Опыт №2.4 Кислородные соединения азота
(Опыты проводятся под тягой!)
Оксид азота (I) Поместить в пробирку 1—2г нитрата аммония, закрыть её пробкой с газоотводной трубкой и осторожно нагреть (см. рис.3). Собрать над водой выделяющийся газ в 2 баночки. В одну — внести ложечку с горящим фосфором, в другую — тлеющую лучинку. Как отличить оксид азота (I) от кислорода?
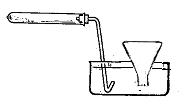
Рис. 3 Прибор для получения оксида азота (I)
Оксид азота (II).
1. Положить в колбу Вюрца (или Энглера) 5г медных стружек и прилить через делительную воронку 30 мл 30%-го раствора азотной кислоты. Если реакция будет идти слабо, следует немного подогреть колбу. Первую промывную склянку необходимо оставить пустой, во вторую налить 10% раствор щелочи (зачем?).
Чем объяснить появление окраски газов в колбе-реакторе? Растворяется ли оксид азота (II) в воде и щелочи?
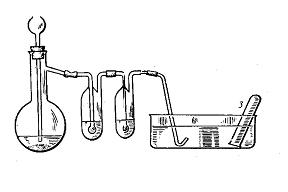
Рис. 4 Прибор для получения оксида азота (II)
2. Собрать оксид азота (II) в 2 колбы (как это сделать?). Испытать, горят ли лучинка и красный фосфор в оксиде азота (II). Что происходит при соприкосновении оксида азота (II) с воздухом? Написать уравнения реакций.
3. Пропустить ток оксида азота (II) через слегка подогретый раствор концентрированной азотной кислоты. Что наблюдается? Написать уравнение реакции.
4. Налить в пробирку 3—5 мл свежеприготовленного насыщенного раствора сульфата железа (II). Пропустить через раствор ток оксида азота (II). Как изменяется окраска раствора? Написать уравнение реакции. Раствор подогреть. Что наблюдается? Как получается оксид азота (II) в промышленности?
|
|
|
Оксид азота (IV)
Положить в колбу Вюрца (или Энглера) 1-2 г медных стружек. Через капельную воронку налить в колбу 5—10 мл концентрированной азотной кислоты (см. рис.5). Первая промывная склянка должна быть пустой (выполняет роль предохранителя), во вторую прилить концентрированную серную кислоту.
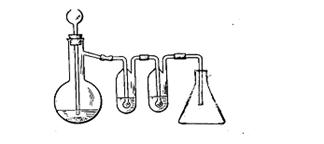
Рис.5 Прибор для получения оксида азота (IV)
Какой газ выделяется? Написать уравнение реакции. Собрать оксид азота (IV) в 2 колбы (как это сделать?) и испытать, горят ли в ней тлеющая лучинка и зажженный фосфор? Написать уравнение реакций. Какие оксиды азота легче отдают кислород?
Опыт №2.5Получение и свойства азотистой кислоты
1. Растворить небольшое количество нитрита натрия или калия в 1-2 мл воды, охладить раствор снегом и прибавить к нему 2—3 капли чистой концентрированной серной кислоты. Что наблюдается? Написать уравнения реакций. Чем объясняется различная прочность азотной и азотистой кислот?
2. Налить в пробирку раствор нитрита калия, подкислить его разбавленной серной кислотой и добавить несколько капель раствора перманганата калия. Что происходит? Написать уравнение реакции. Сделать аналогичный опыт с бихроматом калия. На какие свойства азотистой кислоты указывают эти реакции?
|
|
|
3. К подкисленному раствору йодида калия добавить несколько капель крахмала и раствора нитрита калия. Что наблюдается? Написать уравнение реакции. Проделать аналогичный опыт с бромидом калия, заменив крахмал органическим растворителем. Какую роль играет азотистая кислота в этих реакциях?
Дата добавления: 2018-04-15; просмотров: 1220; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
