Возрастные особенности состава крови
| Показатель | Возраст | ||||||
| 1 день | 1 мес. | 6 мес. | 1 год | 1-6 л | 12 л | 13-15 л | |
| Hb, г/л | 180-240 | 115-175 | 110-140 | 110-135 | 110-140 | 110-145 | 115-150 |
| Er *1012/л | 4,3-7,6 | 3,8-5,6 | 3,5-4,8 | 3,6-4,9 | 3,5-4,5 | 3,5-4,7 | 3,6-5,1 |
| Лейкоциты *109/л | 8,5-24,5 | 6,5-13,5 | 5,5-12,5 | 6,0-12 | 5-12 | 4,5-10 | 4-15 |
| Тромбоциты *109/л | 180-490 | 180-400 | 180-400 | 180-400 | 160-390 | 160-380 | 160-360 |
БЕЛКИ ПЛАЗМЫ КРОВИ
В плазме крови открыто более 200 видов белков, которые составляют 7% объема плазмы. Белки плазмы крови синтезируются в основном в печени и макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках, эндокринных железах. Разрушаются белки плазмы крови печенью, почками, мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких часов до несколько недель.
В плазме крови белки выполняют следующие функции:
- Создают онкотическое давление. Оно необходимо для удержания воды в кровяном русле.
- Участвуют в свертывании крови.
- Образуют буферную систему (белковый буфер).
- Транспортируют в крови плохорастворимые в воде вещества (липиды, металлы 2 и более валентности).
- Участвуют в иммунных процессах.
- Образуют резерв аминокислот, который используется, например, при белковом голодании.
- катализируют некоторые реакции (белки-ферменты).
- Определяют вязкость крови, влияют на гемодинамику.
- Участвуют в реакциях воспаления.
Строение белков плазмы крови
По строению белки плазмы крови являются глобулярными, по составу они делятся на простые (альбумины) и сложные.
|
|
|
Среди сложных, можно выделить липопротеины (ЛПОНП, ЛППП, ЛПНП, ЛПВП, ХМ), гликопротеины (почти все белки плазмы) и металлопротеины (трансферин, церрулоплазмин).
Общее количество белка в плазме крови в норме составляет 70-90 (60-80) г/л, его определяют с помощью биуретовой реакции. Количество общего белка в крови имеет диагностическое значение.
Повышение общего количества белка в плазме крови называется гиперпротеинемия, снижение – гипопротеинемия. Гиперпротеинемия возникает при дегидратации (относительная), травмах, ожогах, миеломной болезни (абсолютная). Гипопротеинемия наступает при спаде отеков (относительная), голодании, патологии печени, почек, кровопотере (абсолютная).
Кроме общего содержания белков в плазме крови также определяют содержание отдельных групп белков или даже индивидуальных белков. Для этого их разделяют с помощью электроэлектрофореза.
Электрофорез – это метод, при котором вещества с различным зарядом и массой, разделяются в постоянном электрическом поле. Электрофорез проводят на различных носителях, при этом получают разное количество фракций. При электрофорезе на бумаге белки плазмы крови дают 5 фракций: альбумины, α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины. При электрофорезе на агаровом геле получается 7-8 фракций, на крахмальном геле – 16-17 фракций. Больше всего фракций – более 30, дает иммуноэлектрофорез.
|
|
|
Белки плазмы можно также разделить с помощью высаливания нейтральными солями щелочных и щелочноземельных металлов (3 фракции: альбумины, глобулины и фибриноген) или осаждения в спиртовом растворе.
| Денситограмма белков сыворотки крови | Электрофореграмма белков сыворотки крови (10 пациентов) |
   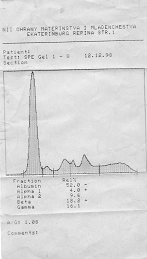
|
 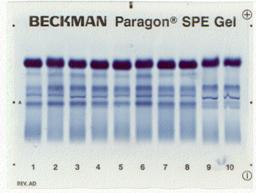
|
Целесообразность разделения белков на фракции связана с тем, что белковые фракции плазмы крови отличаются между собой преобладанием в них белков, с определенными функциями, местом синтеза или разрушения.
Нарушение соотношения белковых фракций плазмы крови называется диспротеинемия. Выявление диспротеинемии имеет диагностическое значение.
Фракции белков плазмы крови
I. Альбумины
Основным белком этой фракции является альбумин.
Альбумин. Простой белок из 585 АК с массой 66кДа, имеет 17 дисульфидных мостиков, много дикарбоновых АК, обладает высокой гидрофобностью. У альбумина наблюдается полиморфизм. Синтезируется в печени (12 г/сут), утилизируется почками, энтероцитами и др. тканями. Т½=20 дней. 60% альбуминов находиться в межклеточном веществе, 40% - в кровяном русле. В плазме альбуминов 40-50г/л, они составляют 60% всех белков плазмы крови.
|
|
|
Функции: поддержание онкотического давления (вклад 80%), транспорт свободных жирных кислот, билирубина, жёлчных кислот, стероидных и тиреоидных гормонов (20% Т4, 11% Т3), ХС, лекарств, неорганических ионов (Cu2+, Ca2+, Zn2+), является источником аминокислот.
Транстиретин (преальбумин). Тетрамер. Молекулярная масса 54 кДа. В плазме 0,25г/л. Белок острой фазы (5 группа). Транспортирует в небольших количествах тироксин (11%), трийодтиронин (9%) и ретинол. Снижается при голодании.
Диспротеинемия альбуминовой фракции реализуется преимущественно за счет гипоальбуминемии.
Причиной гипоальбуминемии является снижение синтеза альбуминов при печеночной недостаточности (цирроз), при повышении проницаемости капилляров, при активации катаболизма вследствие ожогов, сепсисе, опухолях, при потере альбуминов с мочой (нефротический синдром), при голодании.
Гипоальбуминемия вызывает отек тканей, снижение почечного кровотока, активацию РААС, задержку воды в организме и усиление отека тканей. Резкий отток жидкости в ткани приводит к снижению АД и может вызвать шок.
|
|
|
Глобулины.Онисодержат липопротеины и гликопротеины.
II. α1-Глобулины
α1-Антитрипсин - гликопротеин, синтезируемый печенью. В плазме 2,5г/л. Белок острой фазы (2 группа). Важный ингибитор протеаз, в том числе эластаз нейтрофилов, которые разрушают эластин альвеол лёгких и печени. α1-Антитрипсин также ингибирует коллагеназу кожи, химотрипсин, протеазы грибков и лейкоцитов. При дефиците α1-антитрипсина могут возникнуть эмфизема лёгких и гепатит, приводящий к циррозу печени.
Кислый α1- гликопротеин, синтезируется печенью. В плазме 1 г/л. Белок острой фазы (2 группа). Транспортирует прогестерон и сопутствующие гормоны.
ЛПВП синтезируются в печени. В плазме 0,35 г/л. Транспортируют излишки ХС из тканей в печень, обеспечивают обмен других ЛП.
Протромбин - гликопротеид, содержащий около 12% углеводов; белковая часть молекулы представлена одной полипептидной цепью; молекулярная масса около 70000Да. В плазме 0,1 г/л. Протромбин - предшественник фермента тромбина, стимулирующего формирование тромба. Биосинтез протекает в печени и регулируется витамином К, образуемым кишечной флорой. При его недостатке витамина К уровень протромбина в крови падает, что может приводить к кровоточивости (ранняя детская геморрагия, обтурационная желтуха, некоторые болезни печени).
Транскортин - гликопротеин, синтезируемый в печени, масса 55700Да, Т½=5 суток. Переносит кортизол, кортикостерон, прогестерон, 17-альфа-гидроксипрогестерон и, в меньшей степени, тестостерон. В плазме 0,03 г/л. Концентрация в крови чувствительна к экзогенным эстрогенам и зависит от их дозы.
Тироксинсвязывающий глобулин (TBG) -синтезируется в печени. Молекулярная масса 54 кДа. В плазме 0,02 г/л. Т½=5 суток. Он является главным транспортером тироидных гормонов в крови (транспортирует 68% тироксина и 80% трийодтиронина).
Диспротеинемия за счет α1-глобулиной фракции реализуется преимущественно за счет: 1). снижения синтеза α1-антитрипсина. 2). Потере белков этой фракции с мочой при нефротическом синдроме. 3). повышения белков острой фазы в период воспаления.
III. α2-Глобулины
α2-Макроглобулин очень крупный белок (725 кДа), синтезируется в печени. Белок острой фазы (4 группа). В плазме 2,6 г/л. Главный ингибитор множество классов протеиназ плазмы, регулирует свертывание крови, фибринолиз, кининогенез, иммунные реакции. Уровень α2-макроглобулина в плазме уменьшается в острой фазе панкреатита и карциномы простаты, увеличивается - в результате гормонального эффекта (эстрогены).
Гаптоглобин – гликопротеид, синтезируется в печени. В плазме 1 г/л. Белок острой фазы (2 группа). Связывает гемоглобин с образованием комплекса, обладающего пероксидазной активностью, препятствует потери железа из организма. Гаптоглобин эффективно ингибирует катепсины С, В и L, может участвовать в утилизации некоторых патогенных бактерий.
Витамин Д связывающий белок (БСВ) (масса 70кДа). В плазме 0,4 г/л. Обеспечивает транспорта витамина Д в плазме и предотвращает его экскрецию с мочой.
белок, связывающий витамин D (VDB; молекулярный вес = 51243 Да, позиция 17-474, 458 аминокислот, P02774 VTDB_HUMAN), или Gc-глобулин - многофункциональный белок сыворотки крови, синтезируемый в печени. Белок структурно связан с альбумином и имеет сравнимые размеры. Витамин D превращается в печени, а затем в почках в активные метаболиты, перенос которых к тканевым рецепторам витамина D осуществляется Gc-глобулином. Молекула Gc имеет один активный сайт, который связывает D2, D3 и их метаболиты. Преобладающее количество витамина D в крови циркулирует в связанном с VDB состоянии. Показано, что Gc-глобулин является фактором, стимулирующим макрофаги, обладает хемотаксической активностью и может связываться с эндотоксином. Кроме того, Gc-глобулин имеет один участок связывания с актином, образует комплексы с мономерным актином в соотношении 1:1 и тормозит полимеризацию G-актина в F-актин. Актин - внутриклеточный белок, который обладает способностью к полимеризации и может образовывать филаменты (нити). Подвижность и форма клеток зависят от этой способности. При массивном некрозе клеток и разрушении ткани, избыточное выделение актина может привести к существенному уменьшению количества внеклеточных компонентов актиновой системы (скавенджеров). In vivo Gc-глобулин действует как основной «сборщик» актина, возможно, защищая организм от повреждения после цитолиза. В большинстве популяций изменчивость гена Gc выявляется по двум аллелям – Gc2 и Gel. Показано, что при получении с пищей субоптимального количества эргокальциферола (D2) фенотипы Gc коррелируют с наличием или отсутствием рахита, особенно в популяциях с темным цветом кожи. Меланин препятствует проникновению в глубокие слои кожи ультрафиолетовых лучей, поэтому у людей с повышенной пигментацией возник компенсаторный механизм – гиперсекреция сальными железами эргосерина, который под действием ультрафиолетового облучения превращается в витамин D. Затем витамин D проникает вглубь кожи и, достигнув периферических капилляров, связывается с Gc-глобулином и транспортируется в ткани. Показано наличие корреляции между широтой местности, интенсивностью солнечной радиации и частотой аллеля Gc2. Причем географический показатель в большей степени коррелирует с частотой гетерозигот Gc2/1, т.е. в северных широтах гетерозиготы имеют селективные преимущества по сравнению с гомозиготами, по-видимому, за счет их больших адаптивных возможностей по отношению к экстремальным средовым факторам. Gc-актиновые комплексы обычно повышены в сыворотке беременных женщин и у больных с фульминантным некрозом печени. Повышенный уровень был найден у пациентов с гипофосфатемическим витамин D-резистентным и витамин D-зависимым рахитом, гипопаратиреоидизмом. Снижение уровня VDB было обнаружено в образцах сыворотки крови пациентов с высоким риском развития полиорганной недостаточности, например, с травмой, сепсисом и другими состояниями. Клиническое значение маркера: оценка риска развития полиорганной недостаточности при травме, нефротический синдром и др.
Церулоплазмин - главный медьсодержащий белок плазмы (содержит 95% меди в плазмы) с массой 150кДа, синтезируется в печени. В плазме 0,35 г/л. Т½=6 суток. Церулоплазмин обладает выраженной оксидазной активностью; ограничивает освобождение железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, инактивирует активные формы кислорода, предотвращая ПОЛ.
Церулоплазмин - белок острой фазы (3 группа). Он повышается у больных с инфекционными заболеваниями, циррозом печени, гепатитами, инфарктом миокарда, системными заболеваниями, лимфогранулематозом, при злокачественных новообразованиях различной локализации (рак легкого, молочной железы, шейки матки, желудочно-кишечного тракта).
Болезнь Вильсона – Коновалова. Недостаточность церулоплазмина возникает при нарушении его синтеза в печени. При дефиците церулоплазмина Cu2+ уходит из крови, выводятся с мочой или накапливается в тканях (например, в ЦНС, роговице).
Церулоплазмин - это широко распространенный α2-сывороточный гликопротеин, содержащий 95% меди, присутствующей в плазме позвоночных. Церулоплазмин является медь-связывающим белком, который в норме удаляет железо из клеток благодаря своей феррооксидазной активности. Концентрация церулоплазмина в среднем составляет 14.6 (±4.0) мг/дл. Низкий уровень церулоплазмина ведет к патологическому накоплению железа в клетках, включая клетки поджелудочной железы, печени, сетчатки и базальных ганглиев головного мозга. К заболеваниям, ассоциированным со сниженным уровнем церулоплазмина, относят болезнь Вильсона-Коновалова, гемохроматоз, болезнь Менкеса и ацерулоплазминемию.
Антитромбин III. В плазме 0,3 г/л. Антитромбин III действует как ингибитор свертывания крови и является важным индикатором риска образования тромба. Сообщается о снижении уровня антитромбина III при нарушениях функций печени у женщин, принимающих оральные контрацептивы. Низкий уровень антитромбина III также является наследственным аутосомным доминантным признаком
Ретинолсвязывающий белок синтезируется в печени. В плазме 0,04 г/л. Связывает ретинол, обеспечивает его транспорт и предотвращает распад. Функционирует в комплексе с транстиретином. Ретинол связывающий белок фиксирует излишки витамина А, что предотвращает мембранолитическое действие высоких доз витамина.
Ретинол-связывающий белок (RBP) – низкомолекулярный (21 кДа) липокалин, содержащий 8 петель бета-складчатой структуры, специфически связывающий витамин А (ВА) и являющийся транспортным белком витамина A, образующий в крови комплексы с транстиретином/преальбумином, но теряющий свою аффинность к преальбумину после доставки витамина к клеткам-мишеням.
В крови более 90% ВА представлено ретинолом. Печень является не только основным депо ВА, но и главным местом синтеза RBP. Хотя другие ткани (включая жировую ткань, почки, легкие, сердце, скелетные мышцы, селезенку, глаза и тестикулы) также синтезируют этот глобулин. Биосинтез RBP в печени осуществляется на рибосомах. RBP в плазме связан с транстиретином, который функционирует как система транспорта ВА и предотвращает экскрецию RBP с мочой. Период полужизни RBP, связанного с транстиретином, составляет 12 ч, тогда как у свободного белка этот показатель равен 3,5 ч. Подобно другим маленьким белкам (например, β2-микроглобулину), свободные молекулы RBP быстро фильтруются в клубочке и катаболизируются в почечных канальцах после резорбции клетками проксимального отдела. При патологии канальцев эти белки не реабсорбируются и появляются в моче. Комплекс ВА с RBP имеет существенное физиологическое значение: RBP солюбилизирует гидрофобные молекулы ретинола и доставляет его из депо (печень) к органам-мишеням, предохраняет нестабильную свободную форму молекулы ретинола от химического распада (например, ретинол становится устойчивым к окислительному воздействию алкогольдегидрогеназы печени), защищает мембраны от токсического действия ВА. Интоксикация ВА развивается, когда ретинол в плазме и мембранах находится не в комплексе с RBP, а в другой форме. Сетчатка и другие ВА-зависимые ткани-мишени содержат цитозольные рецепторы для комплекса RBP-ВА. Концентрация RBP в плазме крови в нормальных условиях коррелирует с обеспеченностью организма ВА. RBP обычно насыщен на 75%. Депонирование ВА в печени осуществляется только при достаточном поступлении его с пищей и при нормальной концентрации ретинола в крови. Дефицит транспортных белков для ВА, развивающийся при белковой недостаточности, нарушает мобилизацию ретинола из депо и транспорт его к органам-мишеням. Недостаток белка и цинка в рационе уменьшают синтез RBP, оказывая тем самым отрицательное действие на мобилизацию ретинола из печени и выход его в кровь. В этой связи при белковой недостаточности нарушается утилизация даже имеющихся запасов ретинола и развивается так называемый белководефицитный функциональный гиповитаминоз А. Профилактика и лечение его должны проводиться при обязательной коррекции белкового состава рациона. Концентрация белка в плазме возвращается к нормальным величинам параллельно с эффективностью нутриционной поддержки. Скорость снижения в процессе недостаточности питания и скорость повышения при нутриционной поддержке зависит от периода полураспада белка. Хроническая интоксикация кадмием проявляется анемией, разрушением костной ткани и нередко сопровождается развитием прогрессирующего тубулоинтерстициального нефрита. В начале заболевания происходит выделение с мочой специфических низкомолекулярных белков, таких как β2-микроглобулины или RBP, а также кадмия, главным образом, в виде комплекса с белком металлотионенином, который захватывается почками и депонируется в органе (период полувыведения кадмия из организма человека составляет 10-20 лет). Механизм токсического действия металла окончательно не установлен. Дефицит цинка влияет на уровень кадмия и существенно повышает его токсичность. Рекомендуют определять в моче содержание двух видов протеинов, высокомолекулярного (например, альбумина), для распознавания гломерулярной патологии, и низкомолекулярного (например, β2-микроглобулин и RBP), для выявления повреждений проксимальных канальцев. У новорожденных с асфиксией уровень RBP в моче служит показателем, предвосхищающим развитие острой почечной недостаточности. Согласно опубликованным данным (например, Yang et al., 2005) ретинол-связывающий белок 4 (RBP4) играет ключевую роль в развитии инсулинорезистентности. RBP адипоцитов также модулирует гомеостаз глюкозы и снижает чувствительность к инсулину, и изменяет инсулинорезистентность. Повышение уровня RBP4 в сыворотке приводит к инсулинорезистентности, тогда как его снижение усиливает действие инсулина. Сделан вывод о том, что RBP4 изменяет чувствительность к инсулину, влияя на инсулиновый сигналинг в мышцах путем изменения количества фосфорилированного тирозина. Так, RBP4 может участвовать в патогенезе диабета 2 типа, и снижение уровня RBP4 может быть новой стратегией терапии этого заболевания. Показания: раннее обнаружение тубулярной протеинурии, хронические заболевания печени, почечные нарушения, связанные с отравлением Cd, исследование инсулинорезистентности.
Диспротеинемия за счет α2-глобулиной фракции может возникать при воспалении, т.к. в этой фракции содержатся белки острой фазы.
IV. β-Глобулины
ЛПОНП - образуются в печени. Транспорт ТГ, ХС.
ЛППП - образуются в крови из ЛПОНП. Транспорт ТГ, ХС.
ЛПНП – образуются в крови из ЛППП. В плазме 3,5 г/л. Транспортируют излишки ХС из периферических органов в печень.
Трансферрин – гликопротеин, синтезируется печенью. В плазме 3 г/л. Т½=8 суток. Главный транспортер железа в плазме, 1 молекула трансферрина связывает 2 Fe3+, а 1г трансферрина соответственно около 1,25 мг железа. При снижении концентрации железа синтез трансферрина возрастает. Белок острой фазы (5 группа). Снижается при печеночной недостаточности.
Белок плазмы крови, гликопротеин - основной переносчик железа. Синтез трансферрина осуществляется в печени и зависит от ее функционального состояния, от потребности в железе и резервов железа в организме. При снижении концентрации железа синтез трансферрина возрастает. Трансферрин участвует в транспорте железа от места его всасывания (тонкая кишка) до основных мест его использования или хранения (костный мозг, печень, селезенка), препятствуя накоплению токсичных ионов железа в крови.
При разрушении эритроцитов в селезёнке, печени и костном мозге Трансферрин транспортирует железо, высвобождаемое из гема, в костный мозг; где часть железа депонируется, включаясь в состав ферритина и гемосидерина. Одна молекула трансферрина связывает два иона трехвалентного железа, а 1 г трансферрина - около 1,25 мг железа, исходя из чего можно определить общее количество железа, которое может связать сывороточный трансферрин. Оно приближается к величине общей железосвязывающей способности сыворотки крови (ОЖСС). В диагностике используют расчетную величину - % насыщения трансферрина железом (отношение концентрации сывороточного железа к максимальной железосвязывающей способности трансферрина сыворотки, выраженное в процентах).
В норме процент насыщения трансферрина железом составляет около 30%, при недостаточном поступлении железа в организм этот показатель снижается. Избыток железа, сопровождающийся значительным увеличением процента насыщения трансферрина железом, может вызывать патологию печени и селезенки.
Определение уровня трансферрина используют главным образом в дифференциальной диагностике железодефицитных анемий, характеризующихся снижением содержания сывороточного железа, ростом уровня трансферрина и, соответственно, снижением процента насыщения трансферрина железом. Содержание трансферрина у женщин на 10% выше, чем у мужчин. В третьем триместре беременности концентрация трансферрина в сыворотке крови может повыситься на 50%. Концентрация этого белка снижается у пожилых людей. При воспалении трансферрин проявляется как негативный белок острой фазы (его концентрация при острофазном ответе на воспаление уменьшается).
Показания к назначению анализа:
1. Дифференциальная диагностика анемий.
2. Тяжелые инфекции, паразитарные инвазии.
3. Опухоли.
4. Подозрение на гемохроматоз.
Фибриноген гликопротеин, синтезируется в печени. Молекулярная масса 340кДа. В плазме 3 г/л. Т½=100часов. Фактор I свёртывания крови, способен под действием тромбина превращаться в фибрин. Является источником фибринопептидов, обладающих противовоспалительной активностью. Белок острой фазы (2 группа). Содержание фибриногена увеличивается при воспалительных процессах и некрозе тканей. Снижается при ДВС синдроме, печеночной недостаточности. Фибриноген основной белок плазмы, влияющий на величину СОЭ (с повышением концентрации фибриногена скорость оседания эритроцитов увеличивается).
Фибриноген (FBG) - это гомодимер с молекулярной массой 340 кДа, состоящий из двух наборов α-, β- и γ-полипептидных цепей, синтезируется в паренхимальных клетках гепатоцитов и в мегакариоцитах. FBG играет основную роль в процессе свертывания крови. И повышение, и снижение его уровня имеют клиническое значение. После расщепления тромбином на начальной стадии активации коагуляции происходит полимеризация FBG в фибрин. Фибрин самоорганизуется в матрикс фибриновых сгустков и затем сшивается поперечными сшивками фактором XIIIa в нерастворимую сеть волокон фибрина,. FBG также связывается с гликопротеиновым рецептором IIbIIIa тромбоцитов, таким образом, образуя мостики между тромбоцитами, что облегчает их агрегацию. Показано, что повышенный уровень FBG в плазме является независимым фактором риска развития атеросклероза и ИБС. У лиц с наследственным отсутствием FBG - афибриногенемией время кровотечения увеличено.
С-реактивный белок синтезируется преимущественно в гепатоцитах, его синтез инициируется антигенами, иммунными комплексами, бактериями, грибами, при травме (через 4-6 ч после повреждения). Может синтезироваться эндотелиоцитами артерий. В плазме <0,01 г/л. Белок острой фазы (1 группа). Способен связывать микроорганизмы, токсины, частицы поврежденных тканей, препятствуя тем самым их распространению. Эти комплексы активируют комплемент по классическому пути, стимулируя процессы фагоцитоза и элиминации вредных продуктов. С-реактивный белок может взаимодействовать с Т-лимфоцитами, фагоцитами и тромбоцитами, регулируя их функции в условиях воспаления. Обладает антигепариновой активностью, при повышении концентрации ингибирует агрегацию тромбоцитов. СРБ - это маркер скорости прогрессирования атеросклероза. Определяют для диагностики миокардитов, воспалительных заболеваний клапанов сердца, воспалительные заболевания различных органов.
С-реактивный белок (CRP, C-РБ), сывороточный белковый компонент амилоида и пентраксин 3 являются членами семьи пентраксинов. Они - классические белки острой фазы. Уровень CRP повышен в случае воспаления и некроза тканей. Рост при воспалении может достигать 1000-кратного уровня от нормального диапазона значений. С-РБ является ключевым параметром мониторинга эффективности антибактериальной терапии новорожденных с подозрением на бактериальную инфекцию. (Ehl S.: Pediatrics 99,1997 and Benitz W.: Pediatrics 102,1998). Высокая концентрации CRP (> 4 мг/дл) может исключить вирусную инфекцию в качестве единственного этиологического агента инфекции дыхательных путей у детей (Korrpi M.: Scand J Infect Dis 25, 1993). Также CRP - очень чувствительный инструмент для ранней диагностики бактериальной инфекции после операции на кости (Waleczek H.: Chirurg 62, 1991). Повреждение эндотелиальных и гладкомышечных клеток стенки артерий является субклиническим воспалительным процессом. Следовательно, слабое или умеренное повышение уровня СРБ связано с атеросклеротическими процессами. Высокочувствительное измерение CRP в качестве прогностического маркера может быть полезно для контроля развития ишемической болезни сердца (Haverkate F.: The Lancet 349, Feb. 1997). Метод Immuno LEIA® CRP Over All Range комбинирует возможность измерения СРБ в "высокочувствительном" диапазоне, которое имеет диагностическое значение для оценки субклинического воспаления в артериях, а также в диапазоне концентраций, которые наблюдаются в результате острого воспаления. В данном методе антитела к CRP, связанные с латексными частицами, формируют иммунные комплексы с антигеном CRP, находящимся в образце. При этом пропорционально концентрации антигена изменяется мутность раствора, которую можно измерить фотометрически с помощью турбидиметра или нефелометра с использованием стандартной кривой, построенной по стандартам с известной концентрацией.
Диспротеинемия за счет β-глобулиной фракции может возникать при 1). некоторых дислипопротеинемиях; 2). воспалении, т.к. в этой фракции содержатся белки острой фазы; 3). При нарушении свертывающей системы крови.
V. γ-Глобулины
Синтезируются функционально активными В-лимфоцитами (плазмоцитами). У взрослого человека 107 клонов В-лимфоцитов которые синтезируют 107 видов γ-глобулинов. γ-Глобулины гликопротеины, состоят 2 тяжелых (440 АК) и 2 легких (220 АК) полипептидных цепей различной конфигурации, которые соединяются между собой дисульфидными мостиками. Антитела гетерогенны, отдельные составные части полипептидов кодируются разными генами, с различной способностью к мутированию.
Все γ-глобулины разделены на 5 классов G,A,M,D,E. В каждом классе выделяют несколько подклассов.
Диспротеинемия за счет γ-глобулиной фракции может возникать при 1). Иммунодефицитом состоянии; 3). Инфекционных процессах. 2). Нефротическом синдроме.
Белки острой фазы воспаления
Понятие "белки острой фазы" объединяет до 30 белков плазмы крови, участвующих в реакции воспалительного ответа организма на повреждение. Белки острой фазы синтезируются в печени, их концентрация существенно изменяется и зависит от стадии, течения заболевания и массивности повреждения.
Синтез белков острой фазы воспаления в печени стимулируют: 1). ИЛ-6, 2); ИЛ-1 и сходные с ним по действию (ИЛ-1 а, ИЛ-1Р, факторы некроза опухолей ФНО-ОС и ФНО-Р); 3). Глюкокортикоиды; 4). Факторы роста (инсулин, факторы роста гепатоцитов, фибробластов, тромбоцитов).
Выделяют 5 групп белков острой фазы
1. К «главным» белкам острой фазы у человека относят С-реактивный белок (СРВ) и амилоидный А белок сыворотки крови. Уровень этих белков возрастает при повреждении очень быстро (в первые 6-8 часов) и значительно (в 20-100 раз, в отдельных случаях - в 1000 раз).
2. Белки, концентрация которых при воспалении может увеличиваться в 2-5 раз в течение 24 часов. Это кислый α1-гликопротеид, α1-антитрипсин, фибриноген, гаптоглобин.
3. Белки, концентрация которых при воспалении или не изменяется или повышается незначительно (на 20-60% от исходного). Это церулоплазмин, С3-компонент комплемента.
4. Белки, участвующие в острой фазе воспаления, концентрация которых, как правило, остается в пределах нормы. Это α1-макроглобулин, гемопексин, амилоидный Р белок сыворотки крови, иммуноглобулины.
5. Белки, концентрация которых при воспалении может снижаться на 30-60%. Это альбумин, трансферрин, ЛПВП, преальбумин. Уменьшение концентрации отдельных белков в острой фазе воспаления может быть обусловлено снижением синтеза, увеличением потребления, либо изменением их распределения в организме.
Целый ряд белков острой фазы обладает антипротеазной активностью. Это α1-антитрипсин, антихимотрипсин, α2-макроглобулин. Их важная функция состоит в ингибировании активности эластазоподобных и химотрипсиноподобных протеиназ, поступающих из гранулоцитов в воспалительные экссудаты и вызывающих вторичное повреждение тканей. Снижение уровней ингибиторов протеиназ при септическом шоке или остром панкреатите является плохим прогностическим признаком.
Парапротеинемия – появление в плазме крови нехарактерных белков.
Например, во фракции α-глобулинов может появиться α-фетоглобулин, карциноэмбриональный антиген.
α-Фетоглобулин — один из фетальных антигенов, которые циркулируют в крови примерно у 70% больных с первичной гепатомой. Этот антиген выявляется также у пациентов с раком желудка, предстательной железы и примитивными опухолями яичка.
Карциноэмбриональный антиген (КЭА) — гликопротеид, опухолевый антиген, характерный в норме для кишечника, печени и поджелудочной железы плода. Антиген появляется при аденокарциномах органов ЖКТ и поджелудочной железы, в саркомах и лимфомах, также обнаруживается при целом ряде неопухолевых состояний: при алкогольном циррозе печени, панкреатите, холецистите, дивертикулите и язвенном колите.
ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ
Ферменты, находящиеся в плазме крови, можно разделить на 3 основные группы:
1. Секреторные. Они синтезируются в печени, эндотелии кишечника, сосудов поступают в кровь, где выполняют свои функции. Например, ферменты свертывающей и противосвертывающей системы крови (тромбин, плазмин), ферменты обмена липопротеинов (ЛХАТ, ЛПЛ).
2. Тканевые. Ферменты клеток органов и тканей. Они попадают в кровь при увеличении проницаемости клеточных стенок или при гибели клеток тканей. В норме их содержание в крови очень низкое. Некоторые тканевые ферменты имеют диагностическое значение, т.к. по ним можно определить пораженный орган или ткань, по этому их еще называют индикаторными. Например, ферменты ЛДГ с 5 изоформами, креатинкиназа с 3 изоформами, АСТ, АЛТ, кислая и щелочная фосфатаза и т.д.
3. Экскреторные. Ферменты, синтезируемые железами ЖКТ (печень, поджелудочная железа, слюнные железы) в просвет ЖК тракта и участвующие в пищеварении. В крови эти ферменты появляются при повреждении соответствующих желез. Например, при панкреатите в крови обнаруживают липазу, амилазу, трипсин, при воспалении слюнных желез – амилазу, при холестазе – щелочную фосфатазу (из печени).
| Фракция | Белки | Конц г/л | Функция |
| альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | 40 | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | |
| α1-глобулины | α1-антитрипсин | 2,5 | Ингибитор протеиназ |
| Кислый α1- гликопротеин | 1 | Транспорт прогестерона | |
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | 1 | Связывание гемоглобина | |
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязывающий белок | 0,04 | Транспорт ретинола | |
| Витамин Д связывающий белок | 0,4 | Транспорт кальциферола | |
| β-глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | 3 | Транспорт ионов железа | |
| Фибриноген | 3 | Фактор I свёртывания крови | |
| Транскобаламин | 25*10-9 | Транспорт витамина В12 | |
| Глобулин связывающий белок | 20*10-6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок | <0,01 | Активация комплемента | |
| γ-глобулины | IgG | 12 | Поздние антитела |
| IgA | 3,5 | Антитела, защищающие слизистые оболочки | |
| IgM | 1,3 | Ранние антитела | |
| IgD | 0,03 | Рецепторы В-лимфоцитов | |
| IgE | <0,01 | Реагин |
ЛЕКЦИЯ № 23
Тема: Биохимия крови 2.
Дата добавления: 2018-04-04; просмотров: 302; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
