Классификация сложных белков
Сложныебелки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого про-стетической группой. При гидролизе сложных белков, помимо свободных аминокислот, освобождается небелковая часть или продукты ее распада.
Простые белки в свою очередь делятся на основании некоторых условно выбранных критериев на ряд подгрупп: протамины, гистоны, альбумины, глобулины, проламины, глютелины и др. Классификация сложныхбелков (см. главу 2) основана на химической природе входящего в их состав небелкового компонента. В соответствии с этим различают фосфопротеины (содержат фосфорную кислоту), хромопротеины (в состав их входят пигменты), нуклеопротеины (содержат нуклеиновые кислоты), гликопротеины (содержат углеводы),липопротеины (содержат липиды) и металлопротеины (содержат металлы). С учетом особенностей структуры белки подразделяются на простые (построены только из аминокислот) и сложные (кроме белковой части -апопротеина, - имеют в своем составе небелковую простетическую группу). В зависимости от строения последней выделяют следующие группы
сложных белков:
1. Нукпеопротеиды - содержат нуклеиновые кислоты (ДНК и РНК).
2. Гликопротеиды — включают углеводы и их производные.
3. Липопротеиды - содержат в составе липиды (жироподобные вещества).
4. Хромопротеиды - содержат окрашенные вещества (пигменты).
5. Фосфопротеиды - содержат остатки фосфорной кислоты.
6. Витаминопротеиды.
7. Металлопротеиды.
Значимые для организма человека и животных белки по своим структурно-функциональным признакам традиционно разделяются на несколько групп:
• Протамины и гистоны - имеют щелочной характер (в составе много аргинина и лизина), входят в состав нуклеопротеидов и в основном локализуются в ядрах клеток.
• Альбумины и глобулины - нейтральные глобулярные белки, синтезируются в печени и иммунных клетках. Содержатся в плазме крови (альбумины - 35-50 г/л, глобулины - 15-40 г/л); отличаются по растворимости, молекулярной массе (альбумины - 67 кД, глобулины - до 1500 кД) и электрофоретической подвижности. При электрофорезе в слабощелочной среде (рН=8,6) белки сыворотки крови разделяются на фракции альбуминов (50-65 %), ai-глобулинов (5-7 %), осг-глобулинов (6-9 %), (3-глобулинов (8-14 %) и у-глобулинов (12-20 %). Альбумины поддержи-вают онкотическое давление крови, выполняют транспортную и антитоксическую функцию; биологическая роль разных глобулинов - в основном транспортная (связывание и перенос различных веществ) и защитная (иммуноглобулины - антитела, система комплемента и др.).
• Проламины и глютелины - содержатся в клейковине злаковых растений, имеют в основном пищевое значение; в составе много аспарагино-вой и глутаминовой кислот.
• Протеиноиды - шютноупакованные белки, нерастворимые в воде; в состав входит 12-13 типов аминокислот. В желудочно-кишечном тракте они перевариваются медленно или совсем не перевариваются; их основные функции - покровные и опорные.
|
|
|
|
|
|
Цикл Кребса
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбо-новых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом, цикл Кребса – общий конечный путь окисленияацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот иаминокислот.
Образовавшийся в результате окислительного декарбоксилированияпирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьмипоследовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двухдекарбоксилирований (отщепление СО2) теряет два углеродныхатома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекулаокса-лоацетата регенерируется. Рассмотрим все восемьпоследовательных реакций (этапов) цикла Кребса.
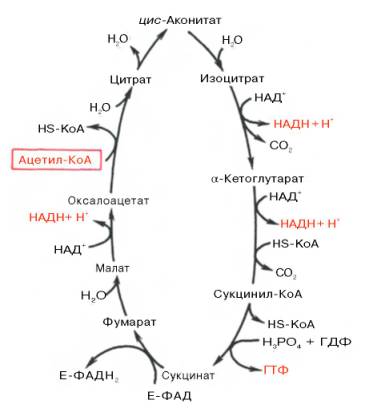 Рис. 10.9. Цикл трикарбоновых кислот (цикл Кребса).
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
Рис. 10.9. Цикл трикарбоновых кислот (цикл Кребса).
Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
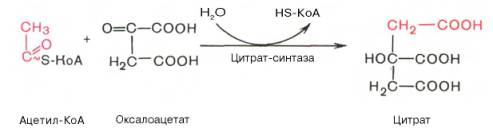 По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментомцитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
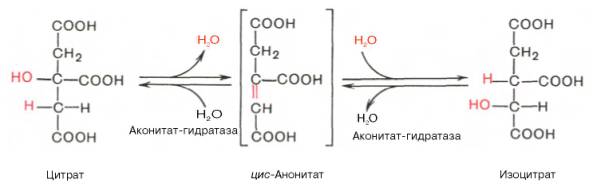
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации ферментаконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментомцитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации ферментаконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
 Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы.
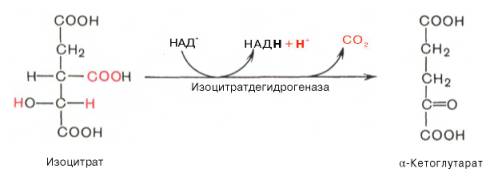 В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активностинуждается в ионах Mg2+или Мn2+.
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковымреакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.
В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активностинуждается в ионах Mg2+или Мn2+.
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковымреакции окислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.
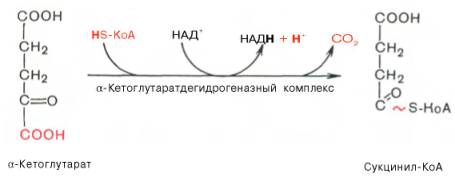 Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
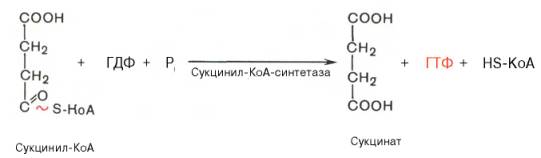 В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцинатакатализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан коферментФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцинатакатализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан коферментФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
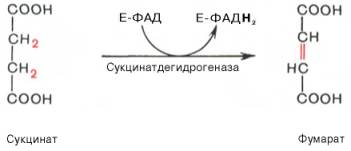 Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:
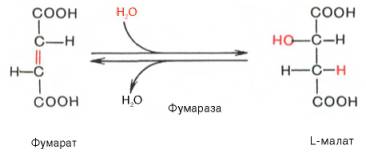 Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
 Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полноеокисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов вдыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребсасинтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекулеАТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующегоокисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилированиипирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а приокислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются приокислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулыНАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что самимолекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат.Реакция катализи-
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полноеокисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов вдыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9молекул АТФ (см. главу 9). Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребсасинтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекулеАТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилирования может образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующегоокисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилированиипирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а приокислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются приокислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо отметить, что образовавшиеся в процессе превращения глицеральдегид-3-фосфата 2 молекулыНАДН в дальнейшем при окислении могут давать не 6 молекул АТФ, а только 4. Дело в том, что самимолекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма (рис. 10.10). Ци-топлазматический НАДН сначала реагирует с цитоплазматическим ди-гидроксиацетонфосфатом, образуя глицерол-3-фосфат.Реакция катализи-
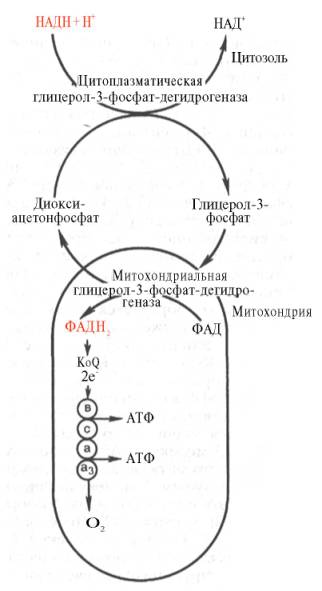 Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н+ <=> Глицерол-3-фосфат + НАД+.
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутримитохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД <=> Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н+. Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н+), вводимая вдыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
руется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н+ <=> Глицерол-3-фосфат + НАД+.
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутримитохондрии другая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД <=> Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиаце-тонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н+. Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н+), вводимая вдыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.
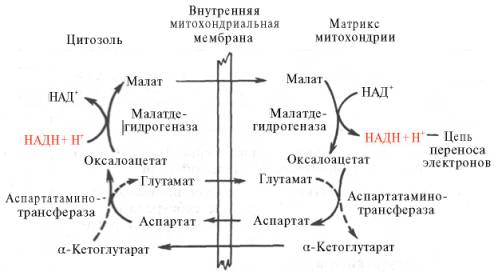 Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н+ в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н+ восстановленные эквиваленты сначала при участии ферментамалатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннююмембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД+восстанавливается в НАДН + Н+, который может теперь передавать свои электроны в цепь дыхательныхферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД+ в цитозоле гли-церальдегид-3-фосфатом, образующимся прикатаболизме глюкозы.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулыглюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н+ в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н+ восстановленные эквиваленты сначала при участии ферментамалатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннююмембрану митохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД+восстанавливается в НАДН + Н+, который может теперь передавать свои электроны в цепь дыхательныхферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД+ в цитозоле гли-церальдегид-3-фосфатом, образующимся прикатаболизме глюкозы.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулыглюкозы может образоваться не 36, а 38 молекул АТФ (табл. 10.1).
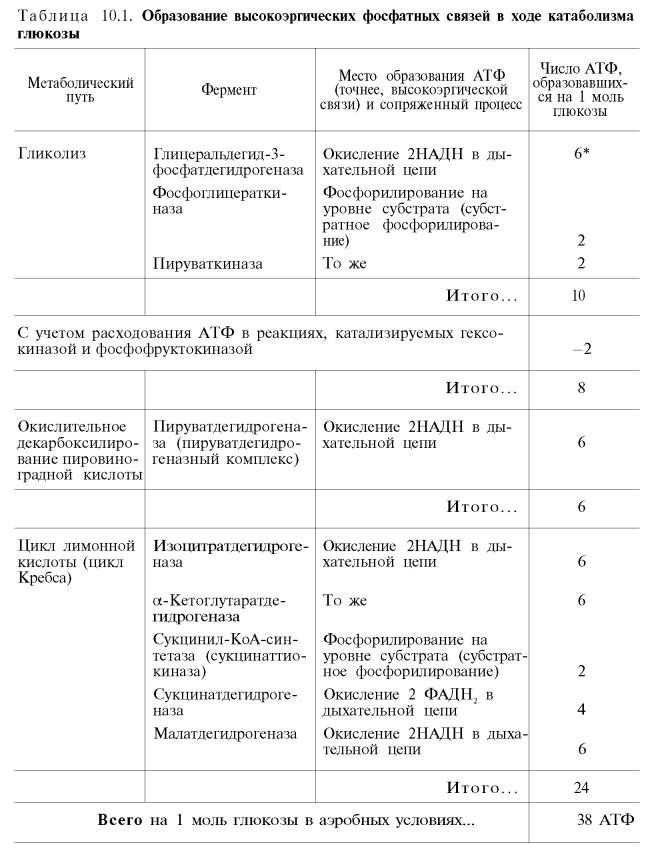 В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
36)Гормоны регулирующие обмен углеводов
Гормон
Действие гормона
Изменение секреции гормона при мышечной деятельности средней тяжести
Тироксин или тетрайодтиронин
Усиливает процессы окисления жиров, углеводов и белков в клетках, ускоряя, таким образом, обмен веществ в организме. Повышает возбудимость центральной нервной системы.
Практически не меняется.
Инсулин
Облегчает проникание сахара из крови в клетки мышц и жировой ткани, облегчает проникновение аминокислот из крови в клетки, способствует синтезу белка и жиров. Способствует отложению глюкозы в запас (в печени).
В начале работы - увеличивается, облегчая проникновение глюкозы в клетки, а затем - снижается, так как вызывает изменения, противоположные тем, которые необходимы для эффективной мышечной деятельности.
Глюкагон
Оказывает действие, во многом противоположное инсулину. Усиливает распад цепочек глюкозы в клетках и выход глюкозы из мест ее хранения в кровь. Стимулирует распад жира в жировой ткани.
Увеличивается, обеспечивая распад и выход в кровь углеводов и жиров, дающих энергию для мышечного сокращения.
Тироксин или тетрайодтиронин
Усиливает процессы окисления жиров, углеводов и белков в клетках, ускоряя, таким образом, обмен веществ в организме. Повышает возбудимость центральной нервной системы.
Практически не меняется.
Трийодтиронин
Действие во многом аналогично тироксину.
Практически не меняется.
Тирокальцитонин
Регулирует обмен кальция в организме, снижая его содержание в крови, и увеличивая его содержание в костной ткани (оказывает действие, обратное паратгормону паращитовидных желез). Снижение уровня кальция в крови уменьшает возбудимость центральной нервной системы.
Повышается при значительном утомлении, наступающем при выполнении длительной мышечной деятельности.
37) Энергетика аэробного превращения глюкозы.
При аэробном превращении глюкозы в конечном счете образуется углекислый газ и вода.
Энергетика -38 молекул АТФ. Условно аэробное превращение глюкозы можно разбить на 3 основых этапа:
1. Переход глюкозы в ПВК.
2. Переход с ПВК в активный ацетил (активная уксусная кислта, ацетил-коэнзим А, ацетил КоА)
3. Включает распад активного ацетила в цикле Креба (находится в центре всех обменных процессов)
1.Протекает так же как и гликолиз, до образования ПВК. Отличается(анаэр. и аэроб.) проц. на данном участке энергетикой. В случае гликолиза образуется 2 молекулы АТФ. В случае аэробного на данном участке образуется 8 молекул АТФ, котор складыв из 2 молекул АТФ гликолиза + 6 молекул АТФ, образовывется путем окислительного фосфорилирования. Т.к на участке образования 1,3 дифосфоглицер. к-ты восст. 2 молекулы НАДН2, которые являются началом двум цепочкам боилогического окисления с НАДН2вод. и эн. переброски на кислород с выделением энергии в виде АТФ 1-3,2-6 АТФ.
2.
В табл. 10.1 приведены реакции, в которых происходит образование высокоэргических фосфатных связей в ходе катаболизма глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.
36)Гормоны регулирующие обмен углеводов
Гормон
Действие гормона
Изменение секреции гормона при мышечной деятельности средней тяжести
Тироксин или тетрайодтиронин
Усиливает процессы окисления жиров, углеводов и белков в клетках, ускоряя, таким образом, обмен веществ в организме. Повышает возбудимость центральной нервной системы.
Практически не меняется.
Инсулин
Облегчает проникание сахара из крови в клетки мышц и жировой ткани, облегчает проникновение аминокислот из крови в клетки, способствует синтезу белка и жиров. Способствует отложению глюкозы в запас (в печени).
В начале работы - увеличивается, облегчая проникновение глюкозы в клетки, а затем - снижается, так как вызывает изменения, противоположные тем, которые необходимы для эффективной мышечной деятельности.
Глюкагон
Оказывает действие, во многом противоположное инсулину. Усиливает распад цепочек глюкозы в клетках и выход глюкозы из мест ее хранения в кровь. Стимулирует распад жира в жировой ткани.
Увеличивается, обеспечивая распад и выход в кровь углеводов и жиров, дающих энергию для мышечного сокращения.
Тироксин или тетрайодтиронин
Усиливает процессы окисления жиров, углеводов и белков в клетках, ускоряя, таким образом, обмен веществ в организме. Повышает возбудимость центральной нервной системы.
Практически не меняется.
Трийодтиронин
Действие во многом аналогично тироксину.
Практически не меняется.
Тирокальцитонин
Регулирует обмен кальция в организме, снижая его содержание в крови, и увеличивая его содержание в костной ткани (оказывает действие, обратное паратгормону паращитовидных желез). Снижение уровня кальция в крови уменьшает возбудимость центральной нервной системы.
Повышается при значительном утомлении, наступающем при выполнении длительной мышечной деятельности.
37) Энергетика аэробного превращения глюкозы.
При аэробном превращении глюкозы в конечном счете образуется углекислый газ и вода.
Энергетика -38 молекул АТФ. Условно аэробное превращение глюкозы можно разбить на 3 основых этапа:
1. Переход глюкозы в ПВК.
2. Переход с ПВК в активный ацетил (активная уксусная кислта, ацетил-коэнзим А, ацетил КоА)
3. Включает распад активного ацетила в цикле Креба (находится в центре всех обменных процессов)
1.Протекает так же как и гликолиз, до образования ПВК. Отличается(анаэр. и аэроб.) проц. на данном участке энергетикой. В случае гликолиза образуется 2 молекулы АТФ. В случае аэробного на данном участке образуется 8 молекул АТФ, котор складыв из 2 молекул АТФ гликолиза + 6 молекул АТФ, образовывется путем окислительного фосфорилирования. Т.к на участке образования 1,3 дифосфоглицер. к-ты восст. 2 молекулы НАДН2, которые являются началом двум цепочкам боилогического окисления с НАДН2вод. и эн. переброски на кислород с выделением энергии в виде АТФ 1-3,2-6 АТФ.
2.  38) Роль аминокислот в биосинтезе фосфолипидов
Принимают участие ам/к-ты: серин и матионин. Начинается биосинтез фосфолипидов так же как 3-глицеридов до образования фосфотивной кислоты.
38) Роль аминокислот в биосинтезе фосфолипидов
Принимают участие ам/к-ты: серин и матионин. Начинается биосинтез фосфолипидов так же как 3-глицеридов до образования фосфотивной кислоты.

 39.Особенности переваривания жиров жвачных животных
Биологической особенностью жвачных животных является то, что потребляют много растительных кормов, в том числе грубых, которые содержат большое количество трудно переваримой клетчатки. Благодаря наличию в содержимом рубца многочисленной микрофлоры (бактерий, инфузорий и грибков) растительные корма подвергаются очень сложной ферментативной и другой обработке. Количество и видовой состав микроорганизмов в рубце у животных зависит от ряда факторов, из которых условия кормления играют первостепенную роль. При каждой смене рациона кормления в рубце одновременно меняется и микрофлора, поэтому для жвачных животных особое значение имеет постепенный переход от одного вида рациона к другому. Роль инфузорий в рубце сводится к механической обработке корма и синтезу собственных белков. Они разрыхляют и разрывают клетчатку так, что клетчатка в дальнейшем становится более доступной для действия ферментов и бактерий. Под действием целлюлозолитических бактерий в преджелудках расщепляется до 70% переваримой клетчатки, из 75% перевариваемых здесь сухих веществ корма. В рубце под влиянием микробной ферментации образуется большое количество летучих жирных кислот — уксусной, пропионовой и масляной, а также газы -углекислый, метан и др. За сутки в рубце коровы образуется до 4л летучих жирных кислот, а соотношение их напрямую зависит от состава рациона. Летучие жирные кислоты почти полностью всасываются в преджелудках и являются для организма животного источником энергии, а также используются для синтеза жира и глюкозы. При поступлении в сычуг микроорганизмы под воздействием соляной кислоты погибают. В кишечнике под воздействием амилолитических ферментов они перевариваются до глюкозы. 40−80% поступившего с кормом протеина (белок) в рубце подвергается гидролизу и другим превращениям, расщепляется микробами до пептидов, аминокислот и аммиака, из поступающего в рубец небелкового азота также образуются аминокислоты и аммиак. Одновременно с процессами расщепления растительного протеина в рубце происходит синтез бактериального белка и белка простейших. Для этой цели в практической деятельности используется и небелковый азот (карбомид и др). В рубце за сутки может синтезироваться от 100 до 450 грамм микробного белка. В дальнейшем бактерии и инфузории с содержимым рубца попадают в сычуг и кишечник, где перевариваются до аминокислот, здесь же происходит переваривание жиров и превращение каротина в витамин А. За счет белка микроорганизмов жвачные животные способны удовлетворять до 20−30% потребностей организма в белке. В рубце животных имеющиеся там микроорганизмы синтезируют аминокислоты, в т.ч. и незаменимые.
Наряду с расщеплением и синтезом белка в рубце происходит всасывание аммиака, который в печени превращается в мочевину. В тех случаях, когда в рубце образуется большое количество аммиака, печень не в состоянии превратить его весь в мочевину, происходит повышение его концентрации в крови, что приводит к появлению у животного клинических признаков токсикоза.
Липолитические ферменты микроорганизмов в рубце гидролизуют жиры корма до глицерина и жирных кислот, а потом в стенке рубца синтезируются вновь.
Имеющаяся в рубце микрофлора синтезирует витамины: тиамин, рибофлавин, пантотеновую кислоту, пиридоксин, никотиновую кислоту, биотин, фолиевую кислоту, кобаламин, витамин К в количествах, практически обеспечивающих основные потребности взрослых животных.
40) Биологическое окисление(тканевое дыхание)
Биологическое окисление- совокупность реакций окисления, проникающие в клетки живого организма.
Сущность биологического окисления заключается в обеспечении организма энергией, которая будет затрачиваться на реакции синтеза взаимопревращения веществ, мышечную работу, поддержание терморегуляции. Источником энергии являются продукты питания, содержащие пищ. белки, жиры, углеводы. Они попадают в жел/киш тракт, под действием гидролитических фертментов распадаются на более простые соед. которые далее попадаютв клетки тканей.
В каждой клетке находятся сложные ферментные системы:
В-окисление
Цикл Кребса
Гликолиз
С помощью которых поступившие в клетку вещества видоизменяются с уелью приобретения форм более доступных для окисления. Сам процесс оксиления под действием молекул кислорода получ. название бтол. окисление. При окислении углеводов и липидов в конечном итоге образуется СО2 и Н2О.
При окислении продуктов гидролиза белков, т.е ам/к-т кроме СО2 и Н2О образ-ся аммиак NH3,мочевина и мочевая кислота, т.к при окислении белков, жиров и углеводов вне организма (при горении), обр-ся практически те же конеч. продукты, как при биол. окислении кроме мочевины и м.к-ты) поэтому биологическое окисление с давних пор сравнивают с горением.
Отличия:
1. При горении основная масса энергии выделяется в виде тепла.
2. При биологическом окислении масса энергии выдел в виде хим. энергии, кот. запас. в фосфатных связях макроэргич. соед-й.
3. При горении энерго окисление углерода, молек О2 с образованием СО2.
4. При биол. энергообразовании явл окисление водорода, окисление субстрата, молек. кислорода в образов. воды,а СО2 в жив. организме образ. только в результате реакции декарбоксилирования
90% всех связей энергии, которая образуется при биологическом окислении запас. в фосфатных связях АТФ.
41.Роль воды в процессе обмена веществ
39.Особенности переваривания жиров жвачных животных
Биологической особенностью жвачных животных является то, что потребляют много растительных кормов, в том числе грубых, которые содержат большое количество трудно переваримой клетчатки. Благодаря наличию в содержимом рубца многочисленной микрофлоры (бактерий, инфузорий и грибков) растительные корма подвергаются очень сложной ферментативной и другой обработке. Количество и видовой состав микроорганизмов в рубце у животных зависит от ряда факторов, из которых условия кормления играют первостепенную роль. При каждой смене рациона кормления в рубце одновременно меняется и микрофлора, поэтому для жвачных животных особое значение имеет постепенный переход от одного вида рациона к другому. Роль инфузорий в рубце сводится к механической обработке корма и синтезу собственных белков. Они разрыхляют и разрывают клетчатку так, что клетчатка в дальнейшем становится более доступной для действия ферментов и бактерий. Под действием целлюлозолитических бактерий в преджелудках расщепляется до 70% переваримой клетчатки, из 75% перевариваемых здесь сухих веществ корма. В рубце под влиянием микробной ферментации образуется большое количество летучих жирных кислот — уксусной, пропионовой и масляной, а также газы -углекислый, метан и др. За сутки в рубце коровы образуется до 4л летучих жирных кислот, а соотношение их напрямую зависит от состава рациона. Летучие жирные кислоты почти полностью всасываются в преджелудках и являются для организма животного источником энергии, а также используются для синтеза жира и глюкозы. При поступлении в сычуг микроорганизмы под воздействием соляной кислоты погибают. В кишечнике под воздействием амилолитических ферментов они перевариваются до глюкозы. 40−80% поступившего с кормом протеина (белок) в рубце подвергается гидролизу и другим превращениям, расщепляется микробами до пептидов, аминокислот и аммиака, из поступающего в рубец небелкового азота также образуются аминокислоты и аммиак. Одновременно с процессами расщепления растительного протеина в рубце происходит синтез бактериального белка и белка простейших. Для этой цели в практической деятельности используется и небелковый азот (карбомид и др). В рубце за сутки может синтезироваться от 100 до 450 грамм микробного белка. В дальнейшем бактерии и инфузории с содержимым рубца попадают в сычуг и кишечник, где перевариваются до аминокислот, здесь же происходит переваривание жиров и превращение каротина в витамин А. За счет белка микроорганизмов жвачные животные способны удовлетворять до 20−30% потребностей организма в белке. В рубце животных имеющиеся там микроорганизмы синтезируют аминокислоты, в т.ч. и незаменимые.
Наряду с расщеплением и синтезом белка в рубце происходит всасывание аммиака, который в печени превращается в мочевину. В тех случаях, когда в рубце образуется большое количество аммиака, печень не в состоянии превратить его весь в мочевину, происходит повышение его концентрации в крови, что приводит к появлению у животного клинических признаков токсикоза.
Липолитические ферменты микроорганизмов в рубце гидролизуют жиры корма до глицерина и жирных кислот, а потом в стенке рубца синтезируются вновь.
Имеющаяся в рубце микрофлора синтезирует витамины: тиамин, рибофлавин, пантотеновую кислоту, пиридоксин, никотиновую кислоту, биотин, фолиевую кислоту, кобаламин, витамин К в количествах, практически обеспечивающих основные потребности взрослых животных.
40) Биологическое окисление(тканевое дыхание)
Биологическое окисление- совокупность реакций окисления, проникающие в клетки живого организма.
Сущность биологического окисления заключается в обеспечении организма энергией, которая будет затрачиваться на реакции синтеза взаимопревращения веществ, мышечную работу, поддержание терморегуляции. Источником энергии являются продукты питания, содержащие пищ. белки, жиры, углеводы. Они попадают в жел/киш тракт, под действием гидролитических фертментов распадаются на более простые соед. которые далее попадаютв клетки тканей.
В каждой клетке находятся сложные ферментные системы:
В-окисление
Цикл Кребса
Гликолиз
С помощью которых поступившие в клетку вещества видоизменяются с уелью приобретения форм более доступных для окисления. Сам процесс оксиления под действием молекул кислорода получ. название бтол. окисление. При окислении углеводов и липидов в конечном итоге образуется СО2 и Н2О.
При окислении продуктов гидролиза белков, т.е ам/к-т кроме СО2 и Н2О образ-ся аммиак NH3,мочевина и мочевая кислота, т.к при окислении белков, жиров и углеводов вне организма (при горении), обр-ся практически те же конеч. продукты, как при биол. окислении кроме мочевины и м.к-ты) поэтому биологическое окисление с давних пор сравнивают с горением.
Отличия:
1. При горении основная масса энергии выделяется в виде тепла.
2. При биологическом окислении масса энергии выдел в виде хим. энергии, кот. запас. в фосфатных связях макроэргич. соед-й.
3. При горении энерго окисление углерода, молек О2 с образованием СО2.
4. При биол. энергообразовании явл окисление водорода, окисление субстрата, молек. кислорода в образов. воды,а СО2 в жив. организме образ. только в результате реакции декарбоксилирования
90% всех связей энергии, которая образуется при биологическом окислении запас. в фосфатных связях АТФ.
41.Роль воды в процессе обмена веществ
|
42)механизм действия ферментов. Структура и функции ферментов, а также механизм их действия почти ежегодно подробно обсуждаются на многих международных симпозиумах и конгрессах. Важное место отводится рассмотрению структуры всей молекулы фермента и ее активных центров, молекулярному механизму действия различных типов ферментов, общей теории энзиматического катализа. Тем не менее до сих пор нет полной ясности по двум кардинальным проблемам энзимологии: чем вызваны специфичность действия и высокая каталитическая эффективность ферментов?
|
|
|
|
|
|
До установления химической природы ферментов гипотезы о механизме их действия опирались на исследования кинетики и модельные опыты химического гомогенного катализа. Повышениескорости химических реакций под действием ферментов объясняли следующим: а) активированием субстрата в результате образования адсорбционных или молекулярных, обратимо диссоциирующих фермент-субстратных комплексов; б) цепным механизмом реакций с участием радикалов или возбужденных молекул. Оказалось, что цепные механизмы реакции не играют существенной роли в биологическом катализе. После установления химической природы ферментов подтвердилось представление, выдвинутое более 80 лет назад В. Анри, Л. Михаэлисом и М. Ментен, о том, что при энзиматическом катализе фермент Е соединяется (в принципе обратимо) со своим субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакциираспадается с освобождением фермента и продуктов реакции Р. Благодаря высокому сродству связывания и образованию ES-комплекса резко возрастает число молекул субстрата, вступающих вреакции. Эти представления легли в основу теории «ключа-замка» Э. Фишера, которую иногда называют теорией «жесткой матрицы». Таким образом, жесткая структура активного центра оказывается комплементарной молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента.
Л. Михаэлис не только постулировал образование промежуточного фермент-субстратного ES-комплекса, но и рассчитал влияниеконцентрации субстрата на скорость реакции. В процессе реакцииразличают несколько стадий: присоединение молекулы субстрата кферменту, преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов и протекающее в одну или несколько стадий отделение конечных продуктов реакции от фермента. Это можно схематически проиллюстрировать следующими примерами:
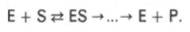
В реакциях анаболизма, например А + В —> АВ, фермент может соединяться как с одним, так и с другим субстратом или обоимисубстратами:
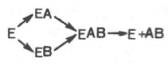
В реакциях катаболизма, например АВ —> А + В:
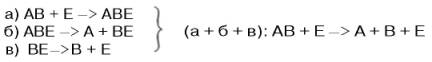
На рис. 4.7 представлена схема образования промежуточного фермент-субстратного комплекса. Еслифермент в активном центре содержит кофермент, то предполагается образование тройного комплекса (рис. 4.8).
Фермент вступает во взаимодействие с субстратом на очень короткий период, поэтому долгое время не удавалось показать образование такого комплекса. Прямые доказательства существования фермент-субстратного комплекса были получены в лабораториях Д. Кейлина и Б. Чанса. В настоящее время экспериментальные и математические методы кинетики, термодинамики и статической механики химических реакций позволяют определить для ряда ферментативных реакций кинетические и термодинамические показатели, в частностиконстанты диссоциации промежуточных фермент-субстратных комплексов, константы скорости и равновесияих образования.
В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические игидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи (рис. 4.9). Информация о природе связей между субстратом и связывающим участком активного центра ферментаможет быть получена методами ЭПР и ЯМР, а также методами УФ- и ИК-спектроскопии.
Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Этим изме-неням придается большое значение в некоторых теориях ферментативного катализа. Так, в противоположность модели Э. Фишера «ключ-замок» Д. Кошлендом была разработана теория «индуцированного соответствия», допускающая высокую конформационную лабильность молекулы белка-фермента и гибкость и подвижностьактивного центра. Эта теория была основана на весьма убедительных экспериментах, свидетельствующих о том, что субстрат индуцирует конформационные изменения молекулы фермента таким образом, чтоактивный центр принимает необходимую для связывания субстрата пространственную ориентацию. Иными словами, фермент только в присутствии (точнее, в момент присоединения) субстрата будет находиться в активной (напряженной) Т-форме в отличие от неактивной R-формы (рис. 4.10). На рис. 4.10 видно, что присоединение субстрата S к ферменту Е, вызывая соответствующие изменения конформации активного центра, в одних случаях приводит к образованию активного комплекса, в других – неактивного комплекса вследствие нарушения пространственного расположения функциональных групп активного центра в промежуточном комплексе. Получены экспериментальные доказательства нового положения о том, что постулированное Д. Кошлендом «индуцированное соответствие» субстрата и фермента создается не обязательно изменениями
43) Биосинтез жирных кислот катализируется синтазой жирных кислот. Эта ферментная система локализована вцитоплазме и нуждается в качестве затравки в ацетил-КоА. В циклической реакции одна молекула удлиняется семикратно на С2-звена. В качестве конечного продукта реакции образуется анион С16-кислоты, пальмитат. Фактический субстрат реакции удлинения цепи малонил-КоА на каждой стадии конденсации отщепляеткарбоксильную группу в вида СО2. Восстановителем в синтезе жирных кислот является НАДФН + Н+. В результате на синтез одной молекулы пальмитата расходуется одна молекула ацетил-КоА, 7 молекулмалонил-КоА и 14 молекул НАДФН + Н+; при этом образуются 7 молекул СО2, 6 молекул H2O, 8 молекул КоА и 14 молекул НАДФ+.
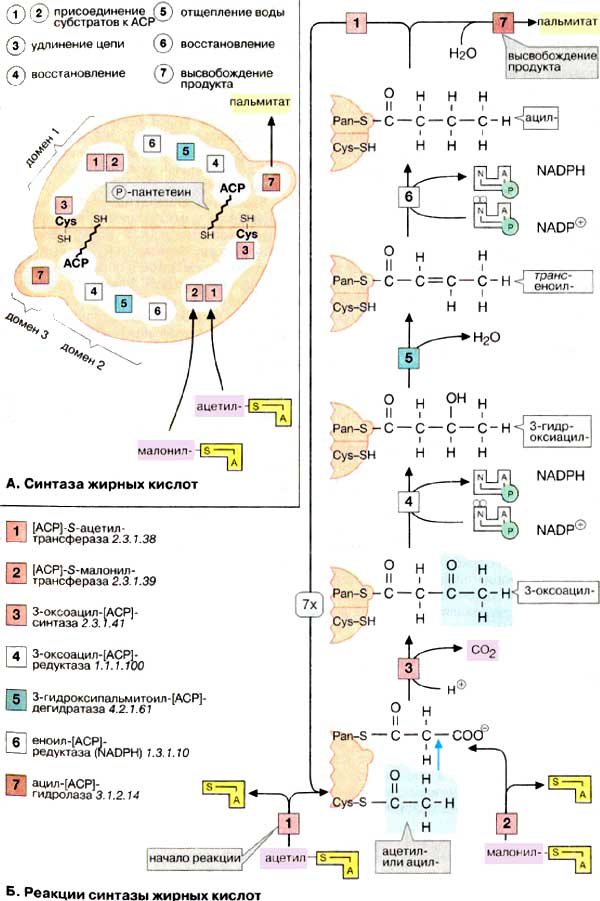
Дата добавления: 2016-01-05; просмотров: 300; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
