Гемоглобины человека
Биологическая функция гемоглобинов
Гемоглобины—структурно-родственные белки, находящиеся в эритроцитах позвоночных. Они выполняют две важные биологические функции:
1) переносят 02 из легких к периферическим тканям;
2) переносят С02 и протоны от периферических тканей к дыхательным органам для последующего выведения из организма. Сравнительная биохимия гемоглобинов чрезвычайно интересна сама по себе, однако мы здесь сосредоточим внимание только на гемоглобинах человека.
Первичная структура гемоглобина А
В отличие от миоглобина, который не имеет четвертичной структуры, гемоглобины представляют собой тетрамерные белки, молекулы которых образованы различными типами полипептидных цепей (они обозначаются а, |3, у, 5, S и т. д.). В состав молекулы входят по две цепи двух разных типов. Длина
а- и р-цепей примерно одинакова—а-цепь содержит 141 остаток, а (З-цепь—146; однако а- и (3- полипептиды гемоглобина А (НЬА) кодируются разными генами и имеют разную первичную структуру. В то же время первичная структура Р-, у- и 5-цепей гемоглобина человека в значительной степени консервативна.
Вторичная и третичная структура гемоглобина А
Несмотря на различия в длине цепи и аминокислотной последовательности миоглобина и р- полипептида НЬА, они имеют почти идентичную вторичную и третичную структуру. Это поразительное сходство, которое распространяется на расположение гема и восьми спиральных участков, частично обусловлено тем, что в эквивалентных положениях первичной структуры миоглобина и Р-субъединицы НЬА находятся хотя и различающиеся, но сходные по своим свойствам аминокислоты. а-Полипептид также весьма сходен с миоглобином, хотя в нем содержится семь, а не восемь спиралей. Как и в миоглобине, гидрофобные остатки у него размещаются внутри структуры, а гидрофильные (опять-таки за исключением двух остатков гистидина) — на поверхности; это в одинаковой мере свойственно и а-, и Р-субъединицам.
|
|
|
Четвертичная структура гемоглобина А
Свойства индивидуальных гемоглобинов неразрывно связаны с их четвертичной, равно как и вторичной и третичной, структурами. Наиболее распространенные гемоглобины имеют следующую тетра- мерную структуру: НЬА (нормальный гемоглобин взрослого человека) — а2р2; HbF (фетальный гемоглобин)— а2у2; HbS (гемоглобин при серповидно- клеточной анемии) — a2S2; НЬА2 (минорный гемоглобин взрослого человека) — а252. Четвертичная структура наделяет гемоглобин дополнительными важными особенностями (отсутствующими у миоглобина), которые способствуют выполнению гемоглобином его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств. Гемоглобин обладает аллостерическнмн свойствами (от греч. аллос—другой, стерос— место, пространство), и на его примере можно лучше понять свойства других аллостерических белков.
|
|
|
Кинетика оксигенирования гемоглобина
Гемоглобин связывает четыре молекулы кислорода на тетрамер (по одной на гем в каждой субъединице); особенно важным отличием его от миоглобина является характерная кривая насыщения кислородом, которая имеет сигмоидную форму (рис. 6.8). Таким образом, способность гемоглобина связы-
Оксигенированная кровь,, поступающая из легких
Дезоксигенированная кровь, возвращающаяся из тканей
О 20 40 60 80 100 120 140 Давление газообразного кислорода, мм рт. ст.
Оксш Вначи Измен
' Св ВЫХ с рыми
СВЯЗЬ!
этом рвязе! |тори |крук' |убъе, fr/Э-ш
В пов t Ч(
Рис. 6.8. Кривые связывания кислорода гемоглобинов и миоглобином. Парциальное давление кислорода в артсРого риальной крови составляет около 100 мм рт. ст., в венознойНГЛ. крови — около 40 мм рт. ст., в капиллярах кровеносных сотому судов активной мышцы — около 20 мм рт. ст.; минималш-^. j ное давление, необходимое для функционирования ферме» J; тов цитохромной системы, равно ~ 5 мм рт. ст. Из рисунк!® с видно, что ассоциация цепей с образованием тетрамерно|Ьерти структуры приводит к существенному повышению эффектны тивности снабжения тканей кислородом по сравнении!, с мономерными белками. (Изолированные цепи гемогло? бина обладают примерно таким же сродством к кислород; что и миоглобин, и характеризуются аналогичной типе лической кривой насыщения.) (Из работы Stanbury J. Bj Wyngaarden J. В., Fredrickson D. S. (editors): The MetabolifeMO Basis of Inherited Diseases. 4th ed. McGraw-Hill, 1978, с изме! _ нениями.) i
|
|
|
jHa, в ок том ал i
вать 02 зависит от того, содержатся ли в данном к
трамере другие молекулы 02. Если да, то последуй щие молекулы 02 присоединяются легче. Следов4вает< тельно, для гемоглобина характерна кинетика коореле перативиого связывания, благодаря которой of связывает максимальное количество 02 в легки? и отдает максимальное количество 02 при тех Ри которые имеют место в периферических тканя| Сравните, например, какие количества кислород! связываются гемоглобином и миоглобином в лег! ких, при Р0 = 100 мм рт. ст., и какие в тканях, пр| Р0 = 20 мм рт. ст. (рис. 6.8). |
Сродство гемоглобинов к 02 характеризуется величиной Рм—значением PQ, при котором наблюдае тся полунасыщение гемоглооииа кислородом. Значе ние Pso у разных организмов существенно различается, но во всех случаях оно превышает значение PQ i периферических тканях рассматриваемого органго ма. Это хорошо иллюстрирует фетальный гемогло бин человека (HBF). Для НЬА Р50 = 26 мм. рт. ст а для HBF Рх = 20 мм рт. ст. Благодаря этой разив це гемоглобин F отбирает кислород у НЬА, находя1 щегося в плацентарной крови. Однако после Ро^р^, дения ребенка HBF утрачивает свою функцию; обла^а ^ дая более высоким сродством к 02, он высвобождзЛИме 'ет меньшее его количество в тканях. '
|
|
|
Оксигенирование сопровождается значительными конформационными изменениями в гемоглобине
Связывание 02 сопровождается разрывом солевых связей, образованных концевыми карбоксильными группами субъединиц (рис. 6.9). Это облегчает связывание следующих молекул 02, поскольку при этом требуется разрыв меньшего числа солевых связей. Указанные изменения заметно влияют на вторичную, третичную и особенно четвертичную структуру гемоглобина. При этом одна а/|3*па'ра субъединиц поворачивается относительно другой ti/p-пары, что приводит к компактизации тетрамера я повышению сродства гемов к 02 (рис. 6.10 и 6.11).
Четвертичная структура частично оксигенирован- ного гемоглобина описывается как Т-состояние (от англ. taut—напряжение); полностью оксигенирован- ному гемоглобину (НЬ02) отвечает R-состояние (relaxed—релаксированное) (рис. 6.12). Термины R- и Т-состояния используют для характеристики четвертичной структуры аллостерических ферментов; меньшим сродством к субстрату обладает Т- состояние.
Коиформационные изменения в окружении гемогруппы
Оксигенирование гемоглобина, как и миоглобина, сопровождается структурными изменениями в окружении гемогруппы. При оксигенировании атом железа, который в дезоксигемоглобине выступал на 0,06 нм из плоскости гемового кольца, втягивается в эту плоскость (рис. 6.13). Вслед за атомом железа ближе к тему перемещается и проксимальный
Рие. 6.9. Солевые связи между субъединицами в дезоксигемоглобине. При оксигенировании эти нековалентные связи, обусловленные электростатическими взаимодействиями, разрушаются. (Из книги Stryer L.: Biochemistry, 2nd ed., Freeman, 1981, с изменениями.)
гистидин (F8), а также связанные с ним соседние остатки.
Транспорт двуокиси углерода
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт С02 от тканей к легким. Гемоглобин связывает С02 сразу после высвобождения кислорода; примерно 15% С02, присутствующего в крови, переносится молекулами гемоглобина. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей С02 в угольную кислоту (рис. 6.14). Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие сдвинуто в сторону диссоциации. Для
Т-форма
Рис. 6.10. Переход гемоглобина из Т- в R-форму сопровождается поворотом одной пары жестко связанных субъединиц (а,/Р2) на 15° относительно другой такой же пары (а,/р,). Ось вращения эксцентрична, т. е. одновременно происходит сдвиг димера (а2/Р2) ближе к оси тетрамера. На этом рисунке показан поворот и смещение затененной а,/Р2-пары относительно
незатененной оц/Р^пары (последняя считается неподвижной).
а, Субм&мница
Asn G4 (102) Дезокси
(Т-форма)
Гистидин F8
Рг-Сувмджвчи
F-спираль
ХС
II
НС
Стерическое I отталкивание I
Окси (R -форма)
04(102)
Рис. 6.11. Изменения, происходящие в области а,/Р2-кон- такта при оксигенировании. Контакт как бы «перескакивает» с одного зубца на другой, с заменой одной водородной связи на другую. Остальные связи образованы неполярными остатками. (Из работы Perutz М. F.: Molecular pathology of human hemoglobin. Stereochemical interpretation of abnormal oxygen affinities. Nature 1971:232:408, с любезного разрешения.)
ис. 6.1
атализ
Рис. 6.13. При оксигенировании диаметр координационной^ „ сферы атома железа становится меньше, и он втягиваетаРВОИС в плоскость гема. Вместе с атомом железа смещается гегся ге стидин F8. (Из книги Stryer L: Biochemistry, 2nd ed., Frees man, 1981, с некоторыми изменениями.) F,
Т-форма
R -форма
«Рис.
апаяс;
Рис. 6.12. Вероятность перехода из Т-формы в Я-форму повышается по мере последовательного оксигенирования каждомуro_-Ifc из четырех гемогрупп. В представленной здесь модели солевые мостики (прямые линии), связывающие субъединицы в T^,0H, форме, разрушаются по мере присоединения кислорода, и даже те солевые мостики, которые остаются неразрушеннымцняет постепенно ослабляются (волнистые линии). Переход из Т- в R-состояние не связан однозначно с присоединением опреде|у лег] ленного числа молекул кислорода, однако при связывании каждой новой молекулы кислорода вероятность этого переход|црОВ(повышается. На переход между двумя состояниями оказывают влияние протоны, двуокись углерода, хлорид и ДФГ. Че1Др0Т выше их концентрация, тем большее число молекул кислорода должно связаться, чтобы оказался возможным переходную i Полностью оксигенированные молекулы в Т-состоянии и полностью дезоксигенированные в R-состоянии не показаны-£цает, они слишком неустойчивы, чтобы присутствовать в заметном количестве. (Из работы Perutz М. F.: Hemoglobin structur|^yrJle and respiratory transport. Sci, Am. [Dec.] 1978:239:92, с изменениями.)
со, + н,о
> н2со3
Карбоангидраза Угольная кислота
HCOi + Н'
Периферические ткани
Hgb • 40:
Hgb.2H-> (Буфер)
Легкие
2Н2С03
J| I Карбоан- 111 гидраза
2С02 + 2Н20
Образуется в цикле Кребса
Рис. 6.15. Эффект Бора. Двуокись углерода, образовавшаяся в периферических тканях, реагирует с водой, образуя угольную кислоту, которая диссоциирует на бикарбонат- ион и протон. Дезокс^генированный гемоглобин выполняет роль буфера — он связывает протоны и поставляет их в легкие. В легких связывание гемоглобином кислорода сопровождается высвобождением протонов из гемоглобина. Протоны соединяются с бикарбонат-ионом, образуя угольную кислоту, которая при участии карбоангидразы превращается в двуокись углерода и воду. Двуокись углерода (углекислый газ) удаляется из легких с выдыхаемым воздухом.
ве кооперативных эффектов. Бора не обнаруживается.
У миоглобина эффект
Самопроизвольно,
'ис. 6.14. Образование угольной кислоты в ходе реакции, катализируемой карбоангидразой эритроцитов, и ее диссоциация на бикарбонат-ион и протон.
предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови (рис. 6.15). В легких идет обратный Процесс: присоединение кислорода,к дезокснгемогло- бииу сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами, переводя да в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием С02. Это обратимое явление известно как эффект Бора. Эффект Бора является свойством тетрамерного гемоглобина и определяется гем-гемовым взаимодействием, лежащим в осно-
Удаляется вместе с „.выдыхаемым воздухом
Г
2С02 + 2Н20
Ц Карбоан-
Молекулярная основа эффекта Бора
Протоны, ответственные за эффект Бора, высвобождаются в результате разрушения солевых мостиков, которым сопровождается связывание кислорода с Т-структурой; они „отсоединяются от атомов азота остатков гистидина (146) в Р-цепях. Эти протоны сдвигакУт равновесие в сторону образования угольной кислоты, которая расщепляется карбоангидразой с образованием С02 (рис. 6.15).
Наоборот, при высвобождении кислорода вновь формируется Т-структура с присущими ей солевыми мостиками, при образовании которых происходит присоединение протонов к остаткам гистидина в Р- цепях. Таким образом, в периферических тканях протоны благоприятствуют образованию солевых мостиков путем протонирования (по атому азота) концевых остатков гистидина в р-субъединицах. Образование солевых мостиков форсирует освобождение кислорода из оксигенированной R-формы гемоглобина. Итак, повышение концентрации протонов способствует освобождению кислорода, а повышение концентрации кислорода стимулирует высвобождение протонов. Первый из этих эффектов проявляется в сдвиге кривой диссоциации кислорода вправо при повышении концентрации ионов водорода (протонов).
Регуляция 2,3-бисфосфоглицератом
Недостаток кислорода в периферических тканях приводит к накоплению 2,3-бисфосфоглицерата (ди- фосфоглицерата, ДФГ) (рис. 6.16). Это соединение образуется из 1,3-бисфосфоглицерата, промежуточного продукта гликолиза. Тетрамер гемоглобина связывает одну молекулу ДФГ, которая размещается в центральной полости, выстланной остатками всех четырех субъединиц. Объем этой полости достаточен для размещения ДФГ только в том случае, когда молекула гемоглобина находится в Т-форме и образуется достаточно широкий просвет между Н-
о
V"
о \
0-
0-
0- V0
-о' \\ о
Рис. 6.16. Структура 2,3-бисфосфоглицерата.
Г"
спиралями р-цепей. Связывание ДФГ осуществляется путем образования солевых мостиков между атомами кислорода ДФГ и группами, принадлежащими обеим р-цепям: концевыми аминогруппами остатков ValNAl, аминогруппами остатков LysEF6 и боковыми группами остатков His Н21 (рис. 6.17). Таким образом, ДФГ стабилизирует дезоксигениро- ваииую Т-форму гемоглобина, образуя поперечные связи между Р-цепями—дополнительные солевые мостики, которые должны быть разрушены при переходе гемоглобина из Т- в R-форму.
С фетальным гемоглобином ДФГ связывается менее прочно, чем с гемоглобином взрослого человека, поскольку в его р-цепи в положении Н21 находится не His, a Ser, который не может участвовать в формировании солевых мостиков, удерживающих ДФГ в центральной полости. -Поэтому ДФГ в меньшей степени способствуют стабилизации Т-формы фетального гемоглобина и последний обладает более высоким сродством к кислороду по сравнению с гемоглобином взрослого человека.
Пусковым механизмом перехода между R- и Т- формами гемоглобина служит перемещение атома железа в плоскость порфирииового кольца или от нее. Источником свободной энергии для этих процессов (около 3000 кал/моль) служат стерические и электростатические факторы. Таким образом, совсем небольшое смещение атома Fe2+ относительно порфирииового кольца вызывает значительные изменения конформации гемоглобина и решающим образом воздействует на его ответную реакцию на сигнал, поступающий из внешней среды.
Рис. 6.17. Механизм связывания ДФГ с дезоксигемоглобином человека. ДФГ взаимодействует с тремя положительно заряженными группами в каждой из Р-цепей. (Из работы Arnone A.: X-ray diffraction study of bonding of 2,3- diphosphoglycerate to human dcoxyhemoglobin. Nature 1972:237:146, с разрешения.)
Мутантные гемоглобины человека [
Мутации генов, кодирующих а- и Р-цепи, мог. существенным образом сказываться на их биолог| ческой функции. Известно несколько сот мутантнь| гемоглобинов человека (в большинстве случай, функционально активных), и о некоторых из них, of личающихся сильным изменением биологически функций, речь пойдет ниже. Патологическое состо! ние, при котором мутация вызывает изменение би| логической функции темоглобина, называют гем| глобинопатией. I
В семействе гемоглобинов М остатки прокснмал§ ного или дистального гистидина в а- или I субъедииицах заменены на остатки тирозина. АгоЛ16- железа в составе гема находится в этом случа^Д в Ре3+-состоянии, что обусловлено образованиеВпр] прочного ионного комплекса с фенолятным а ни! ном тирозина. Результатом такой аномалии явл| ется метгемоглобинемия, поскольку ферри-гем | способен связывать 02. В а-цепи гемоглобв М R—Т-равновесие сдвинуто в сторону образоь»езо ния Т-формы. Сродство к кислороду Низкое, эффежрШ Бора отсутствует. В р-цепях гемоглобинов М може|рИ1 происходить переход между R- и Т-состояниями следовательно, наблюдается эффект Бора.
Мутации, приводящие к преимущественно] образованию R-формы (в качестве примера мож] привести гемоглобин Чезапик), отличаются тем, соответствующие гемоглобины обладают повыше4ОЛ1 ным сродством к кислороду. Подобные гемоглобину и не способны поставлять достаточное количество слорода периферическим тканям. Возникает ткан&нт вая гипоксия, ведущая к развитию полицитемии <п^ал вышению концентрации эритроцитов).
Гемоглобин при серповидноклеточной анемии
Oi
.м:
THI
ой ог с
В гемоглобине S остаток Glu А2(6)Р замещен Val. Остаток А2 (Glu или Val) располагается на ni верхности молекулы гемоглобина и контактиру, с водой, и замещение полярного остатка Glu на н< полярный Val приводит к появлению на поверхнос Р-субъединицы «липкого участка». Этот липкий уч1*ов сток присутствует как в оксигенированном, так 1ия в дезоксигенированном гемоглобине S'(b гемоглой не А он отсутствует). На поверхности дезоксш'ени] ванного гемоглобина существует комплементар: участок, способный прочно связываться с лиша участком р-субъединицы, тогда как в оксигенирова] ном гемоглобине этот участок маскируется други: группами (рис. 6.18). Когда гемоглобин S перехо, в дезоксигенированное состояние, его липкий уч< сток связывается с комплементарным участком другой молекуле дезоксигенированного гемоглобгУе на. Происходит полимеризация дезоксигемоглобипР6! S и его осаждение в виде длинных волокон. Воло:
н ■к >Д 'ем г,е-
of Pi
У ги ы iei зт
зя ю 10
Рис. 6.18. Схема, поясняющая взаимодействие липкого участка гемоглобина S (черный треугольник) с рецептором липкого участка (светлый треугольник) дезоксигемоглобина А и дезоксигемоглобина S. Наличие комплементарных участков на [а юверхности молекулы дезоксигемоглобина S способствует его полимеризации с образованием волокнистых структур. В присутствии дезоксигемоглобина А процесс полимеризации останавливается, поскольку на поверхности этой молекулы липкого участка нет. (Из книги Stryer L.: Biochemistry, 2nd ed., Freeman, 1981, с некоторыми изменениями.)
та
Окси А
Дезокси А
Окси S
Дезокси S
<
>
hi
minm
Дезокси А Дезокси S
е) 10 1Я HI Hi
13 цезоксигемоглобина S механически деформируют ж эритроцит, придавая ему серповидную форму, что:е Приводит к лизису клеток и множеству вторичных н клинических проявлений. Таким образом, если бы можно было поддерживать гемоглобин S в оксигени- (юванном состоянии или по крайней мере свести минимуму концентрацию дезоксигенированного гемоглобина S, то нам удалось бы предотвратить ЭДвюлимеризацию дезоксигенированного гемоглобина н В и образование «серповидных» клеток. Ясно, что и полимеризации подвержена Т-форма гемоглобина S. Интересно отметить (хотя в практическом плане это мало существенно), что ферри-ион метгемоглобина Д. остается в плоскости порфиринового кольца и тем самым стабилизирует R-форму гемоглобина. То же относится и к гемоглобину при серповидноклеточ- вой анемии: гемоглобин S в ферри-состоянии (метге- н^юглобин S) не подвержен полимеризации, посколь- о ку он стабилизирован в R-форме.
В дезоксш емоглобине А тоже имеется рецептор- lejjpbm участок, способный взаимодействовать с лип- шм участком оксигенированного или дезоксигенированного гемоглобина S (рис. 6.18), но присоедине- аия «липкого» гемоглобина S к дезоксигемоглобину,ИЖА недостаточно для образования полимера, поско- 10, льку сам дезоксигемоглобин А липкого участка не содержит и не может связать следующую молекулу гемоглобина. Следовательно, связывание дезоксигемоглобина А с R- или Т-формой гемоглобина S преры- д^вает полимеризацию.
В результате полимеризации дезоксигемоглобина S образуются спиральные фибриллярные структуры. нЖ1ри этом каждая молекула гемоглобина контактирует с четырьмя соседними молекулами (рис. 6.19). Образование подобных трубчатых волокон ответственно за механические нарушения в содержащем
Рис. 6.19. Предполагаемая спиральная структура волокна из агрегированных молекул дезоксигемоглобина S. (Из работы Maugh Т. II: A new understanding of sickle cell emerges. Science 1981:211:265, с разрешения.)
Рис. 6.20. Электронные микрофотографии нормального (А) и серповидного (S) эритроцитов. Изменения в молекуле глобина, приводящие к такому изменению формы клетки, вызваны мутацией единственного основания в ДНК (А вм Т), в результате чего в цепи |3-глобина происходит замена глутамата на валин (гл. 36).
их эритроците: он приобретает серповидную форму (рис. 6.20), становится подверженным лизису в момент прохождения им щелей в синусоидах селезенки.
Талассемии
Другая важная группа нарушений, связанных с аномалиями гемоглобина—талассемии. Для них характерна пониженная скорость синтеза а-цепей гемоглобина (а-талассемия) или р-цепей ф-та- лассемия). Это приводит к анемии, которая может принимать очень тяжелую форму. В последние годы достигнут ощутимый прогресс в выяснении молекулярных механизмов, ответственных за развитие талассемии (см.. гл. 36).
Колаген
Коллаген
Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белкаи – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела.
Видимые в оптическом микроскопе коллагеновые волокна состоят из различимых в электронном микроскопе фибрилл – вытянутых в длину белковых молекул, названных тропоколлагеном. Тропоколлаген – основная структурная единица коллагена (рис. 21.2). Необходимо четко разграничивать понятия «коллагеновые волокна» и «коллаген». Первое понятие по существу является морфологическим и не может быть сведено к биохимическим представлениям о коллагене как о белке. Коллагеновое волокно представляет собой гетерогенное образование и содержит, кроме белка коллагена, другие химические компоненты. Молекула тропоколла-гена – это белок коллаген. Одной из отличительных черт данного белка является то, что 1/3 всех его аминокислотных остатков составляет глицин, 1/3 – пролин и 4-гидроксипролин, около 1% – гидроксилизин; некоторые молекулярные формы коллагена содержат также 3-гидроксипролин, хотя и в весьма ограниченном количестве: 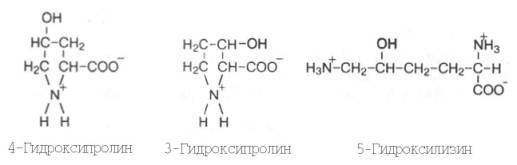
Молекулярная масса тропоколлагена около 285000. Тропоколлаген состоит из трех полипептидных цепей одинакового размера, которые сливаются в спиралевидный триплет. Тройная спираль стабилизируется многочисленными межцепочечными поперечными сшивками между лизи-новыми и гидроксилизиновыми остатками. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, например в 10 раз больше, чем химотрипсин.
Изучение аминокислотного состава и последовательности чередования аминокислот в полипептидных цепях тропоколлагена показало, что существует два типа цепей – цепи α1 и α2, а также четыре разновидности цепи α1: α1 (I), α1 (II), α1 (III) и α1 (IV). В табл. 21.1 представлены данные о структуре коллагенов различных тканей.

Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора – аскорбиновой кислоты.
Учитывая наличие разных молекулярных форм в пределах одного типа (например, коллаген типа 1 имеет состав [α1 (I)]2 α2 либо [α1 (I)]3, есть основание считать, что существует по крайней мере не менее 10 молекулярных форм коллагена (Е.С. Северин).
Напомним, что коллаген – внеклеточный белок, но он синтезируется в виде внутриклеточной молекулы-предшественника, которая перед образованием фибрилл зрелого коллагена подвергается посттрансляционной модификации. Предшественник коллагена (сначала препроколлаген, а затем проколлаген) претерпевает процессинг в ходе прохождения через эндо-плазматический ретикулум и комплекс Гольджи до появления во внеклеточном пространстве. Внеклеточные амино- и карбоксипротеаза проколлагена удаляют соответственно аминоконцевой и карбоксиконцевой про-пептиды. Вновь образованные молекулы коллагена спонтанно собираются в коллагеновые фибриллы. В результате перекрестного связывания цепей и спиральных молекул фибрилл через основания Шиффа и альдольную конденсацию (т.е. перекрестное связывание их рядом ковалентных связей) образовавшиеся фибриллы приобретают силу напряжения зрелых колла-геновых фибрилл.
Дата добавления: 2016-01-05; просмотров: 34; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
