Переваривание белков
В желудке имеются все условия для переваривания белков. Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда (рН 1,5–2,5). Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина; в присутствии соляной кислоты происходят набухание белков, частичная денатурация и, возможно, гидролиз сложных белков. Кроме того, соляная кислота стимулирует выработку секретина в двенадцатиперстной кишке, ускоряет всасывание железа и оказывает бактерицидное действие.
Ввиду исключительной роли соляной кислоты в переваривании белков были предприняты попытки объяснить механизм ее секреции в желудке. В деталях этот механизм до сих пор не выяснен, однако имеющиеся данные свидетельствуют, что образующиеся при диссоциации хлорида натрия в крови ионы хлора диффундируют через клеточную мембрану и соединяются с ионами водорода, которые в свою очередь освобождаются при диссоциации угольной кислоты, образующейся в обкладочных клетках из конечных продуктов обмена – Н2 О и СО2. Образовавшаяся соляная кислота затем экскретируется обкладочными клетками в полость желудка. Равновесие ионов Сl– между кровью и обкладочными клетками достигается поступлением отрицательно заряженных ионов HCO3–из клеток в кровь взамен ионов Сl–, поступающих из крови в клетки. Предполагается участие АТФ, поскольку синтез соляной кислоты требует энергии.
|
|
|
Следует отметить, что при некоторых поражениях желудка (обычно при воспалительных процессах) могут нарушаться секреция соляной кислоты и соответственно переваривание белков.
Пепсин, катализирующий гидролиз пептидных связей, образованных остатками ароматических аминокислот, расщепляет практически все природные белки. Исключение составляют некоторые кератины, протамины, гистоны и мукопротеины. При их гидролизе образуются различного размера пептиды и, возможно, небольшое число свободных аминокислот. В желудочном соке детей грудного возраста, а также в секрете четвертого желудочка телят и других молодых жвачных животных содержится отличный от пепсина весьма активный фермент реннин. Он катализирует свертывание молока (превращение растворимого казеиногена в нерастворимый казеин). У взрослых людей эту функцию выполняет пепсин. Механизм этого процесса, несмотря на кажущуюся простоту, в деталях пока не выяснен. Предполагают, что реннин превращает растворимый казеиноген молока в параказеин, кальциевая соль которого нерастворима, и он выпадает в осадок. Интересно отметить, что после удаления ионов Са2+ из молока образования осадка не происходит. Наличие активного реннина в желудочном соке детей грудного возраста имеет, по-видимому, важное физиологическое значение, поскольку при свертывании молока, являюще-
|
|
|
гося основным пищевым продуктом в этом возрасте, резко замедляется продвижение нерастворимого казеина через пищеварительный канал, в результате чего он дольше подвергается действию протеиназ.
Дальнейшее превращение белков пищи осуществляется в тонкой кишке, где на белки действуют ферменты панкреатического и кишечного соков. Трипсин и химотрипсин действуют на белки аналогично пепсину, разрывают другие внутренние пептидные связи; оба фермента наиболее активны в слабощелочной среде (рН 7,2–7,8). Благодаря гидролитическому действию на белки всех трех эндопептидаз (пепсин, трипсин, химотрипсин) образуются различной длины пептиды и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов – пептидаз. Помимо панкреатической карбоксипептидазы, на пептиды действуют кишечная аминопептидаза и разнообразные дипептидазы. Эта группа ферментов относится к экзопептидазам и катализирует гидролиз пептидной связи по схеме:
|
|
|
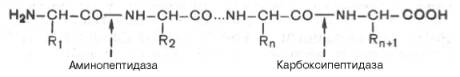
Точкой приложения аминопептидазы является пептидная связь с N-кон-ца пептида. Карбоксипептидаза разрывает пептидную связь с противоположного С-конца пептида. Эти ферменты отщепляют по одной аминокислоте от полипептида.
В итоге остаются дипептиды, на которые действуют специфические дипептидазы, при этом образуются свободные аминокислоты, которые затем всасываются.
Из других ферментов протеолиза следует упомянуть об эластазе и коллагеназе поджелудочной железы, гидролизующих соответственно эластин и коллаген. Топографически основные процессы гидролиза белков, как и углеводов и жиров, протекают на поверхности слизистой оболочки кишечника (так называемое пристеночное пищеварение, по A.M. Уголеву).
46-
47 дезаминирование аминокислот
Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака.
|
|
|

Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гис-тидина, подвергающегося внутримолекулярному дезаминированию.
Рассмотрим более подробно механизм окислительного дезаминиро-вания аминокислот, протекающего в две стадии.
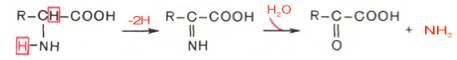
Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта (иминокислота), который на второй стадии спонтанно без участия фермента, но в присутствии воды распадается на аммиак и α-кетокислоту. Следует указать, что оксидазы аминокислот (L- и D-изомеров) являются сложными флавопротеинами, содержащими в качестве кофермента ФМН или ФАД, которые выполняют в этой реакции роль акцепторов двух электронов и протонов, отщепляющихся от аминокислоты. Оксидазы L-аминокислот могут содержать как ФМН, так и ФАД, а оксидазы D-аминокислот – только ФАД в качестве простетической группы. Схематически реакции окислительного дезами-нирования аминокислот с участием коферментов могут быть представлены в следующем виде:
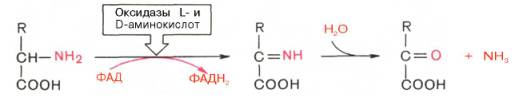
Восстановленные флавиннуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода, которая подвергается расщеплению под действием каталазы на воду и кислород.
Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая дезаминирование 12 природных (L-изомеров) аминокислот. Оказалось, однако, что этот фермент имеет оптимум действия в щелочной среде (рН 10,0) и при физиологических значениях рН его активность на порядок ниже, чем при рН 10,0. В тканях животных и человека отсутствует подобная среда, поэтому оксидазе L-ами-нокислот принадлежит, вероятнее всего, ограниченная роль в процессе окислительного дезаминирования природных аминокислот. В животных тканях оксидазным путем со значительно большей скоростью дезами-нируются D-изомеры аминокислот. Эти данные подтвердились после того, как из животных тканей был выделен специфический фермент оксидаза D-аминокислот, который в отличие от оксидазы L-аминокислот оказался высокоактивным при физиологических значениях рН среды. Не до конца ясным остается вопрос о том, каково значение столь активной оксидазы D-аминокислот в тканях, если поступающие с пищей белки и белки тела животных и человека состоят исключительно из природных (L-изомеров) аминокислот.
В животных тканях Г. Эйлером открыт высокоактивный при физиологических значениях рН специфический фермент (глутаматдегидрогеназа), катализирующий окислительное дезаминирование L-глутаминовой кислоты. Он является анаэробным ферментом и чрезвычайно широко распространен во всех живых объектах. В качестве кофермента глутамат-дегидрогеназа содержит НАД (или НАДФ). Реакция включает анаэробную фазу дегидрирования глутаминовой кислоты с образованием промежуточного продукта – иминоглутаровой кислоты и спонтанный гидролиз последней на аммиак и α-кетоглутаровую кислоту в соответствии со следующей схемой:
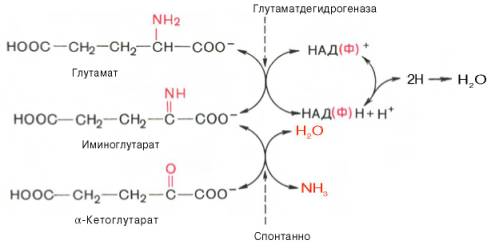
Первая стадия окисления глутаминовой кислоты аналогична реакции окислительного дезаминирования. Восстановленный НАДН далее окисляется при участии флавиновых ферментов и цитохромной системы (см. главу 9) с образованием конечного продукта воды. Образовавшийся аммиак благодаря обратимости ферментативной реакции, но обязательно в присутствии восстановленного НАДФН может участвовать в синтезе глу-тамата из α-кетоглутаровой кислоты. Различают три разных типа глутаматдегидрогеназ: один из них использует в качестве кофермента как НАД, так и НАДФ (клетки животных); два других используют или НАД, или НАДФ (микроорганизмы, клетки растений и грибов), соответственно катализируя дезаминирование или биосинтез глутамата.
Глутаматдегидрогеназа животных тканей является одним из наиболее изученных ферментов азотистого обмена. Это олигомерный фермент (мол. масса 312000), состоящий из 6 субъединиц (мол. масса каждой около 52000) и проявляющий свою основную активность только в мультимерной форме. При диссоциации этой молекулы на субъединицы, наступающей легко в присутствии НАДН, ГТФ и некоторых стероидных гормонов, фермент теряет свою главную глутаматдегидрогеназную функцию, но приобретает способность дезаминировать ряд других аминокислот. Это свидетельствует об аллостерической природе глутаматдегидрогеназы, действующей как регуляторный фермент в аминокислотном обмене.
Помимо перечисленных 4 типов дезаминирования аминокислот и ферментов, катализирующих эти превращения, в животных тканях и печени человека открыты также три специфических фермента (серин- и треонин-дегидратазы и цистатионин-γ-лиаза), катализирующих неокислительное дезаминирование соответственно серина, треонина и цистеина.
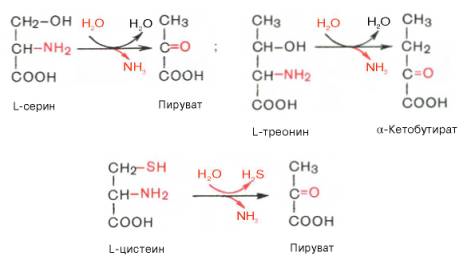
Конечными продуктами реакции являются пируват и α-кетобутират, аммиак и сероводород. Поскольку указанные ферменты требуют присутствия пиридоксальфосфата в качестве кофермента, реакция неокислительного дезаминирования, вероятнее всего, протекает с образованием шиффовых оснований как промежуточных метаболитов.
Наиболее изучен фермент треониндегидратаза, которая оказалась не только аллостерическим ферментом, но наряду с триптофан-2,3-диокси-геназой и тирозинаминотрансферазой индуцибельным ферментом в животных тканях (индукция синтеза ферментов de novo является общим свойством микроорганизмов). Так, при скармливании крысам гидролизата казеина активность треониндегидратазы печени повышается почти в 300 раз. Этот синтез тормозится ингибитором белкового синтеза пуромицином. Поскольку индукция почти полностью тормозится также глюкозой пищи, треонингидратаза, по-видимому, является ответственной за глюконеогенез, так как α-кетобутират легко превращается в пируват и соответственно в глюкозу.
Дата добавления: 2016-01-05; просмотров: 113; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
