Строение митохондрий Наружная мембрана
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из билипидного слоя и пронизывающих его белков; соотношение липидов и белков по массе — примерно 1:1. Особую роль играет порин — каналообразующий белок: он формирует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут пересекать наружную мембрану только посредством активного транспорта через транспортные белки митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
[править]
Межмембранное пространство
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c — один из компонентов дыхательной цепи митохондрий.
|
|
|
[править]
Внутренняя мембрана
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
|
|
|
[править]
Матрикс
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
[править]
Митохондриальная ДНК
Основная статья: Митохондриальная ДНК
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
|
|
|
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
|
|
|
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70s-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
[править]
Митохондриальные белки
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограниченно. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
[править]
Функции митохондрий и энергообразование
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
Перенос электронов с НАДН на кислород по дыхательной цепи;
Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Большой олигомерный фермент, катализирующий перенос электронов;
Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
[править]
АТФ-синтеза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
22 окислительное фосфорилирование
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
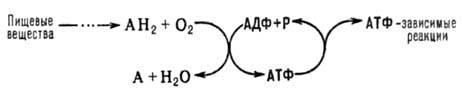
АН2-орг. в-ва, окисляемые в дыхат. цепи (т. наз. субстраты окисления, или дыхания), АДФ-аденозиндифосфат, Р-неорг. фосфат.
Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада окислительного фосфорилирования (ок. 5%).
У животных, растений и грибов окислительное фосфорилирование протекает в спе-циализир. субклеточных структурах-митохондриях (рис. 1); у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране.
Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН2 для окислительного фосфорилирования. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т. наз.-окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться -окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
Механизм окислительного фосфорилирования можно представить схемой: Перенос электронов (дыхание) А ~ ВАТФ А ~ В-высокоэнергетич. интермедиат Предполагалось, что А ~ В - хим. соед. с макроэргич. связью, напр. фосфорилир. фермент дыхат. цепи (хим. гипотеза сопряжения), или напряженная конформация к.-л. белка, участвующего в окислительном фосфорилировании (конформац. гипотеза сопряжения). Однако эти гипотезы не получили эксперим. подтверждения. Наиб. признанием пользуется хемиосмотич. концепция сопряжения, предложенная в 1961 П. Митчеллом (за развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно этой теории, своб. энергия транспорта электронов в дыхат. цепи затрачивается на перенос из митохондрий через митохондриальную мембрану на ее наружную сторону ионов Н+ (рис. 2, процесс 1). В результате на мембране возникает разность электрич. потенциалов и разность хим. активностей ионов Н+ (внутри митохондрий рН выше, чем снаружи). В сумме эти компоненты дают трансмембранную разность электрохим. потенциалов ионов водорода между матриксом митохондрий и внеш. водной фазой, разделенными мембраной:
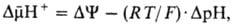
где R-универсальная газовая постоянная, T-абс. т-ра, F- число Фарадея. Величина 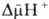
обычно составляет ок. 0,25 В, причем осн. часть (0,15-0,20 В) представлена электрич. Составляющей 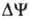 Энергия
Энергия 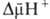 выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
Перенос электронов (дыхание) 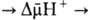 АТФ
АТФ
Сопряжение окисления и фосфорилирования через 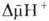 позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия
позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия 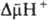 , помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
, помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
В дыхат. цепи имеется неск. участков, к-рые характеризуются значит. перепадом окислит.-восстановит. потенциала 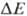 и сопряжены с запасанием энергии (генерацией
и сопряжены с запасанием энергии (генерацией 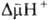 ). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено (
). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено (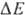 0,35-0,4 В), убихинол: цитохром-c-редуктазное звено (
0,35-0,4 В), убихинол: цитохром-c-редуктазное звено (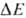 ~ ~ 0,25 В) и цитохром-с-оксидазный комплекс (
~ ~ 0,25 В) и цитохром-с-оксидазный комплекс ( ~ 0,6 В) -пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
~ 0,6 В) -пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
Обычно для характеристики эффективности окислительного фосфорилирования используют величины Н+/2е или q/2e, указывающие сколько протонов (либо электрич. зарядов) переносится через мембрану при транспорте пары электронов через данный участок дыхат. цепи, а также отношение Н+/АТФ, показывающее, сколько протонов нужно перенести снаружи внутрь митохондрий через АТФ-синтетазу для синтеза 1 молекулы АТФ. Величина q/2e составляет для пунктов сопряжения 1, 2 и 3 соотв. 3-4, 2 и 4. Величина Н+/АТФ при синтезе АТФ внутри митохондрий равна 2; однако еще один Н+ может тратиться на вынос синтезированного АТФ4- из матрикса в цитоплазму переносчиком адениновых нуклеотидов в обмен на АДФ -3. Поэтому кажущаяся величина Н+ / АТФнаружн равна 3.
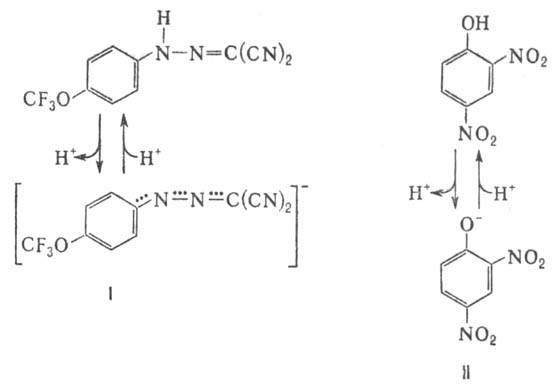
В организме окислительное фосфорилирование подавляется мн. токсичными в-вами, к-рые по месту их действия можно разделить на три группы: 1) ингибиторы дыхат. цепи, или т. наз. дыхат. яды (см. Дыхание). 2) Ингибиторы АТФ-синтетазы. Наиб. распространенные ингибиторы этого класса, употребляемые в лаб. исследованиях, - антибиотик олигомицин и модификатор карбоксильных групп белка дициклогексилкарбодиимид. 3) Т. наз. разобщители окислительного фосфорилирования. Они не подавляют ни перенос электронов, ни собственно фосфорилирование АДФ, но обладают способностью уменьшать величину на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв. ф-лы I и II; показаны протонир. и депротонир. формы).
Биохимия питания
Биохимические основы питания человека
Полноценное питание должно содержать:
источники энергии (углеводы, жиры, белки);
незаменимые аминокислоты;
незаменимые жирные кислоты;
витамины;
неорганические (минеральные) кислоты);
клетчатку;
Н2О.
Источники энергии
Углеводы, жиры и белки являются макропитательными веществами. Их потребление зависит от роста, возраста и пола человека и определяется в граммах.
Углеводы составляют основной источник энергии в питании человека - самая дешевая пища. В развитых странах около 40 % потребления углеводов приходится на рафинированные сахара, а 60 % составляет крахмал. В менее развитых странах доля крахмала возрастает. За счет углеводов образуется основная часть энергии в организме человека.
Жиры - это один из основных источников энергии. Перевариваются в желудочно-кишечном тракте (ЖКТ) гораздо медленнее, чем углеводы, поэтому лучше способствуют возникновению чувства сытости. Триглицериды растительного происхождения являются не только источником энергии, но и незаменимымых жирных кислот: линолевой и линоленовой.
Белки - энергетическая функция не является для них основной. Белки - это исочники незаменимых и заменимых аминокислот, а также предшественники биологически активных веществ в организме. Однако при окислении аминокислот образуется энергия. Хотя она и невелика, но составляет некоторую часть энергетического рациона.
Может ли этиловый спирт служить источником энергии?При окислении 1 г этанола выделяется 7 ккал энергии. Это больше, чем при распаде 1 г углеводов, и меньше, чем при распаде 1 г жиров. Энергия, которая выделяется при окислении этанола, запасается в виде АТФ. Метаболизм этанола протекает в печени.
Эта реакция идет в цитоплазме. Затем уксусный альдегид подвергается повторному окислению, но уже в митохондриях.
При окислении этанола до уксусной кислоты выделяется НАДН2, который идет на цепь тканевого дыхания и образуется АТФ.
Уксусная кислота в дальнейшем активируется. Ац-КоА вступает в ЦТК.
Но этанол не является достаточно хорошим источником энергии.
Причины этого следующие.
Образующийся уксусный альдегид и сам этиловый спирт являются токсичными для человека, особенно для клеточных мембран.
Больные алкоголизмом мало потребляют адекватной пищи (мало белков).
Крепкие спиртные напитки не содержат витаминов и минеральных веществ. Поэтому часто встречаются авитаминозы - чаще всего авитаминоз В1: алкогольный полиневрит - синдром Вернике-Корсакова (неврологические расстройства).
Необходимо много НАД для окисления этанола и уксусного альдегида. Поэтому в клетке снижается запас НАД, необходимого окисления естественных продуктов питания. Прежде всего при этом страдают белковый и жировой обмены.
В организме этанол может превращаться только в жиры и стероиды, но из него не может синтезироваться глюкоза и гликоген. А нейроны головного мозга человека потребляют только глюкозу. Поэтому нарушается функция ЦНС.
У алкоголиков наблюдается избыточное образование кетоновых тел, поэтому запах у них изо рта напоминает запах, который встречается у больных сахарным диабетом.
Усиливается синтез кетоновых тел.
Во многих развитых странах люди сейчас страдают от избытка питания, который ведет к ожирению, а в малоразвитых - наоборот, от недостаточности питания.
Недоедание.
12 тыс. человек в мире ежедневно умирают от голода. Недостаточность питания у детей приводит к таким нарушениям, как истощение и квашиоркор.
Квашиоркор развивается у детей при употреблении малокалорийной пищи с недостаточным содержанием белка. Замедляется рост ребенка, развиваются отеки, дегенеративные изменения в печени, почках, поджелудочной железе. Даже если такой ребенок не погибает, все равно длительное белковое голодание делает его инвалидом на всю жизнь. У взрослых при длительном белковом голодании развиваются похожие явления.
Незаменимые вещества организма
Витамины.
Аминокислоты.
Полиненасыщенные жирные кислоты.
Неорганические вещества (минеральные элементы).
Клетчатка.
Клетчатка.
Компонент неутилизируемых пищевых волокон.В состав клетчатки входят целлюлоза, гемицеллюлоза, лигнин, пектин. Эти вещества содержатся во фруктах, овощах, необработанном зерне. Не переваривается в желудочно-кишечном тракте.
Значение клетчатки для питания организма следующее.
Регулирует перистальтику кишечника.
Участвует в формировании каловых масс.
Способствует развитию чувства насыщения при приеме пищи.
Создает необходимые условия для функционирования нормальной микрофлоры кишечника.
Стимулирует выведение холестерина с желчью.
Уменьшает и задерживает всасывание глюкозы (важно для больных сахарным дибетом).
Является сорбентм для токсических веществ.
Незаменимые аминокислоты.
Это такие аминокислоты, которые не синтезируются в организме, а должны поступать извне:Триптофан (суточная потребность 0,5 г в сутки), треонин, изолейцин, лизин, валин, лейцин (суточная потребность около 2 г), фенилаланин (сут.потр.около 2 г), метионин (сут.потр.около 2 г). аргинин незаменим только у детей.
Пищевые белки сильно отличаются по аминокислотному составу. Растительные белки содержат неполный набор аминокислот и в несвойственных нашему организму соотношениях.
Животные белки имеют хорошие химические характеристики и высокую биологическую ценность. Организм хорошо переваривает животные белки и эффективно использует образующиеся при этом аминокислоты.
Белки растительного происхождения имеют низкую химическую ценность. В белках какого-либо одного растения могут отсутствовать одна или несколько аминокислот. Поэтому организм должен получать разнообразную растительную пищу. Белки зерен злаков полностью не перевариваются, так как они защищены оболочкой, состоящей из целлюлозы, которая не расщепляется пищеварительными ферментами желудочно-кишечного тракта.
Незаменимые жирные кислоты.
К ним относятся линолевая и линоленовая кислоты. Они не синтезируются в организме человека и поэтому должны поступать с пищей. Обычно мы не испытываем в них недостатка, так как они содержатся в растительных продуктах (маслах), а также в рыбьем и курином жирах.
В организме незаменимые жирные кислоты входят в состав клеточных мембран, а также являются предшественниками для синтеза биологически активных веществ, таких, как простагландины. Линолевая и линоленовая кислоты являются непосредственными предшественниками арахидоновой кислоты. Именно из арахидоновой кислоты синтезируются простагландины, тромбоксаны и лейкотриены.
Простагландины- это 20-углеродные жирные кислоты, содержащие пятичленное углеводородное кольцо. Различают несколько групп простагландинов, которые отличаются друг от друга наличием кетоносвой и гидроксильной групп в 9-м и 11-м положениях.
Предшественники простагландинов высвобождаются из фосфолипидов мембран (непищевые!) и расщепляются под действием фермента фосфолипазы-А2. Это регуляторная стадия в биосинтезе простагландинов. С помощью этой стадии регулируется количество субстрата, который подвергается последующему действию фермента циклооксигеназы.
Кортикостероиды ингибируют синтез простагландинов, угнетая фермент фосфолипазу-А2. Этим можно объяснить противовоспалительное действие кортикостероидов.
Синтез простагландинов протеккает в 2 стадии.
1-я стадия катализируется ПГ-Н-циклооксигеназой.Этот фермент работает по универсальному механизму и, независимо от того, в каком органе или ткани эта реакция протекает, она заканчивается образованием ПГН2. Это сложный мультиферментный комплекс, который локализуется в микросомах. Он катализирует образование циклопентанового кольца.
Ацетилсалициловая кислота (аспирин), а также все противовоспалительные нестероидные средства подавляют синтез простагландинов, являясь ингибиторами этого фермента.
2-ю стадию катализируют ферменты, общее название которых - конвертазы. Эти ферменты имеют тканевую специфичность, поэтому в каждом типе ткани из ПГН2 образуется свой продукт:
в головном мозге - ПГD;
в половых железах - ПГЕ, ПГF.
Простагландины действуют в тех клетках, где они синтезируются. Характер действия простагландина зависит от типа клетки. В этом заключается принципиальное отличие простагландинов от гормонов.
Физиологические эффекты простагландинов:
простагландины усиливают воспалительные процессы;
регулируют приток крови к определенному органу;
моделируют синаптическую передачу.
ПГЕ вызывает расслабление мускулатуры бронхов и трахеи. ПГЕ1 и ПГЕ2 используются как средства для снятия бронхоспазма (препараты-аэрозоли). В клинике используют препараты ингибиторов простагландинов.
Лабильными продуктами превращения простагландинов являются тромбоксаны. Их функция заключается в том, что они участвуют в регуляции активности тромбоцитов. Являясь мощными стимуляторами образования тромбов, они способствуют агрегации тромбоцитов.
Простациклины предотвращают агрегацию тромбоцитов.
Лейкотриены.
Это тоже производные арахидоновой кислоты. Участвуют в иммунных процессах, воспалительных и аллергических реакциях, обладают спазмолитическим действием,влияют на артериальное давление и проницаемость сосудов
Витамины
Роль витаминов в жизнедеятельности организма
Витамины - это низкомолекулярные органические вещества разнообразного строения.
Объединены в одну группу по следующим признакам.
Витамины абсолютно необходимы организму и в очень небольших количествах.
Витамины не синтезируются в организме и должны поступать извне или синтезироваться микрофлорой кишечника.
Витамины играют одинаковую роль во всех формах жизни, но высшие животные утратили способность к их синтезу. Например, аскорбиновая кислота (витамин "С") не синтезируется в организмах человека, обезьян и морской свинки, так как в процессе эволюции была утеряна ферментная система синтеза этого витамина из глюкозы.
Авитаминоз- это заболевание, которое развивается при полном отсутствии того или иного витамина в организме. В настоящее время авитаминозы обычно не встречаются, а бывают гиповитаминозы при недостатке витамина в организме.
Причины развития гипо - и авитаминозов.
Все причины можно разделить на внешние и внутренние.
Внешние причины гиповитаминозов
Недостаточное содержание витамина в пище (при неправильной обработке пищи, при неправильном хранении пищевых продуктов).
Состав рациона питания (например, отсутствие в рационе овощей и фруктов).
Не учитывается потребность в том или ином витамине. Например, при белковой диете возрастает потребность в витамине "РР" (при обычном питании он может частично синтезироваться из триптофана). Если человек потребляет много белковой пищи, то может увеличиться потребность в витамине "В6" и снизиться потребность в витамине РР.
Социальные причины: урбанизация населения, питание исключительно высокоочищенной и консервированной пищей; наличие антивитаминов в пище. Социальные причины развития авитаминозов существуют в мире. Например, в отдаленных районах Севера, в рационе людей мало овощей и фруктов. Урбанизация также имеет значение, так как в пищу потребляется много консервированных и рафинированнных продуктов. В крупных городах люди недостаточно обеспечены солнечным светом - поэтому может быть гиповитаминоз Д.
Внутренние причины гиповитаминозов.
1. Физиологическая повышенная потребность в витаминах, например, в период беременности, при тяжелом физическом труде.
2. Длительные тяжелые инфекционные заболевания, а также период выздоровления.
3. Нарушение всасывания витаминов при некоторых заболеваниях ЖКТ, например, при желчнокаменной болезни нарушается всасывание жирорастворимых витаминов.
4. Дисбактериоз кишечника. Имеет значение, так как некоторые витамины синтезируются полностью микрофлорой кишечника (это витамины В3, Вc, В6, Н, В12 и К).
5. Генетические дефекты некоторых ферментативных систем. Например, витамин Д-резистентный рахит развивается у детей при недостатке ферментов, участвующих в образовании активной формы витамина Д (1,25-диоксихолекальциферола).
Классификация витаминов
Водорастворимые витамины. К этой группе относят витамины С, Р, В1, В2, В3, ВC, В6, В12, РР, Н.
Жирорастворимые витамины: А, Д, Е, К.
Большинство водорастворимых витаминов должно поступать регулярно с пищей, так как они быстро выводятся или разрушаются в организме.
Жирорастворимые витамины могут депонироваться в организме.Кроме того, они плохо выводятся, поэтому иногда при избытке жирорастворимых витаминов наблюдаются гипервитаминозы - заболевания, связанные с интоксикацией организма высокими дозами жирорастворимых витаминов. Такие заболевания описаны для витаминов А и Д.
Для большинства витаминов известно, что их производные входят в состав коферментов и простетических групп ферментов. Для некоторых витаминов (витамин С) точно известно, в каких реакциях они участвуют, но коферментная функция пока не открыта.
Витамин А (ретинол, антиксерофтальмический)
Необходимо знать формулу витамина А.
Наиболее ранний и специфический признак гиповитаминоза А - гемералопия (куриная слепота) - нарушение сумеречного зрения. Возникает из-за недостатка зрительного пигмента - родопсина. Родопсин содержит в качестве активной группы ретиналь (альдегид витамина А) - находится в палочках сетчатки. Эти клетки (палочки) воспринимают световые сигналы низкой интенсивности.
Родопсин = опсин (белок) + цис-ретиналь.
При возбуждении родопсина светом, цис-ретиналь, в результате ферментативных перестроек внутри молекулы переходит в полностью-транс-ретиналь (на свету). Это приводит к конформационной перестройке всей молекулы родопсина. Родопсин диссоциирует на опсин и транс-ретиналь, что является пусковым механизмом, возбуждающим в окончаниях зрительного нерва импульс, который затем передается в мозг.
В темноте, в результате ферментативных реакций транс-ретиналь вновь превращается в цис-ретиналь и, соединяясь с опсином, образует родопсин.
Витамин А также влияет на процессы роста и развития покровного эпителия. Поэтому при авитаминозе наблюдается поражение кожи, слизистых оболочек и глаз, которое проявляется в патологическом ороговении кожи и слизистых. У больных развивается ксерофтальмия - сухость роговой оболочки глаза, так как происходит закупорка слезного канала в результате ороговения эпителия. Так как глаз перестает омываться слезой, которая обладает бактерицидным действием, развиваются конъюнктивиты, изъязвление и размягчение роговицы - кератомаляция. При авитаминозе А может быть также поражение слизистой ЖКТ, дыхательных и мочеполовых путей. Нарушается устойчивость всех тканей к инфекциям. При развитии авитаминоза в детстве - задержка роста.
В настоящее время показано участие витамина А в защите мембран клеток от окислителей - т. е. витамин А обладает антиоксидантной функцией.
Витамин А запасается в печени.
Пищевые источники- печень морских рыб и млекопитающих, желток яиц, цельное молоко, рыбий жир. Овощи и фрукты красно-оранжевого цвета (томаты, морковь и др.) содержат много каротина - водорастворимого предшественника витамина А, имеющего в молекуле 2 иононовых кольца.
В настоящее время, гиповитаминоз А наблюдается у людей с заболеваниями кишечника, поджелудочной железы, при нарушении желчевыделительной функции печени, т. е. при заболеваниях, при которых нарушается всасывание жира. Высокие дозы витамина А могут приводить к токсическим эффектам. Характерные проявления гипервитаминоза - воспаление глаз, гиперкератоз, выпадение волос, диспептические явления.
Суточная потребность в витамине А - 1-2,5 мг, в каротине - в 2 раза больше.
Витамин Д (холекальциферол, антирахитный)
Сам витамин Д не обладает витаминной активностью, но он служит предшественником 1,25-дигидрокси-холекальциферола (1,25-дигидроксивитамина Д3).
Синтез активной формы протекает в два этапа - в печени присоединяется оксигруппа в положении 25, а затем в почках - оксигруппа в положении 1. Из почек активный витамин Д3 переносится в другие органы и ткани - главным образом в тонкий кишечник и в кости, где витамин Д участвует в регуляции обмена Са и Р. Недостаток витамина Д приводит к развитию нарушений фосфорно-кальциевого обмена и процессов окостенения. В результате у детей развивается рахит, связанный с недостатком Са и Р. Характерные признаки рахита - остеомаляция ("размягчение" костей - запаздывание окостенения), запаздывание закрытия родничков, деформации грудной клетки, позвоночника, конечностей. У таких детей снижен мышечный тонус, наблюдается раздражительность, потливость, выпадение волос.
У взрослых при недостатке витамина Д наблюдается остеопороз - разрежение костной ткани в результате вымывания солей кальция из скелета.
Потребность в витамине Д повышается у беременных.
При благоприятных условиях витамин Д может синтезироваться в организме человека из предшественника - 7-дегидрохолестерина под действием ультрафиолетовых лучей (фотохимическая реакция) в результате разрыва связи в кольце В.
Пищевые источники - рыба, рыбий жир, печень, сливочное масло, желток яиц.
Суточная доза витамина Д3- 10-20 мкг. Высокие дозы витамина Д (выше 1,5 мг в сутки) крайне токсичны. При гипервитаминозе кроме интоксикации наблюдается отложение гидроксиапатита в некоторых внутренних органах (кальцификация почек, кровеносных сосудов).
Витамин К (филлохинон)
Витамин К необходим для нормального синтеза протромбина (фактор II) - предшественника одного из белков системы свертывания - тромбина. Тромбин - это фермент, который катализирует реакцию превращения фибриногена в фибрин - основу кровяного сгустка при активации системы светрывания крови.
При недостатке витамина К синтезируется дефектная молекула протромбина и ряда других факторов свертывания крови. Причина - нарушение ферментативного карбоксилирования глутаминовой кислоты, необходимой для связывания Са2+ белками системы свертывания. Основное проявление недостаточности - нарушение свертывания крови, в результате которого происходят самопроизвольные паренхиматозные и капиллярные кровотечения.
Авитаминоз, как правило связан с нарушением выделения желчи в ЖКТ (при желчнокаменной болезни).
Пищевые источники- ягоды рябины, капуста, арахисовое масло и др. растительные масла. Витамин К также синтезируется микрофлорой кишечника, поэтому одна из причин гиповитаминозов при недостатке витамина в пище - дизбактериоз кишечника (например, при антибиотикотерапии).
Если больной страдает гиповитаминозом К, например, при некоторых видах желтух, то операции - даже удаление зуба - могут сопровождаться длительным кровотечением.
Синтезирован водорастворимый аналог витамина К - викасол, который используют при лечении гиповитаминозов, связанных с нарушением всасывания витамина К из кишечника.
Известны природные антивитамины К - например, дикумарин, салициловая кислота, которые применяют при лечении тромбозов, так как антивитамины К способны снижать количество протромбина в крови.
Суточная потребность точно не установлена, так как витамин синтезируется микрофлорой. Считают, что в сутки потребность около 1 мг.
Является антиоксидантом.При недостаточности витамина Е - дегенеративные изменения в печени, нарушение функций биологических мембран. Витамин Е предохраняет липиды клеточных мембран от окисления активными формами кислорода. Авитаминоз проявляется при очень длительном голодании или при стойком нарушении желчевыделительной функции печени (нарушение всасывания жиров). При этом наблюдаются шелушение кожи, мышечная слабость, стерильность - нарушением функции размножения. Поскольку витамин Е широко распространен в природе (растительные масла, семена пшеницы и др. злаков, сливочное масло), то авитаминоз встречается редко.
Суточная потребность - около 10-30 мг.
Витамин С (аскорбиновая кислота, антицинготный, антискорбутный)
В 1932 г. впервые выделен из сока лимона, через два года искусственно синтезирован. Важное свойство - способность аскорбиновой кислоты легко окисляться.
Биологическая роль витамина С (связана с его участием в окислительно-восстановительных реакциях).
Витамин С, являясь сильным восстановителем, играет роль кофактора в реакциях окислительного гидроксилирования, что необходимо для окисления аминокислот пролина и лизина в оксипролин и в оксилизин в процессе биосинтеза коллагена. Коллаген может синтезироваться и без участия витамина С, но такой коллаген не является полноценным (не формирутся его нормальная структура). Поэтому при недостатке витамина С ткани, содержащие много коллагена, становятся непрочными, ломкими. В первую очередь нарушается структура стенок сосудов, повышается их проницаемость, наблюдаются кровоизлияния под кожу и под слизистые оболочки.
Участвует в синтезе стероидных гормонов надпочечников.
Необходим для всасывания железа.
Участвует в неспецифической иммунной защите организма.
Авитаминоз "С"- цинга. Проявления цинги: болезненность, рыхлость и кровоточивость десен, расшатывание зубов, нарушение целостности капилляров - подкожные кровоизлияния, отечность и болезненность суставов, нарушение заживления ран, анемия. Иногда цинга развивается у новорожденных на искусственном вскармливании пастеризованным молоком, в которое не добавлен витамин С. В основе всех изменений при цинге, за исключением анемии, лежит нарушение синтеза коллагена. Анемия связана с нарушением всасывания железа.
В настоящее время цинга не распространена, но весной у многих людей наблюдается недостаток (гиповитаминоз) витамина "С", что проявляется, например, повышенной утомляемостью, понижением иммунитета.
Основные источники витамина С: свежие зеленые овощи и фрукты.
Следует помнить, что витамин С легко разрушается при нагревании, особенно в щелочной среде в присутствии кислорода, ионов железа и меди. Хорошо сохраняется в кислой среде (в квашеной капусте, в клюкве, в ягодах черной смородины и плодах шиповника). При длительном хранении овощей и фруктов содержание в них витамина "С" уменьшается.
Источником витамина С является также хвоя ели и сосны.
Суточная потребность - около 100 мг в сутки.
Лечебная доза - до 1-2 г в сутки.
Витамин Р (рутин, витамин проницаемости)
Биологическая роль- стабилизация основного вещества соединительной ткани, путем ингибирования фермента гиалуронидазы. При недостатке витамина Р у людей повышается проницаемость кровеносных сосудов, которое сопровождается кровоизлияниями и кровотечениями. Витамин Р усиливает действие витамина С (снижает потребность в нем)
Пищевые источники: зеленые овощи и фрукты, кожура лимона.
Суточная потребность - не установлена.
Витамин группы В
Витамин B1 (тиамин, антиневритный).
Производное витамин В1- ТДФ (ТПФ) является коферментом пируватдегидрогеназного комплекса (фермента пируваткарбоксилазы), -кетоглутаратдегидрогеназного комплекса и фермента транскетолазы (фермента -тотаратдекарбоксилазы), а также входит в состав кофермента транскетолаз - ферментов неокислительного этапа ГМФ-пути..
При недостаточности витамина В1может возникнуть болезнь бери-бери, характерная для тех стран Востока, где основным продуктом питания служит очищенный рис и кукуруза. Для этого заболевания характерна мышечная слабость, нарушение моторики кишечника, потеря аппетита, истощение, периферический неврит (характерный признак - человеку больно вставать на стопу - больные ходят "на цыпочках"), спутанность сознания, нарушения работы сердечно-сосудистой системы. При "бери-бери" повышается содержание пирувата в крови.
Пищевые источники витамина В1 - ржаной хлеб. В кукурузе, рисе, пшеничном хлебе витамин В1практически отсутствует. Это объясняется тем, что в зерне ржи тиамин распределен по всему зерну, а в других злаках он содержится только в оболочке зерен.
Суточная потребность - 1.5 мг/сутки.
Витамин В2(рибофлавин) входит в состав флавинмононуклеотида (ФМН) и флавинадениндинуклеотида (ФАД) - простетических групп флавиновых ферментов.
Его биологическая функция в организме - участие в окислительно-восстановительных реакциях в составе флавопротеидов (ФП).
Недостаточность этого витамина часто встречается в России. Особенно часто бывает у людей, которые не употребляют в пищу черный ржаной хлеб. Проявление гиповитаминоза: ангулярные дерматиты в углах рта ("заеда"), глаз. Часто это сопровождается кератитами (воспаление роговицы). В очень тяжелых случаях бывает анемия. Очень часто сочетаются сочетанные гиповитаминозы витаминов "В2" и "РР",так как эти витамины содержатся в одних и тех же продуктах.
Пищевые источники: ржаной хлеб, молоко, печень, яйца, овощи желтого цвета, дрожжи.
Суточная потребность: 2-4 мг/сутки.
Фолиевая кислота (ВC). В составе 3 структурных единицы: птеридин, ПАБК (парааминобензойная кислота) и глутаминовая кислота.
Часто ПАБК (парааминобензойную кислоту) тоже называют витамином. Но это неверно. ПАБК - это фактор роста для микроорганизмов, которые синтезируют фолиевую кислоту.
Активный С1извлекается из глицина или серина с помощью фермента, в небелковой части которого содержится витамин Вc - фолиевая кислота. Фолиевая кислота два раза восстанавливается в организме (к ней присоединяется водород).
ТГФК является коферментом ферментов, переносящих одноуглеродные радикалы.
Из метилен-ТГФК могут образовываться все другие формы активного С1: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК в результате реакций окисления или восстановления метилен-ТГФК.
Фолиевая кислота в виде тетрагидрофолиевой кислоты является коферментом, участвующим в ферментативных реакциях, связанных с переносом активных одноуглеродных радикалов. Например: биосинтез пуриновых и пиримидиновых мононуклеотидов.
При авитаминозе у человека наблюдается макроцитарная анемия, при которой нарушен синтез ДНК в клетках красного костного мозга, для больных характерна потеря веса.
Пищевые источники: зеленые листья овощей, дрожжи, мясо, шпинат.
Авитаминозы встречаются редко, так как потребность в этом витамине компенсируется за счет микрофлоры кишечника. При некоторых заболеваниях кишечника, когда возникают дисбактериозы, нарушается всасывание фолиевой кислоты.
Суточная потребность: 0.2-0.4 мг.
Витамин В6(пиридоксин) в форме пиридоксальфосфата является простетической группой трансаминаз и декарбоксилаз аминокислот. Он необходим и для некоторых реакций обмена аминокислот. Поэтому при авитаминозе В6 наблюдаются нарушения обмена аминокислот.
В6 также участвует в реакциях синтеза гема гемоглобина (синтез d-аминолевулиновой кислоты). Поэтому при недостатке В6 у человека развивается анемия.
Кроме анемии, наблюдаются дерматиты. Недостаток В6может развиться у больных туберкулезом, потому что этих больных лечат препаратами, синтезированными на основе изониазида - это антагонисты витамина В6.
Пищевые источники: ржаной хлеб, горох, картофель, мясо, печень, почки.
Суточная потребность взрослого человека: 0,15-0,20 мг.
Пантотеновая кислота (витамин В3) Молекула пантотеновой кислоты состоит из бета-аланина и 2,4-дигидрокси-диметил-масляной кислоты. Формулу знать необязательно.
Важность этого витамина в том, что он входит в состав HS-KoA (кофермента ацилирования).
Строение КоА:
тиоэтиламин;
пантотеновая кислота;
3-фосфоаденозин-5-дифосфат.
HSКоА - кофермент ацилирования, т. е. входит в состав ферментов, которые катализируют перенос ацильных остатков. Поэтому В3участвует в бета-окислении жирных кислот, окислительном декарбоксилировании -кетокислот, биосинтезе нейтрального жира, липоидов, стероидов, гема, ацетилхолина.
При недостатке пантотеновой кислоты при дисбактериозе у человека развиваются дерматиты, в тяжелых случаях - изменения со стороны желез внутренней секреции, в том числе надпочечников. Также наблюдается депигментация волос, истощение.
Дата добавления: 2016-01-05; просмотров: 130; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
