Водородный показатель. Характер среды
Диссоциация воды протекает по типу очень слабого электролита:
НОН «Н+ + ОН-
Кд (Н2О) при 250С = 1,8×10‾716; [Н2О] в 1л = 55,56 моль/л;
1,8×10‾16×55,56 = 1×10‾14. Тогда [Н+][ОН‾] = const = 10‾14 = Кв.
Ионное произведение воды: в чистой воде, а также в любом водном растворе произведение концентрации ионов воды при неизменной температуре является постоянной величиной, которую обозначают Кв или Кн2о.
В чистой воде [Н+]=[ОН‾] = Ö10‾14 = 10‾7моль/л.
Водородный показатель среды (рН) – отрицательный десятичный логарифм концентрации водородных ионов.
рН = - lg с(Н+ ); где с(Н+) – молярная концентрация ионов водорода (Н+).
| Среда водного раствора | с (Н+), моль/л | с (ОН‾), моль/л | рН |
| Нейтральная | 10‾7 | 10‾7 | |
| Кислая | больше 10‾7 | Меньше 10‾7 | меньше 7 |
| Щелочная | меньше 10‾7 | Больше 10‾7 | больше 7 |
· рН раствора любой кислоты < 7 (среда кислая). Причем, чем сильнее кислота, тем рН меньше (при одинаковой общей молярной концентрации кислот);
· рН раствора любого основания > 7 (среда щелочная). При одинаковых общих молярных концентрациях оснований наиболее щелочная среда (больше рН в растворе сильного основания).
Гидролиз солей
Гидролиз солей – результат поляризационного взаимодействия ионов соли с их гидратной оболочкой (водой), приводящее к образованию слабого электролита и изменению характера среды водного раствора.
Соль тем сильнее гидролизуется, чем слабее кислота или основание, из которых образована соль.
(1) 1ст. Кn+ + H OH → КОН(n-1)+ + Н+; среда кислая
(2) 1ст. Аn- + Н ОН → НА(n-1)- + ОН-; среда щелочная
(3)
|
Кn+ + Аn- + НОН → К(ОН)n + НnА;
Случаи (1), (2), (3) – гидролиз по катиону (соль образована слабым основанием); гидролиз по аниону (соль образована слабой кислотой); гидролиз по катиону и аниону (соль образована слабым основанием и слабой кислотой).
BeCI2 ® Be2+ + 2CI‾
1ст. BeCI2 + HOH «BeOHCI + HCI; Be2+ + H OH «BeOH+ (м.д.с.) + Н+
Na2CO3® 2Na+ + CO32‾
1ст. Na2CO3 + HOH «NaHCO3 + NaOH; CO32‾ + H OH «HCO3‾ + ОН‾
Если ПВ (ион соли – вода) не может привести к образованию слабого электролита, то говорят, что по такому иону гидролиз не протекает. К ним относятся катионы щелочей и анионы сильных кислот.
ПВ (ион соли – вода) возрастает если:
· по модулю заряд иона: Mg2+ ® AI3+; SO32‾ ® PO43‾…
Для солей, гидролизующихся ступенчато, гидролиз ограничивается предпоследней ступенью, при этом глубина с каждой ступенью уменьшается: hr!>hr2и Кг' > К,2.
Например: hr(А1С13) >hr(А10НС12) >hr(А1(ОН)2С1).
Отсутствие осадка А1(ОН)3 в растворе соли А1С13 указывает на ограничение гидролиза второй стадией, т.к. соль полностью не разлагается водой.
· ¯ радиус иона при одинаковых зарядах: Mg2+ ® Be2+; Se2‾ ® S2‾…
· деформируемость электронной оболочки иона: Ca2+® Fe2+; SO42‾ ® SO32‾
Факторы, влияющие на глубину гидролиза
Гидролиз солей - процесс в основном, обратимый (равновесный), поэтому усиление (hpT, КГТ) или ослабление (hri, Кг-1) процесса гидролиза определяются принципом смещения химического равновесия - принципом JleШателье.
Следует отметить, что чём глубже идет гидролиз соли по катиону, тем выше кислотность (рН4), и наоборот, чем глубже идет гидролиз по аниону, тем выше щелочность (рНТ) водного раствора соли.
Факторы, влияющие на глубину гидролиза
природа соли - катионы щелочных и щелочно-земельных металлов (Na+, К+, Rb+, Са2+, Sr2+, Ва2+ и т.д.) и анионы сильных кислот (СГ, Вг“, Г, С104", SO^, N03“) гидролизу не подвергаются, т.к. с ионами воды не образуют мдс;
температура среды - гидролиз является эндотермическим процессом, следовательно, в соответствии с принципом JleШателье, нагревание раствора усиливает гидролиз;
концентрация раствора - разбавление раствора, усиливает гидролиз;
поляризующее действие ионов - усиление ион-дипольного взаимодействия (при увеличении заряда, деформации электронной оболочки и уменьшении радиуса иона) способствует распаду гидратной оболочки ионов, тем самым усиливает гидролиз.
Гидролиз можно усилить путем связывания одного из продуктов гидролиза (ионов Н+ или ОН") в молекулы воды (Н20) за счет введения:
кислоты, если при гидролизе образуются ионы ОН
щелочи, если при гидролизе образуются ионы Н+;
раствора соли, гидролизующейся по аниону, если исходная соль гидролизуется по катиону, и наоборот.
Например: гидролиз соли А1С13, гидролизующейся по катиону (среда кислая) усиливается при нагревании или разбавлении раствора, а также введении в раствор щелочи (образуется вода) или раствора соли, гидролизующейся по аниону (Na2C03).
Учитывая, что при гидролизе образуется слабый электролит (мд.с.), то по константе диссоциации (К) образовавшегося мд.с. можно судить о глубине гидролиза: чем Ф К (чем слабее электролит), тем глубже гидролиз (hr, Кг).
Например:
hr (FeCl3) >hr (FeCl2), т.к. Кд(Fe(OH)3) < Кд(Fe(OH)2)
Полный и неполный гидролиз
Гидролиз, сопровождающийся полным разложением вещества под действием воды, называется полным и является необратимым процессом. В случае неполного разложения вещества наблюдается неполный гидролиз, он протекает обратимо.
Случаи неполного гидролиза
соль гидролизуется по катиону, заряд которого меньше 4:
Be2+С121_ + Н+ОН-BeOHCl+ НС1
соль гидролизуется только по аниону:
Na2+С03 ** + Н+ОН“ <н>NaHC03+ NaOH
Случаи полного гидролиза:
соль гидролизуется по катиону, заряд которого равен или больше:
Ti4+С14+ 4Н+ОН" ->Ti(OH)4i+ 4НС1Т
соль гидролизуется по катиону и аниону одновременно:
(NH4)2+S^ + 2Н+ОНГ ->2NH4OH + H2ST
бинарные соединения двух неметаллов или активного металла и неметалла (нитриды, карбиды, силициды, гидриды, пероксиды, фосфиды, арсениды металлов I-А, II-Aподгрупп, кроме бериллия):
B3+ci31_+ зн+он" -* н3во34 + 3hciT
Na1+Н + Н+.ОН" NaOH+ Н2Т
В случае полного разложения солей водой (hr—► 100%) получить их водные растворы лрактически невозможно. Такие соли (сульфиды, карбонаты, силикаты железа, алюминия, хрома) существуют только в сухом виде и в таблице растворимости напротив них ставят прочерк. В этом случае, продуктами гидролиза являются малорастворимые и летучие соединения:
A12S3+ 6Н20 2А1(ОН)3! +3H2St
Следует отметить, что при смешивании водных растворов двух солей, одна из которых гидролизуется по катиону, а другая по аниону, между ними протекает не реакция обмена,а наблюдается реакция взаимного усиления гидролизаобеих солей.
Например, между водными растворами солей ВаС12 и Na2C03протекает реакция обмена, так как соль ВаС12 гидролизу не подвергается, а соль Na2C03гидролизуется по аниону:
, ВаГ^ + Na2C03^ ВаС034 + 2NaClВ случае смешивания водных растворов солей CrCl3nNa2C03протекает реакция взаимного усиления гидролиза, так как соль
CrCLгидролизуется по катиону, а соль Na2C03гидролизуется по аниону. Образующиеся в результате гидролиза ионы Н+ от соли СгС13 и ионы ОН" от соли Na2C03связываются между собой в воду (Н20), раствор при этом разбавляется, и соответственно усиливает гидролиз обеих солей:
2СгС13 + 3Na2C03+ ЗНОН -► 2Cr(OH )31 + ЗСО/Г + 6NaCl
Следует отметить, что гидролитические процессы принимают активное участие в поддержании в организме кислотнощелочного равновесия (КЩР) необходимого для нормального течения процессов обмена веществ. При нормальном состоянии здоровья в составе крови преобладает слабощелочная среда, pH 7,45. Крайне кислое рН=7,32 или крайне щелочное рН=7,56 состояние крови вызывает различные заболевания. Поскольку минеральный состав пищи богат как катионами (кальций, магний, калий, натрий), имеющих щелочную ориентацию, так и анионами (фосфаты, сульфаты, хлориды), имеющих кислую среду очень важно правильное питание
ВОПРОС
Основные понятия об ОВР
Окислительно востоновительными называют реакции, в которых происходит изменение степени окисления элементов, образующих молекулы реагирующих веществ.
Изменение степени окисления атома может произойти только в результате присоединения или отдачи электронов, поэтому ОВР можно определить как реакции в которых происходит переход электронов от одних атомов к другим.
Частицы отдающие электроны, называются востановителями, а сам процесс отдачи электронов называется процессом окисления.
При окислении степень окисления элемента повышается.
Например:
Zn0-2e->zn2+
2Br—-2e-> 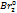
Частицы присоединяющие электрон называют окислителями, а сам процесс востановлением.
При окислении степень окисления понижается
Например:
Cu2++2e->Cu0
В процессе овр востановитель окисляется, а окислитель востанавливается.
В реакции ОВР окисление и востановление происходит одновременно.
К ОВР относятся реакции замещения, некоторые реакции присоединения и разложения. Реакции обмена не являются ОВР.
Например:
Ba+h2so4-> baso4+h2
Na2o+h2o=2naoh
2nh3=n2+h2
ОПРЕДЕЛЕНИЕ РОЛИ ВЕЩЕСТВА В ОВР
В качестве окислителя и востановителя могут выступать простые и сложные вещества. Металлы в свободном состоянии могут быть только востановителями, а не металлы кроме фтора, проявляют как окислительные так и востановительные свойства.
По значеню степени окисления атома элемента в сложном соединении можно определить в целом роль вещества в ОВР:
При минимальной степени окисления элемента, вещества проявляют только востановительные свойства.
При максимальной степени окисления, окислительными свойствами
При промежуточной степени окисления, востановительными, окислительными и двойственными свойствами.
Например: вещества окислители: KMn7+o, HN5+o3
Вещества востановители: N3-H3
ОКС ВОСТ ДВОЙСТВ: Mn4+02
11.2. Влияние различных факторов на ход ОВР
На ход ОВР влияют:
· Среда, в которой протекает ОВР
MnO4- восстанавливается в кислой среде до Mn2+ (а), в нейтральной среде до MnO2(б), а в щелочной среде до MnO42- (в) :
(а) 5NaNO2 + 2KMnO4 + 3H2SO4 ® 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O
(б) NaNO2 + 2KMnO4 + 2KOH ® NaNO3 + 2K2MnO4 + H2O
(в) 3NaNO2 + 2KMnO4 + H2O ® 3NaNO3 + 2MnO2¯ + 2KOH
· Концентрация реагентов
* H2SO4 (разб.) + Fe ® FeSO4 + H2; H2SO4 (конц.) + Fe ¹(холод);
6H2SO4 (конц.) + 2Fe ® Fe2(SO4)3 + 3SO2 + H2O (T)
* Zn + Н2SO4 (разб.) ® ZnSO4 + Н2
4Zn + 5Н2SO4 (конц, с2) ® 4ZnSO4 + Н2S + 4Н2О
3Zn + 4Н2SO4 (конц, с1) ® 3ZnSO4 + S + 4Н2О; с1< с2
· Температура
· Cl2 + 2NaOH ® NaClO + NaCl + H2O (охлаждение, Т↓);
3Cl2 + 6NaOH ® NaClO3 + 5NaCl + 3H2O (нагревание, T)
· Природа и участие катализатора
NaI Na2S4O6 + H2O
* Na2S2O3 + H2O2 Na - тетратионаты
Na - тиосульфаты
H2MoO4 NaHSO4 + H2O
Na – гидросульфаты
* 2КClO3 ® 2KCl + 3 O2 (с участием Кt – MnO2)
4КClO3 ® KCl + 3KClO4 (без Кt)
11.3. Типы ОВР
ОВР подразделяются на:
· Межмолекулярные ОВР – это ОВР, в которых электроны переходят от одного вещества к молекулам другого вещества. Атомы восстановители и атомы окислители входят в состав различных исходных веществ.
Например :Mn4+ O2 + 4H Cl - ® Mn2+ Cl2 + Cl2 0 + 2H2O
· Внутримолекулярные ОВР - это ОВР, в которых электроны переходят от атомов восстановителей к атомам окислителей внутри молекул одного и того же вещества. Атомы восстановители и атомы окислители входят в состав молекул одного и того же исходного вещества и являются атомами различных элементов или одного элемента, но с различной степенью окисления.
Например: 2K Cl5+O2- 3 ® 2K Cl - + 3 O0 2
· ОВР диспропорционирования (самоокисления-самовосстаноления) - это ОВР, в которых одна часть молекул выступает в роли восстановителя, а другая – в роли окислителя. Атомы восстановители и атомы окислители входят в состав молекул одного и того же исходного вещества, являются атомами одного и того же элемента и имеют одинаковую степень окисления.
Например: 4 K2 S4 +O3 ® K2 S 2- + 3 K2 S 6+O4
· ОВР конпропорционирования - эти реакции противоположные реакциям диспропорционирования. Атомы восстановители и атомы окислители входят в состав различных исходных веществ, но являются атомами одного и того же элемента с различной степенью окисления, в результате реакции образуются молекулы одного и того же продукта.
Например: S 4+O2 + 2 H2 S 2- ® 3 S 0 + 2 H2O
ВОПРОС 17
Дата добавления: 2016-01-03; просмотров: 98; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
