МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2004 рік. 1. В реакції 15г гідрокарбонату деякого лужного металу з надлишком хлоридної кислоти утворилось 3,36л (н.у.)
Й клас
1. В реакції 15г гідрокарбонату деякого лужного металу з надлишком хлоридної кислоти утворилось 3,36л (н.у.). Визначте формулу гідрокарбонату, складіть рівняння названої реакції та реакції гідролізу солі в йонній та молекулярній формах. (4,5 балів).
2. Визначте масу кальцій хлориду гексагідрату, яку потрібно добавити до 200 мл розчину, кальцій хлориду (ρ = 1,01 г/мл) з масовою часткою солі 5%, щоб одержати розчин з масовою часткою 0,2.
Балів).
3. 5г суміші Al – Mg – SiO2 розділили навпіл. Одну частину обробили розчином лугу, внаслідок чого виділилось 1,12л водню (н.у.); другу — хлоридною кислотою, внаслідок чого виділилось 2,24л водню. Визначте відсотковий склад суміші. (6 балів).
4. При взаємодії 1,28г невідомого металу з концентрованим розчином нітратної кислоти утворюється сіль двовалентного металу і виділяється 896мл (н.у.) газу, що містить 30,43% Нітрогену і 69,57% Оксигену. Густина газу за воднем дорівнює 23. Знайдіть невідомий метал.
Балів).
5. Закінчіть рівняння реакцій, вкажіть окисник і відновник. Складіть електронний баланс:
a) NH4NO2 → N2 + …
б) HClO4 → ClO2 + O2 + …
в) Ca3(PO4)2 + Ca3P2 → P + CaO (5,5 бала)
6. Сульфур (IV) оксид, що утворився внаслідок повного згоряння 179,2л гідроген сульфіду (Н2S), пропущено крізь 2л розчину натрій гідроксиду (ρ =1,28 г/мл) з масовою часткою NaOH 25%. Який склад утвореної солі? (5 балів).
|
|
|
Й клас
1. В результаті спалювання 18г невідомого вуглеводню одержали 25,2л (н.у.) карбон (IV) оксиду. Відомо, що 10л цього вуглеводню має масу 7,14г. Визначте формулу речовини. (4 бали).
2.Визначте масу кальцій хлориду гексагідрату, яку потрібно добавити до 200 мл розчину кальцій хлориду (ρ = 1,01 г/мл) з масовою часткою солі 5%, щоб одержати розчин з масовою часткою 0,2.
Балів).
3.Визначити молекулярну формулу і будову вуглеводню, здатного
приєднати 4 атоми брому; від дії купрум (І) хлориду він утворює осад червоного кольору, а при гідратації за Кучеровим — сполуку, при окисненні якої утворюється суміш мурашиної, пропіонової та оцтової (переважно) кислот. Відповідь ілюструвати рівняннями реакцій. (7 балів).
4.24,8г оксиду одновалентного металу розчинили в 175,2г води. Знайти масову частку розчиненої речовини в одержаному розчині, якщо в оксиді масова частка Оксигену складає 25,8%. (5 балів).
|
|
|
5.На нейтралізацію 0,1М карбонової кислоти з молярною масою 90г/моль затрачено 40г розчину натрій гідроксиду з масовою часткою NaOH 0,2. Визначте основність кислоти, складіть її структурну формулу, опишіть хімічні властивості, підтвердивши відповідними рівняннями хімічних реакцій. (7 балів).
6.а) В результаті взаємодії арсен (V) сульфіду з розчином нітратної кислоти (в реакцію вступають і молекули води) утворюється ортоарсенова кислота, сульфатна кислота і нітроген (II) оксид. Напишіть рівняння реакцій, розставте коефіцієнти, вкажіть окисник і відновник.
б) Закінчити рівняння реакцій:
1) Н3РО3 → РН3 + H3PO4
2) NH4NO2 → N2 + …
Балів).
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2004 рік
РОЗВ'ЯЗКИ ЗАДАЧ МІСЬКОЇ ОЛІМПІАДИ З ХІМІЇ
Й клас
 1. Дано: Розв’язок:
1. Дано: Розв’язок:
m (молекули Н2О) = 1моль Н2О містить 6,02∙1023 молекул.
= 2,99∙10-26 кг Тоді:
ν (Н2О) = 1моль 1 молекула Н2О → 2,99∙10-26 кг
|
|
|
6,02∙1023 молекул Н2О → х кг
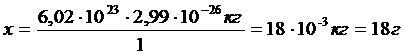
m (Н2О) – ?
Відповідь: 18г.
 |
Дано: Розв’язок:
О2, Н2, СО2 О2 — тліючою скіпкою, вона розгоряється;
 Н2 — скіпкою, яка горить:
Н2 — скіпкою, яка горить:
Де який газ? якщо чистий водень — він загорить;
якщо суміш — «свистящий звук».
СО2 — скіпка, яка горить — гасне (СО2 не підтримує горіння).
3. Дано: Розв’язок:
 FexSy 1) Fe2O3 → 2Fe
FexSy 1) Fe2O3 → 2Fe
O2 160г 112г
m (Fe2O3) = 20г 20г х
|
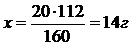 m (SO2) = 16г
m (SO2) = 16г

Формула?
2) SO2 → S
64 32
16 х
|
|
|
|
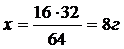
3) Складаємо атомний фактор
Fe : S = 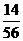 :
: 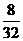 = 0,25 : 0,25 = 1 : 1
= 0,25 : 0,25 = 1 : 1
FeS
Відповідь: FeS.
4.  Дано: Розв'язок:
Дано: Розв'язок:
Mg на повітрі Нехай маса Mg, до реакції 100 г, тоді 10% - це 10 г Оксигену, тому щ
окиснився що маса суміші збільшилась за рахунок окиснення.
m(Mg) > на 10% Отже маса суміші (MgO та Mg) після реакції – 110 г.
10г. х
 ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
ν(Mg) до ν(MgO) За рівнянням: 2Mg + О2 = 2 MgO х = 10 · 80 : 32 = 25г (MgO)
1 моль 2 моль
32г. 80г.
Тоді в 110 г суміші буде 25г. MgO і 110 – 25 = 85 г Mg
ν(Mg) = 85 : 24 = 3,4 моль; ν(MgO) = 25 : 40 = 0,625 моль
ν(Mg) : ν(MgO) = 3,4 : 0,625 = 17 : 5
Відповідь: 17 моль Mg до 5 моль MgO.
Дата добавления: 2018-02-18; просмотров: 1124; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
