МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік. 3.Знаходимо кількість речовини фосфору, що прореагував.
0,007моль х
4Р + 5О2 = 2Р2О5
4 моль 5 моль
3.Знаходимо кількість речовини фосфору, що прореагував.
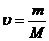 ;
;  (Р) = 0,217г : 31г/моль = 0,007 моль
(Р) = 0,217г : 31г/моль = 0,007 моль
4. Знаходимо кількість речовини кисню, що витратився на
спалювання фосфору за рівнянням реакції.
0,007 моль ( Р ) - х моль О2
4 моль ( Р ) - 5 моль О2
х = 0,007моль · 5моль : 4 моль = 0,00875 моль
5. Знаходимо об’єм кисню, що витратився на спалювання
фосфору.
V= 
 ; V ( О2 ) = 0,00875 моль · 22,4 моль/л = 0,196 л.
; V ( О2 ) = 0,00875 моль · 22,4 моль/л = 0,196 л.
6. Знаходимо об’єм повітря.
100 л повітря - 21 л О2
х л повітря - 0,196 л О2
х = 100 % · 0,196 л : 21 % = 0,933 л або 933 мл
Відповідь : 933 мл повітря.
-
 Дано : Розв’язок :
Дано : Розв’язок :
Na2CO3· x H2O 1. Знаходимо молярну масу речовини.
W ( Na ) = 16,08 % W=  ; Мr =
; Мr = 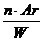 ;
;
Мr = 2 · 23 : 0,1608 = 286
 М = 286 г/моль
М = 286 г/моль
х - ? 2. Знаходимо число молекул води в речовини
|
|
|
Мr (Na2CO3· x H2O) = 2· Аr(Na) + Аr(С) + 3· Аr(О ) + х · Мr(H2O)
286 = 2· 23 + 12 + 3 · 16 + х · 18
286 = 106 + 18х
18х = 180
х = 10
Формула : Na2CO3· 10 H2O
Відповідь : 10 молекул води.
-
 Дано : Розв’язок :
Дано : Розв’язок :
m (суміші Аl і Ме ) =1,82г 1. Знаходимо масу алюмінію в суміші.
V (H2) = 0,672 л Ме + НСl = реакція не відбувається, бо
 V (О2) = 0,56 л метал стоїть після водню в
V (О2) = 0,56 л метал стоїть після водню в
Ме - ? електрохімічному ряді напруг металів.
W ( Ме ) - ? x 0,03 моль
2Аl + 6 HCl = 2AlCl3 + 3H2
2 моль 3 моль
|
|
|
а) знаходимо кількість речовини водню, що виділився.
 ;
;  = 0,672 л : 22,4 л/моль = 0,03 моль ( Н2)
= 0,672 л : 22,4 л/моль = 0,03 моль ( Н2)
б) знаходимо кількість речовини алюмінію за рівнянням реакції.
х моль Аl - 0,03 моль H2
2 моль Аl - 3 моль H2
х = 2моль · 0,03моль : 3 моль = 0,02 моль (Аl )
в) знаходимо масу алюмінію.
m =  M M ( Al ) = 27 г/моль m (Al) = 0,02 моль · 27 г/моль = 0,54 г.
M M ( Al ) = 27 г/моль m (Al) = 0,02 моль · 27 г/моль = 0,54 г.
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
2.Знаходимо масу метала в суміші.
m (Ме) = m (суміші) – m (Al)
m (Ме) = 1,82г – 0,54г = 1,28 г
3. Знаходимо масову частку металу в суміші.
W(речовини) =  ; W(Me) = 1,28 г : 1,82 г = 0,70 або 70%
; W(Me) = 1,28 г : 1,82 г = 0,70 або 70%
4. Знаходимо, що це за метал .
а) знаходимо кількість речовини кисню, що пішов на спалювання алюмінію.
0,02 моль х
4Al + 3O2 = 2Al2O3; х = 0,02моль · 3 моль : 4моль = 0,015 моль
|
|
|
4 моль 3 моль
б) знаходимо кількість речовини кисню, що пішов на спалювання суміші.
 ;
;  0,56 л : 22,4 л/моль = 0,025 моль
0,56 л : 22,4 л/моль = 0,025 моль
в) знаходимо кількість речовини кисню, що пішов на спалювання невідомого металу.
 = 0,025 моль – 0,015 моль = 0,01 моль ( О2 )
= 0,025 моль – 0,015 моль = 0,01 моль ( О2 )
г) знаходимо еквівалентну масу металу.
1,28г 0,32г
Ме + О2 = Ме2Ох Еквівалентна маса ( О2) = 8 г/екв.;
х 8 г/екв. m(O2)=0,01моль·32г/моль = 0,32 г
х = 1,28 г · 8 г/екв. : 0,32 г = 32 г/екв. невідомого металу
д) За формулою Екв. =  , де n – валентність металу, знаходимо Аr(Ме).
, де n – валентність металу, знаходимо Аr(Ме).
Нехай метал одновалентний, тоді Аr (Ме) = 32 г/екв·1=32 (такого Ме не існує)
Нехай метал двовалентний, тоді Аr (Ме) = 32 г/екв·2=64 (Аr (Сu)=64, тоді це мідь)
Нехай метал трьохвалентний, тоді Аr (Ме) = 32 г/екв·3=96 (такого Ме не існує)
Відповідь : метал – Сu; W ( Ме ) = 0,7 (70 %).
 9-й клас
9-й клас
- Дано: Розв’язок:
СаО х 130г
|
|
|
 Δm = 30% СаО + Н2О = Са(ОН)2
Δm = 30% СаО + Н2О = Са(ОН)2
Чи все вапно 56г 74г
прореагувало? Нехай є 100 г СаО, тоді m(Са(ОН)2 = 130 г.(якщо все негашене вапно
прореагувало)
Знаходимо, яка маса негашеного вапна повинна прореагувати, щоб утворилось 130 г гашеного вапна за рівнянням реакції.
Х = 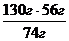 = 98,4г, таким чином не все негашене вапно прореагувало.
= 98,4г, таким чином не все негашене вапно прореагувало.
Відповідь: не все негашене вапно вступило в реакцію.
 2. Дано: Розв’язок :
2. Дано: Розв’язок :
АВ2 Оскільки елементи І – ІІІ групи не утворюють летких
W1 (Н) = 25% водневих сполук, то ця речовина скоріше всього
 W2 (Н) = 11,1% складається з елементів 4 і 6 групи. Скоріше всього
W2 (Н) = 11,1% складається з елементів 4 і 6 групи. Скоріше всього
АВ2 - ? це будуть С і О, але перевіримо.
АН4 – воднева сполука елемента А.
W(Н) = 25% W(А) = 75%
МІСЬКА ОЛІМПІАДА З ХІМІЇ. 2003 рік
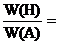
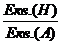 ;
; 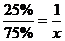 ; х = 75%∙ 1 ׃ 25% = 3 ( Екв. А )
; х = 75%∙ 1 ׃ 25% = 3 ( Екв. А )
Екв.=  ; Якщо n=2, тоді Аr ( А ) = 6 – не існує;
; Якщо n=2, тоді Аr ( А ) = 6 – не існує;
Якщо n=3, тоді Аr ( А ) = 9 – Ве
Якщо n=4, тоді Аr ( А ) = 12 – С
Н2В – воднева сполука елемента В.
W(Н) = 11,11%
W(В) = 88,89%
Екв.(Н) = 1, за законом еквівалентів
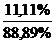 =
=  ; х =
; х = 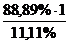 = 8, це еквівалент Оксигену.
= 8, це еквівалент Оксигену.
Отже речовина АВ2 буде СО2 .
Відповідь:СО2 .
3.
1) ВаО + SO3 = BaSO4
2) ВаО + Н2О = Ва(ОН)2
SO3 + Н2О = Н2 SO4
Ва(ОН)2 + Н2 SO4 = BaSO4 +2Н2О
3) Ва(ОН)2 +2НСl = ВаСl2 + 2Н2О
Н2 SO4 +2NaOH = Na2SO4 + 2Н2O
ВаСl2 + Na2SO4 = BaSO4 + 2NaCl
Відповідь : Х – це речовина барій сульфат.
4. -2 +4 0
а) 2Н2S + SO2 = 3S + 2H2O

 -2 -2ĕ 0
-2 -2ĕ 0
S → S 2 відновник
+4 +4ĕ 0 4
S → S 1 окисник
б) +3 +5 +2

 3HNO2 = HNO3 + 2NO + H2O
3HNO2 = HNO3 + 2NO + H2O
+3 +1ĕ +2
N → N 2 - окисник
+3 -2ĕ +5 2
N → N 1 - відновник
 5. Дано : Розв’язок :
5. Дано : Розв’язок :
V1(розчину NaCl)=500мл 1.Знаходимо масу вихідного розчину.
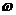 1( NaCl) = 20% m=
1( NaCl) = 20% m=  ∙V
∙V
 1(розчину) = 1,152г/мл m1(р-ну)=1,152г/мл ∙ 500мл = 576г
1(розчину) = 1,152г/мл m1(р-ну)=1,152г/мл ∙ 500мл = 576г
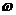 2(NaCl) = 4,5% 2. Знаходимо масу NaCl в вихідному розчині.
2(NaCl) = 4,5% 2. Знаходимо масу NaCl в вихідному розчині.
 2(розчину) = 1,027г/мл
2(розчину) = 1,027г/мл 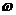 =
= 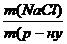 ; m(NaCl)=
; m(NaCl)= 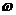 ∙m(р-ну)
∙m(р-ну)
 V2(розчину) - ? m1(NaCl)= 0,2 ∙ 576г = 115,2г
V2(розчину) - ? m1(NaCl)= 0,2 ∙ 576г = 115,2г
3.Знаходимо масу добутого розчину.
m1(NaCl) = m2(NaCl)
m(р-ну) = m(NaCl) : 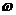 2;
2;
Дата добавления: 2018-02-18; просмотров: 1037; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
