Внутреннее трение (вязкость) газов
Внутреннее трение связано с взаимодействием между слоями газа, перемещающимися параллельно друг другу с разными по величине скоростями. Причиной внутреннего трения является наложение упорядоченного движения слоев газа с различными скоростями на хаотическое тепловое движение молекул со средней скоростью < u >, величина которой зависит от температуры.
|
|
Благодаря тепловому движению, молекулы переходят из слоя, движущегося со скоростью v1 , в слой, движущийся со скоростью v2 и наоборот. При этом молекулы переносят импульсы своего упорядоченного движения.
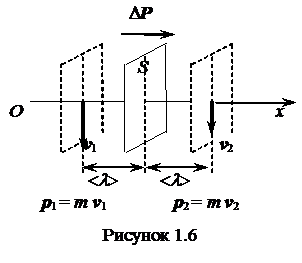
Рассмотрим площадку S (рис.1.6), расположенную между двумя слоями газа, движущегося соответственно со скоростями v1 и v2 (v1 >v2), т.е. наблюдается неоднородность в отношении импульса упорядоченного движения молекул.
Так как v1 > v2 , то m v1 > m v2 .
Уравнение переноса примет вид
DР = DN m v , (2.8)
DР = – 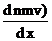 <l><u> S t = –
<l><u> S t = – <l> <u> n m
<l> <u> n m 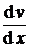 S t , (2.9)
S t , (2.9)
где DР - изменение импульса слоя газа, ограниченного площадкой S, за время t.
Изменение импульса слоя газа равно импульсу силы трения, действующему в направлении движения газа (параллельному площадке S), т.е. DР = Fтр t.
Тогда fтр = 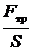 = –
= –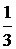 <l> <u> n m
<l> <u> n m 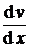 = –
= – <l> <u> r
<l> <u> r 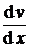 ,
,
где fтр - сила трения, действующая на единицу площади, r - плотность газа.
Обозначив  <l> <u> r = h ,
<l> <u> r = h ,
получим
fтр = – h  . (2.10)
. (2.10)
|
|
|
Полученное уравнение называется уравнением внутреннего трения (вязкости) или законом Ньютона.
Коэффициент внутреннего трения (вязкости) h не зависит от давления, если средняя длина свободного пробега меньше размеров сосуда.
Явление переноса в жидкостях
Молекулы жидкости расположены, в отличие от молекул газа, близко друг к другу и взаимодействуют друг с другом. Между молекулами располагаются микрополости. Молекула жидкости колеблется около положения равновесия некоторое время t, затем она “перескакивает” на расстояние порядка среднего расстояния <d> между соседними молекулами (рис.1.7). Среднее время <t> нахождения молекулы около положения равновесия (время релаксации) зависит от температуры, уменьшаясь с ее увеличением. Средняя скорость перемещения молекул жидкости < v > = 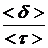 невелика (значительно меньше, чем скорость молекул газа при той же температуре).
невелика (значительно меньше, чем скорость молекул газа при той же температуре).
 В жидкостях, как и газах, в случае появления пространственной неоднородности плотности, температуры или скорости упорядоченного движения молекул, возникают явления переноса - диффузия, теплопроводность и внутреннее трение. Явления переноса в жидкостях, как и в газах, обусловлены тепловым движением молекул и подчиняются тем же законам Фика, Фурье и Ньютона.
В жидкостях, как и газах, в случае появления пространственной неоднородности плотности, температуры или скорости упорядоченного движения молекул, возникают явления переноса - диффузия, теплопроводность и внутреннее трение. Явления переноса в жидкостях, как и в газах, обусловлены тепловым движением молекул и подчиняются тем же законам Фика, Фурье и Ньютона.
|
|
|
Особенности строения жидкости и теплового движения их молекул сказываются на значениях коэффициентов переноса и на их зависимости от параметров состояния.
Коэффициент диффузии D жидкостей возрастает с увеличением температуры, что связано с сокращением времени релаксации и некоторым увеличением среднего расстояния <d > между положениями равновесия.
Процесс теплопроводности в жидкостях осуществляется путем взаимодействия колеблющихся молекул. Так как молекулы жидкости расположены близко друг к другу, то коэффициент теплопроводности у них значительно больше, чем у газов.
Механизм внутреннего трения у жидкостей отличен от газов. Молекулы жидкостей большую часть времени находятся около положения равновесия, поэтому масса жидкости увлекает соседние слои, в основном, за счет сил сцепления. Коэффициент внутреннего трения у жидкостей с ростом температуры резко уменьшается. Вязкость жидкости во много раз больше, чем вязкость газа.
Реальные газы
Как уже отмечалось, поведение реальных газов хорошо описывается в модели идеального газа, когда расстояния между молекулами очень велики по сравнению с размерами самих молекул. Однако при больших степенях сжатия и при низких температурах становятся заметными отклонения в их поведении от уравнения Менделеева - Клапейрона. Причины такого отклонения достаточно банальны. Они связаны прежде всего с тем, что молекулы газа имеют конечный объем, тогда как в модели идеального газа они считаются материальными точками. Кроме того, между отдельными молекулами существуют силы взаимодействия, т.е. у молекул кроме кинетической энергии их хаотического движения появляется потенциальная энергия. Голландский ученый Ван-дер-Ваальс первый сумел придумать новую модель, которая учитывала бы оба этих фактора. Он предположил, что между молекулами действуют силы притяжения, которые по своей природе являются электрическими.
|
|
|
Каждую молекулу он рассматривал как твердый шар некоторого диаметра d. В этом случае ясно, что молекулы не могут подойти друг к другу ближе этого расстояния. В теории строения кристаллов показывается, что N таких шаров при условии тесного соприкосновения друг с другом занимают объем в четыре раза больший, чем  , т.е пустоты между шарами имеют объем в три раза больший, чем объем самих шаров. Поэтому величину объема газа V, входящего в уравнение Менделеева - Клапейрона, надо заменить на новую величину (V-b), где b рассматривается как некоторая поправка на истинный объем, доступный молекулам газа. Далее он учел, что молекулы могут взаимодействовать не только друг с другом, но и с окружающими их стенками сосуда. Если силы взаимодействия между молекуламивдали от стенки - в среднем компенсируют друг друга, то вблизи стенки (при условии, что молекула находится к стенке ближе, чем некий эффективный радиус межмолекулярного взаимодействия, т.е расстояние, где заметно проявляются силы взаимного притяжения) на выделенную молекулу действует некоторая равнодействующая сила fм , направленная от стенки и стремящаяся уменьшить кинетическую энергию молекулы при ее ударе об стенку. Величина работы этой силы зависит от количества молекул в сфере эффективного взаимодействия, т.е. от концентрации молекул в сосуде - n. Поэтому можно утверждать, что работа сил притяжения пропорциональна концентрации молекул: Апр = а1n, и кинетическая энергия молекул при их подлете к стенке уменьшается на величину Апр. Уменьшив среднюю кинетическую энергию молекул на Апр в основном уравнении кинетической теории газов, получим новое выражение для величины давления газа на стенку сосуда:
, т.е пустоты между шарами имеют объем в три раза больший, чем объем самих шаров. Поэтому величину объема газа V, входящего в уравнение Менделеева - Клапейрона, надо заменить на новую величину (V-b), где b рассматривается как некоторая поправка на истинный объем, доступный молекулам газа. Далее он учел, что молекулы могут взаимодействовать не только друг с другом, но и с окружающими их стенками сосуда. Если силы взаимодействия между молекуламивдали от стенки - в среднем компенсируют друг друга, то вблизи стенки (при условии, что молекула находится к стенке ближе, чем некий эффективный радиус межмолекулярного взаимодействия, т.е расстояние, где заметно проявляются силы взаимного притяжения) на выделенную молекулу действует некоторая равнодействующая сила fм , направленная от стенки и стремящаяся уменьшить кинетическую энергию молекулы при ее ударе об стенку. Величина работы этой силы зависит от количества молекул в сфере эффективного взаимодействия, т.е. от концентрации молекул в сосуде - n. Поэтому можно утверждать, что работа сил притяжения пропорциональна концентрации молекул: Апр = а1n, и кинетическая энергия молекул при их подлете к стенке уменьшается на величину Апр. Уменьшив среднюю кинетическую энергию молекул на Апр в основном уравнении кинетической теории газов, получим новое выражение для величины давления газа на стенку сосуда:
|
|
|
 . (3.1)
. (3.1)
Учитывая, что 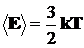 и обозначая
и обозначая 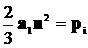 , получаем:
, получаем:
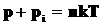 . (3.2)
. (3.2)
Умножив обе части (3.2) на молярный объем газа V0 и вспомнив, что nV0 = NA, где NA - число Авогадро, а kNA = R - универсальная газовая постоянная, нетрудно придти к такому выражению:
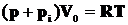 . (3.3)
. (3.3)
Величину pi можно выразить через V0, т.к. концентрация молекул n ~  . Тогда pi =
. Тогда pi = 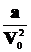 , где а - некий новый коэффициент пропорциональности, зависящий от природы молекул и количества газа. Подставляя выражение для рi в (3.3) и учитывая поправку на конечный объем молекул (объем V0 необходимо заменить новой величиной (V0 - b)), приходим к новому уравнению состояния, описывающего свойства реальных газов:
, где а - некий новый коэффициент пропорциональности, зависящий от природы молекул и количества газа. Подставляя выражение для рi в (3.3) и учитывая поправку на конечный объем молекул (объем V0 необходимо заменить новой величиной (V0 - b)), приходим к новому уравнению состояния, описывающего свойства реальных газов:
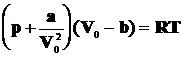 . (3.4)
. (3.4)
называемому уравнением Ван-дер-Ваальса.
Важно сравнить теоретические кривые с экспериментальными изотермами реальных газов, которые изображены на рис. 3.1 Как видно из рисунка, для сравнительно высоких температур (T1< T2< T3< T4< T5 < T6< Т7) изотермы Ван-дер-Ваальса (Т6 и Т7) очень похожи на изотермы идеального газа. Однако при температурах ниже, чем некоторая температура Ткр , называемая критической, на кривых появляются горизонтальные участки, соответствующие фазовому переходу жидкость - газ . После того, как вещество полностью перейдет в жидкое состояние, кривые начинают круто подниматься вверх, иллюстрируя хорошо известный факт несжимаемости жидкости. Имеется температура, при которой горизонтальный участок кривой вырождается в точку.
                   р T1 T2 T3 T4 T5 T6 Т7
Ткр
V
Рис. 3.1 Экспериментальные изотермы реального газа р T1 T2 T3 T4 T5 T6 Т7
Ткр
V
Рис. 3.1 Экспериментальные изотермы реального газа
|
При этой температуре пропадает различие в плотности жидкости и ее пара, и говорят, что вещество находится в критическом состоянии. Очевидно, что при температурах, выше критической, вещество не может быть переведено в жидкое состояние при любом сжатии.
Участок кривой cd соответствует состоянию переохлажденного пара, когда в нем нет центров конденсации. Вещество остается в газообразном состоянии, хотя его температура может быть ниже точки росы. Появление центров конденсации вызывает образование мельчайших капелек. Это явление известно как туман.
Основы термодинамики
Дата добавления: 2018-02-15; просмотров: 775; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!