Распределение энергии по степеням свободы
Поскольку при выводе формулы для давления газа собственные размеры молекул не учитывались, последние можно рассматривать как материальные точки. Положение любой такой точки в пространстве определяется тремя координатами, т.е. одноатомная молекула (ее можно рассматривать как материальную точку) в пространстве обладает тремя степенями свободы (I = 3).
Числом степеней свободы тела называется наименьшее число независимых координат, необходимых для определения положения тела в пространстве.
Все координаты «равноправны» так, что вся кинетическая энергия молекулы равновероятно распределяется между ними, т.е. на одну координату приходится энергия 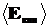 i= (1/2)kT.
i= (1/2)kT.
При равной вероятности всех направлений скорости по координатным осям
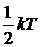
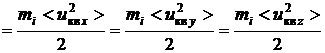 ,
,
т.е. средняя энергия теплового движения одноатомных молекул равномерно распределяется между тремя степенями свободы их поступательного движения, и на каждую степень свободы приходится энергия равная 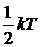 .
.
Для двухатомных молекул наряду с тремя поступательными степенями свододы возможны вращательные движения молекулы вокруг двух осей, проходящих через центр ее масс и перпендикуляных к оси самой молекулы (рис).
Кинетическая энергия вращательного движения молекулы относительно одной из осей равна

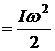 .
.
 Момент инерции I молекулы относительно собственной оси молекулы равен 0. Вращение молекулы относительно ее собственной оси не изменяет ее положения в пространстве. Таким образом, двухатомные молекулы обладают пятью (тремя поступательными и двумя вращательными) степенями свободы (I = 5), на каждую из которых, в соответствии с законом равномерного распределения энергии по степеням свободы, приходится энергия равная
Момент инерции I молекулы относительно собственной оси молекулы равен 0. Вращение молекулы относительно ее собственной оси не изменяет ее положения в пространстве. Таким образом, двухатомные молекулы обладают пятью (тремя поступательными и двумя вращательными) степенями свободы (I = 5), на каждую из которых, в соответствии с законом равномерного распределения энергии по степеням свободы, приходится энергия равная 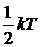 .
.
|
|
|
Для трех и более атомных молекул наряду с тремя поступательными степенями свободы возможны вращательные движения молекулы вокруг трех осей, проходящих через центр ее масс (рис), следовательно, трех и более атомные молекулы обладают шестью (тремя поступательными и тремя вращательными) степенями свободы (I = 6), на каждую из которых приходится энергия равная 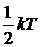 .
.
Распределение молекул по скоростям
Понятие среднеквадратичной скорости было введено как результат усреднения по всевозможным значениям скоростей, которыми обладают молекулы газа. При этом предполагалось, что все направления скоростей равновероятны, т.е. распределение молекул по направлению скоростей изотропно, и усреднение велось лишь по величине скоростей. Если выбирать интервал скоростей достаточно малым, то число молекул, скорость которых лежит в этом интервале, определяется тремя факторами: общим числом молекул газа Nобщ, величиной заданного интервала скоростей dv и третьим параметром, характеризующим распределение молекул по скоростям f(v), т.е. относительной долей молекул со значениями скоростей в интересующем нас интервале dv:
|
|
|
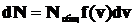 (1.8)
(1.8)
или
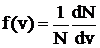 .
.
Явный вид функции  определен Максвеллом, который для идеального газа с массой молекул m при конечной температуре Т нашел, что
определен Максвеллом, который для идеального газа с массой молекул m при конечной температуре Т нашел, что
 , (1.9)
, (1.9)
где k – постоянная Больцмана.
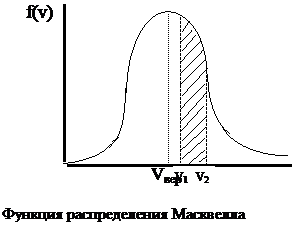
График этой функции представлен на рис., откуда видно, что функция имеет максимум при некотором значении скорости. Значение этой скорости легко найти по обычной процедуре исследования любой функции на экстремум: приравнивая к нулю первую производную f(v), получим:
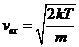 . (1.10)
. (1.10)
Скорость, определяемая данным выражением, получила название наиболее вероятной скорости.
Число молекул, скорости которых лежат в интервале от v1 до v2 (cм. рис.) определяется площадью заштрихованной кривой, которая, как известно из математики, равна интегралу f(v) в пределах от v1 до v2 , т.е.
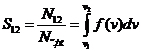 . (1.11)
. (1.11)
До сих пор предполагалось, что распределение молекул однородно по всему объему, занимаемого газом. Однако в поле внешних сил эта однородность нарушается. Можно найти, что давление с высотой z над поверхностьюизменяется по закону:
|
|
|
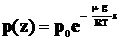 . (1.12)
. (1.12)
Полученное выражение носит название барометрической формулы.
Преобразуем показатель степени в (1.12) с учетом того, что
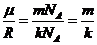 .
.
Тогда 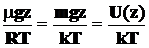 , где U(z) = mgz представляет потенциальную энергию молекулы в поле Земли. Тогда (1.12) приобретает такой вид:
, где U(z) = mgz представляет потенциальную энергию молекулы в поле Земли. Тогда (1.12) приобретает такой вид:
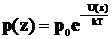 .
.
Величину давления р(z) можно выразить из основного уравнения кинетической теории газов через концентрацию молекул n:
р = 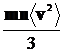 =
= 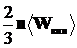 = nkT, (1.13)
= nkT, (1.13)
откуда видно, что давление пропорционально концентрации молекул. Поэтому концентрация молекул также экспотенциально зависит от энергии:
n(z) = n0 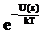 . (1.14)
. (1.14)
Л.Больцман обобщил эту формулу на случай произвольного распределения по энергиям некоторого числа частиц в произвольном силовом поле (не только гравитационном поле Земли). В частности, если в системе может быть несколько энергетических уровней, то «заселенность» этих уровней определяется распределением Больцмана:
n (E) = n0 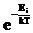 , (1.15)
, (1.15)
т.е. при любой конечной температуре частицы распределяются так, что их число на каждом из уровней тем меньше, чем больше величина энергии этого уровня.
|
|
|
Дата добавления: 2018-02-15; просмотров: 573; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
