В) фосфоресценция, дезактивация, сенсибилизация;
г) дегидратация, флуоресценция, фосфоресценция
140. Квантовый выход фотохимической реакции равен:
А) отношению числа прореагировавших молекул к числу поглощенных квантов света;
б) числу квантов света, поглощенных в единицу времени;
в) отношению числа поглощенных квантов света к числу прореагировавших молекул;
г) числу квантов света, поглощенных активными частицами в единице объема системы.
141. В соответствии с законом светопоглощения Бугера–Ламберта–Бера оптическая плотность (D) равна:
а) D = – ε · l · C; б) D = – ε · C ; в) D = ε · l · C ; г) D = l · C.
142. Оптическая плотность раствора с концентрацией 2,2·10–5 моль/л (молярный коэффициент поглощения 4200) равна 0,277. Измерения проводили в кюветах с толщиной светопоглощающего слоя:
а) 1 см; б) 3 см; в)2 см; г) 5 см
143. Оптическая плотность раствора с концентрацией 2,5·10–5 моль/л, если молярный коэффициент поглощения равен 7 000, а измерения проводили в кювете с толщиной светопоглощающего слоя 1 см равна:
а) 0,175; б) 0,345; в) 0,231; г) 0, 163
144. При введении катализатора в систему не изменяется:
а) константа химического равновесия обратимой реакции;
б) скорость реакции;
В) энергия активации реакции;
г) доля активных частиц в реакционной смеси.
145. Увеличение скорости реакции в случае положительного катализа объясняется:
а) увеличением энергии активации реакции;
б) уменьшением доли активных частиц;
В) уменьшением энергии активации реакции;
|
|
|
г) уменьшением средней кинетической энергии молекул реагирующих веществ
146. Изменение скорости реакции в случае ингибирования объясняется:
а) уменьшением энергии активации;
б) увеличением доли активных частиц;
в) увеличением энергии активации;
г) действием промоторов
147. Гомогенный катализ – это каталитические реакции:
а) идущие на поверхностях раздела фаз, образуемых катализатором и реагирующими веществами;
б) характеризующиеся ускорением процесса одним из продуктов реакции;
В) в которых реагенты и катализатор находятся в одной фазе;
г) протекающие под действием биологических катализаторов белковой природы
148. Вещества, увеличивающие площадь действия катализатора и предотвращающие его спекание называются:
а) промоторы и ингибиторы; в) носители и каталитические яды;
б) носители и промоторы; г) носители и ингибиторы
149. Вещества, снижающие каталитическую активность, называются:
а) носители; в) каталитические яды;
б) промоторы; г) загрязнители
150. Каталитические реакции, протекающие с участием биологических катализаторов белковой природы и характеризующиеся высокой активностью и высокой специфичностью, носят название:
|
|
|
а) ферментативного катализа; в) гомогенного катализа;
б) автокатализа; г) гетерогенного катализа
ЭЛЕКТРОХИМИЯ
151. Окислительно-восстановительная реакция - это реакция:
а) протекающая без изменения степени окисления атомов реагирующих веществ,
6) протекающая с изменением степени окисления атомов реагирующих веществ,
в) протекающая с изменением степени окисления молекул реагирующих веществ,
г) протекающая с переходом электронов от окислителя к восстановителю
152. Окислитель – это соединение:
а) отдающее электроны в реакции;
б) принимающее электроны в реакции;
в) определяющее рН среды;
г) выпадающее в осадок
153. Выберите положение, наиболее полно характеризующее отличие электрохимических реакций от химических реакций:
а) протекают исключительно как окислительно-восстановительные реакции на пространственно-разделенных электродах;
б) протекают на пространственно-разделенных электродах и сопровождаются взаимопревращением химической и электрической энергии;
в) протекают в двойном электрическом слое и сопровождаются превращением химической и электрохимической энергии;
|
|
|
Г) протекают как окислительно-восстановительные реакции в двойном электрическом слое на пространственно разделенных электродах и сопровождаются взаимопревращением химической и электрической энергии
154. Электродом называют:
а) металлическую пластинку, используемую при изготовлении аккумуляторов и при работе гальванического элемента.
6) систему, обладающую электрической проводимостью,
в) ионный проводник, предназначенный для определения количества электричества, проходящего через раствор,
г) проводник первого рода (металл, графит), приведенный в контакт с проводником второго рода (раствором или расплавом электролита)
155. Причиной возникновения электродного потенциала между металлом и раствором его соли является:
а) различная концентрация ионов в твердой и жидкой фазе и стремление выравнивать их в обеих фазах;
б) стремление выравнивать скорости движения ионов в твердой и жидкой фазах;
в) пространственное разделение зарядов противоположного знака на границе раздела фаз и образование двойного электрического слоя;
г) стремление ионов выравнивать энергию гидратации в обеих фазах
156. Абсолютным электродным потенциалом называется:
|
|
|
а) равновесный потенциал, возникающий в двойном электрическом слое;
б) скачок потенциала на границе металл–раствор;
в) скачок потенциала на границе раствор – раствор;
г) скачок потенциала на границе двух металлов
157. Выберите положение, наиболее полно характеризующее суть понятия «гальванический элемент»:
а) устройство, предназначенное для получения электрического тока;
б) устройство, в котором химическая энергия электродных полуреакций самопроизвольно превращается в электрическую энергию благодаря переносу электронов по внешней цепи;
в) прибор, предназначенный для превращения электрической энергии в химическую энергию;
г) химический источник электрического тока
158. Большое численное значение константы равновесия окислительно-восстановительной реакции указывает, что:
а) равновесие смещено вправо и реакция идет практически до конца;
6) равновесие смещено влево и реакция идет практически до конца;
в) реакция протекает очень быстро;
г) реакция протекает очень медленно
159. Направление протекания окислительно-восстановительной реакции можно определить:
а) по величине потенциала окислителя;
6) по величине потенциала восстановителя;
в) по величине ЭДС;
г) по концентрации восстановителя и окислителя
160. Отрицательное значение ЭДС реакции говорит о следующем:
а) реакция не может самопроизвольно протекать в прямом направлении;
6) реакция протекает самопроизвольно в прямом направлении;
в) реакция протекает очень медленно;
г) реакция протекает быстро
161. Вероятность протекания окислительно-восстановительной реакции в прямом направлении будет наибольшей при численном значении DGo:
а) – 200 кДж; 6) – 400 кДж; в) + 200 кДж; г) + 500 кДж
162. При известном значении ЭДС величину энергии Гиббса можно рассчитать по формуле:
а) 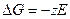 ; б)
; б)  ; в)
; в)  ; г)
; г) 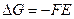
163. К электродам первого рода относят:
а) хлорсеребряный электрод; в) бромид-селективный электрод;
б) металлический электрод; г) каломельный электрод
164. Водородный электрод является стандартным при следующих условиях:
а) 
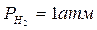 , Т любая;
, Т любая;
6) 
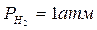 , Т=00С;
, Т=00С;
в) 
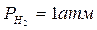 , Т =25К;
, Т =25К;
г) 
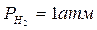 , Т =250С
, Т =250С
165. Уравнение Нернста, используемое для расчета величины электродного потенциала в случае электрода первого, выглядит следующим образом:
а) 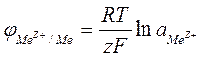 ;
;
б) 
в) 
г) 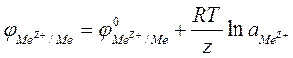
166. Потенциал электрода Сd│Cd2+ (а=0,1) в стандартных условиях равен ( 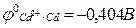 ):
):
а) +0,4335; б) –0,8650; в) –0,4335; г) +0,9265
167. Потенциал электрода Сu│Cu2+ (а=0,05) в стандартных условиях равен (  ):
):
а) +0,3992; б) +0,2996;в) –0,3992; г) –0,2996
168. Укажите схему водородного электрода
а) Рt,½Н2│Н+; б) ½Н2 │Н+; в) Н+│ ½Н2; г) Pt ôH2
169. Потенциал водородного электрода равен (рН=10):
а) – 0,59; б) +0,30; в) – 0,30; г) +0,59
170. Потенциал водородного электрода в стандартных условиях случае [H+] =10–3 равен:
а) 0,169 В; б) 0,177 В; в) 0,315; г) 0,590
171. К электродам второго рода относится электрод:
а) медный; в) хлорсеребряный;
б) хлорид-селективный; г) хингидронный
172. К электродам второго рода относится электрод, который схематически записывают следующим образом:
а) Сu│Cu2+; б) Hg,Cd│Cd2+; в) Ag │ Ag С I , KCI насыщ. ; г) Рt,½H2 │H+
173. Потенциал электрода Ag│AgBr(тв), Br– (a=0,005) (  ) равен:
) равен:
а) 0,0645; б) – 0, 0,3282; г) 0, 3445; г) – 0,2543
174. Уравнение Нернста для хлорсеребряного электрода имеет вид:
а)  ; в)
; в)  ;
;
б)  ; г)
; г) 
175. К окислительно-восстановительным относится электрод, который схематически записывают следующим образом:
а) Ag│AgСI, KCI насыщ.; б) Сd│Cd2+; в) Fe3+ │ Fe2+ ; г) Рt,½H2 │H+
176. Укажите формулу для расчета реального потенциала процесса Ох+ze-+mH+→Red:
а)  ; в)
; в)  ;
;
б)  ; г)
; г) 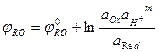
177. Укажите формулу для расчета реального окислительного потенциала процесса Cr2O72- + 14H++ 6e- = 2Cr3+ + 7H2O:
а) E=E0+0,059lg  ; в ) E= E0+
; в ) E= E0+  lg
lg  ;
;
6)E=E0+  lg
lg  ; г) E= E0+
; г) E= E0+  lg
lg 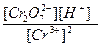
178. К ионоселективным электродам относится электрод:
а) водородный; б) амальгамный; в) хлорсеребряный; г) стеклянный
179. Бромид-селективный электрод относится к:
а) электродам второго рода; в) мембранным электродам;
б) газовым электродам; г) амальгамным электродам
180. Гальванический элемент, для которого величина ЭДС не зависит от стандартных электродных потенциалов, называется:
а) топливным; б) концентрационным; в) химическим; г) сложным
181. К какому типу электрохимических цепей относится элемент Hg, Hg2CI2 | KCI | CI2, Pt:
а) простая химическая цепь; б) сложная химическая цепь;
в) концентрационная цепь с переносом; г) концентрационная цепь без переноса
182. К концентрационным цепям без переноса относится элемент:
а) Hg, Hg2CI2 | KCI | CI2, Pt; в) Hg, Cd │ CdSO4 │ Cd, Hg
б)Zn | ZnSO4 || ZnSO4 | Zn; г) Cu | CuSO4 || ZnSO4 | Zn
183. ЭДС элемента Сu│Cu2+ (а = х) || Cu2+│Сu (а =1) равна 0,0885 при 298К. Определите значение х:
а) 0,0001; б) 0,0010; в) 0,0002; г) 0,0015
184. По отношению к потенциометрии верным является следующее утверждение:
а) метод основан на измерении электропроводности раствора;
б) метод основан на измерении ЭДС обратимых гальванических элементов;
в) метод основан на измерении времени электролиза испытуемого раствора;
г) метод основан на измерении зависимости силы тока от напряжения
185. В качестве электрода сравнения используется следующий электрод:
а) ионоселективный; в) амальгамный;
б) стеклянный; г) хлорсеребряный
186. В качестве индикаторного электрода используется следующий электрод:
а) стеклянный; б) хлорсеребряный;
б) стандартный водородный; г) каломельный
187. Кулонометрия основана на измерении:
а) ЭДС обратимых гальванических элементов;
б) электропроводности раствора;
в) количества электричества, израсходованного на электродную реакцию;
г) зависимости силы тока от напряжения
188. Полярографические (вольт-амперные) кривые показывают:
а) ход изменения времени электролиза от концентрации исследуемого иона;
б) ход изменения силы тока, проходящего через раствор, с изменением напряжения;
в) ход изменения ЭДС от концентрации раствора;
г) ход изменения электропроводности от концентрации раствора
189. Потенциалом полуволны (Е½ , В)позволяет проводить качественное определение ионов в методе:
а) потенциометрии; в) кондуктометрии;
б) кулонометрии; г) полярографии
190. При электролизе водного раствора хлорида олова (II) на оловянном аноде протекает процесс:
а) Sn→ Sn 2++2 ē; б) 2CI– → CI2 + 2ē; в) 2Н2О → О2 + 4Н+ + 4ē; г) О2 + 2Н2О + 4ē→ОН–
191. При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). На катоде выделился водород объемом:
а) 2,8 л; б) 11,2 л; в) 5,6 л; г) 22,4 л
192. При электролизе раствора CuCI2 масса катода увеличилась на 3,2 г. При этом на медном аноде:
а) выделилось 0,112 л СI2; в) перешло в раствор 0,1 моля С u 2+ ;
б) выделилось 0,59 л О2; г) перешло в раствор 0,05 моля Сu 2+
193. Ток силой3,85 А за 15 минут с учетом того, что все электричество затрачено на разложение катиона, выделит никель (М = 59 г/моль) массой:
а) 1,059 г; б) 0,106 г; в) 10,59 г; г) 1,012 г
194. Ток силой 6 А за 30 минут с учетом того, что все электричество затрачено на разложение катиона, выделит серебро (М = 108 г/моль) массой:
а) 24 г; б) 12 г; в) 6 г; г) 3 г
195. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Атомная масса металла равна:
а) 115; б) 58; в) 38; г) 75
196. Коррозия сплава железа будет протекать наиболее медленно:
а) в морской воде; в) в растворе НСI;
б) во влажном воздухе; г) в сухом воздухе
197. Чтобы избежать коррозии железные детали нужно скрепить заклепками:
а) свинцовыми; б) медными; в) оловянными; г) алюминиевыми
198. В случае коррозии железо будет являться анодом при контакте со всеми металлами в ряду:
а) Ni, Zn, AI; б) Со, Ni,С u; в)Zn, Сr, Рb; г) Ni, AI, Со
199. При прокладке водопровода наиболее эффективно использовать следующие методы защиты:
а) электрохимический; в) ингибиторный;
б) лакокрасочное покрытие; г) протекторный
200. При контакте сплава с агрессивной средой, содержащей кислоту, наиболее эффективным способом защиты от коррозии является:
а) электрохимический; в) использование ингибиторов;
б) лакокрасочное покрытие; г) протекторный
Дата добавления: 2021-04-05; просмотров: 166; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
