Фазовые переходы и капиллярные явления.
1. Уравнение Ван-дер-Ваальса: ( p + a / V 2 ) ( V - b ) = RT
 Параметр a – характеризует силы притяжения между молекулами, b - силы отталкивания и размеры молекул.
Параметр a – характеризует силы притяжения между молекулами, b - силы отталкивания и размеры молекул.
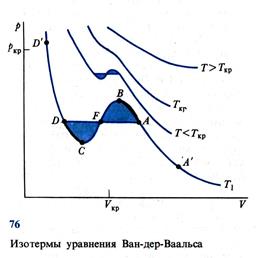
На изотерме при Т1 на рис. 3.2:
DD ′ – жидкое состояние вещества;
AA ′ - газообразное состояние вещества;
|
2. При критической температуре Ткр. исчезает различие между жидкостью и газом, а область фазового перехода вырождается в точку перегиба. При T > Ткр. – только газообразное состояние вещества.
3. Критические параметра вещества: V кр. =3 b ; p кр. = a / 27 b 2 ; Ткр. =8 a / 27 Rb .
4. Приведенное уравнение Ван-дер-Ваальса: ( p + 3 / w 2 ) (3 w - 1) = 8 q
где p = p / p кр ; w = V / V кр ; q = T / T кр .
5. Равновесие фаз достигается при равенстве потенциалов Гиббса G = U + PV - TS этих фаз (dG = Vdp – SdT ).
6. Фазовые переходы I рода сопровождаются скачком первых производных от G : 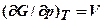 ;
;  . Поэтому такие переходы сопровождаются скачком удельного объема (плотности) и выделением (или поглощением) тепла.
. Поэтому такие переходы сопровождаются скачком удельного объема (плотности) и выделением (или поглощением) тепла.
7. Фазовые переходы II рода сопровождаются скачком вторых производных от G : 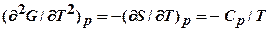 ;
;  ;
;
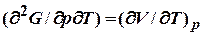 . Поэтому они сопровождаются скачком теплоемкости, а также коэффициентов изотермической сжимаемости
. Поэтому они сопровождаются скачком теплоемкости, а также коэффициентов изотермической сжимаемости  и объемного расширения
и объемного расширения  , при этом плотность изменяется монотонно и непрерывно, выделения или поглощения тепла не происходит. Примеры фазовых переходов II рода: парамагнетик – ферромагнетик и диэлектрик - сегнетоэлектрик, сопровождаемые появлением макроскопического магнитного момента и спонтанной поляризации у вещества; переход металлов и сплавов из нормального в сверхпроводящее состояние; переход жидкого гелия в сверхтекучее состояние и т.д.
, при этом плотность изменяется монотонно и непрерывно, выделения или поглощения тепла не происходит. Примеры фазовых переходов II рода: парамагнетик – ферромагнетик и диэлектрик - сегнетоэлектрик, сопровождаемые появлением макроскопического магнитного момента и спонтанной поляризации у вещества; переход металлов и сплавов из нормального в сверхпроводящее состояние; переход жидкого гелия в сверхтекучее состояние и т.д.
|
|
|
7.Фазовые переходы I рода между тремя фазами вещества: газообразным (1), жидким (2) и твердым (3) (испарение и конденсация, плавление и кристаллизация, сублимация и возгонка) описываются уравнением Клапейрона- Клаузиуса:  >0;
>0;  >0;
>0; 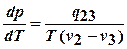 ,
,
где q - удельная теплота фазового перехода,  - удельный объем вещества.
- удельный объем вещества.
Для фазовых переходов газ«жидкость (1«2) и газ«твердое тело (1«3) производные dp / dT положительныдля всех веществ. Для большинства веществ dp / dT >0 и при фазовых переходов жидкость«твердое тело - такие вещества называются нормальными. Однако имеются и аномальные вещества (например, вода и лед), для которых dp / dT <0, т.к для них 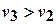 .
.

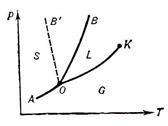 8. Фазовые диаграммы – геометрическое изображение фазового состояния системы в зависимости от температуры T и давления p – рис. 3.3. Каждая точка на кривых рис. 3.3 соответствует условию равновесия между двумя фазами. Поэтому вдоль кривых вещество находится в двухфазном состоянии, вне кривых – в однофазном (S – твердом, L – жидком, G – газообразном).
8. Фазовые диаграммы – геометрическое изображение фазового состояния системы в зависимости от температуры T и давления p – рис. 3.3. Каждая точка на кривых рис. 3.3 соответствует условию равновесия между двумя фазами. Поэтому вдоль кривых вещество находится в двухфазном состоянии, вне кривых – в однофазном (S – твердом, L – жидком, G – газообразном).
|
|
|
ОК – кривая испарения или конденсации, заканчивается при T кр ..
ОВ – кривая плавления или кристаллизации для нормальных веществ, ОВ′- для аномальных. Для нормальных веществ при увеличении давления температура плавления повышается, а для аномальных, наоборот, понижается.
АО – кривая возгонки или сублимации. О– тройная точка – равновесие трех фаз.
Капиллярные явления.
1. Добавочное (капиллярное) давление в жидкости под искривленной поверхностью (формула Лапласа):  , где s - коэффициент поверхностного натяжения жидкости, q - краевой угол смачивания,
, где s - коэффициент поверхностного натяжения жидкости, q - краевой угол смачивания,  - главные радиусы кривизны.
- главные радиусы кривизны.
Частные случаи:  - давление Лапласа в жидкости внутри капилляра радиусом R ;
- давление Лапласа в жидкости внутри капилляра радиусом R ;  - внутри пузырька или капли жидкости радиусом R ;
- внутри пузырька или капли жидкости радиусом R ;  - внутри мыльного пузырька радиусом R ;
- внутри мыльного пузырька радиусом R ;  - давление Лапласа в жидкости между плоскопараллельными пластинами, находящимися на расстоянии d.
- давление Лапласа в жидкости между плоскопараллельными пластинами, находящимися на расстоянии d.
2. Высота поднятия жидкости в капилляре радиусом R: 
Знак h определяется знаком  .
.
|
|
|
Дата добавления: 2021-06-02; просмотров: 57; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
