МОЛЕКУЛЯРНАЯ (СТАТИСТИЧЕСКАЯ ) ФИЗИКА и ТЕРМОДИНАМИКА
Идеальные газы
1. Давление р идеального газа на стенку сосуда: р = n kT =  ,
,
Т- температура, n – концентрация,  - скорость, m –масса молекул газа.
- скорость, m –масса молекул газа.
2. Уравнение состояния идеального газа p = nkT
Уравнение Клайперона – Менделеева: 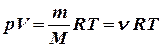 ,
,
m –масса газа, М - молярная масса, n - число молей; V- объем газа.
Молярной массой М вещества называется масса его 1 моля, а 1 моль вещества численно равен относительной молекулярной массе  его молекул, выраженной в граммах:
его молекул, выраженной в граммах:  =
=  .
.
Молярные массы некоторых газов.
| газ | относительная молекулярная масса  (безразмерная величина) (безразмерная величина)
| Молярная масса М |
| Водород - H2 | 2 | 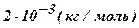
|
| Гелий - He | 4 | 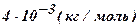
|
| Аргон - Ar | 40 | 
|
| Кислород - O2 | 32 | 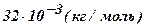
|
| Азот - N2 | 28 | 
|
| Углекислый газ - CO2 | 44 | 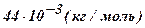
|
| Вода - H2O | 18 | 
|
Смеси идеальных газов.
1. В смеси идеальных газов для каждого i-ого газа можно записать уравнение Клайперона – Менделеева  .
.
Величина 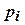 в данном уравнении называется парциальным давлением.
в данном уравнении называется парциальным давлением.
2. Давление смеси газов на стенки сосуда равно сумме парциальных давлений компонент смеси : P =  - закон Дальтона.
- закон Дальтона.
3.Уравнение Клапейрона-Менделеева для смеси газов:

где  - эффективная молярная масса смеси газов.
- эффективная молярная масса смеси газов.
 =
= 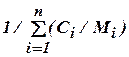 =
= 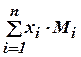
где 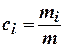 - массовая концентрация; а
- массовая концентрация; а  - молярная концентрация i-ого газа в смеси,
- молярная концентрация i-ого газа в смеси,  - суммарное число молей в смеси газов.
- суммарное число молей в смеси газов.
Функции распределения Максвелла:
1. j (  ) =
) =  ; dN / N = dP = j (
; dN / N = dP = j (  ) d
) d  -
-
относительное число молекул, скорость  которых лежит в интервале [
которых лежит в интервале [  ;
;  + d
+ d  ] и вероятность dP этого явления.
] и вероятность dP этого явления.
|
|
|
2. f (  )=
)= 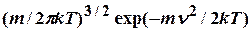 ; dN / N = dP = f (
; dN / N = dP = f (  ) d
) d  - относительное число молекул и вероятность того, что компоненты
- относительное число молекул и вероятность того, что компоненты  ,
, 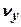 и
и 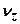 их скоростей меняются в интервалах: [
их скоростей меняются в интервалах: [  ;
;  + d
+ d  ]; [
]; [ 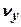 ;
; 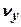 + d
+ d 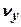 ];[
];[ 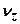 ;
; 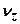 + d
+ d 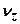 ].
].
3. F (  )=
)=  ; dN / N = dP = F (
; dN / N = dP = F (  ) d
) d  -
-
относительное число молекул, модули скоростей которых лежат в интервале [  ;
;  + d
+ d  ] и вероятность этого явления.
] и вероятность этого явления.

| |
| ||||
| |||||

|
4. Максимум функции распределения F (  ) наблюдается при наиболее вероятной скорости молекул:
) наблюдается при наиболее вероятной скорости молекул: 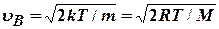 . При повышении температуры Т максимум F (
. При повышении температуры Т максимум F (  )смещается в область более высоких скоростей и уменьшается, поскольку площадь под кривой должна оставаться постоянной
)смещается в область более высоких скоростей и уменьшается, поскольку площадь под кривой должна оставаться постоянной
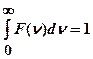 - условие нормировки функции распределения.
- условие нормировки функции распределения.
5. Среднеквадратичная скорость молекул : 
6. Среднеарифметическая скорость молекулы: 

Функция распределения Больцмана:
n = no exp (- U / kT ) , где U – потенциальная энергия частицы;
Вгравитационном поле эта функция имеет вид: n = no exp (- mgh / kT ) – для частиц массой m , либо n = no exp (- Mgh / RT ) –для молекул газа с молярной массой М.
Термодинамические свойства и процессы в идеальных газах.
|
|
|
«0» начало термодинамики постулирует равенство температуры во всех частях системы, находящейся в состоянии термодинамического равновесия.
I начало термодинамики является обобщением закона сохранения энергии на молекулярные системы: 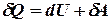
где  – бесконечно малое количество теплоты,
– бесконечно малое количество теплоты, 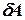 – элементарная работа,
– элементарная работа,  – бесконечно малое изменение внутренней энергии системы.
– бесконечно малое изменение внутренней энергии системы.
II начало термодинамики накладывает ограничение на процессы. По современной формулировке в изолированной системе возможны лишь процессы, которые сопровождаются не убыванием энтропии: DS£0. Для обратимых процессов изменение энтропии DS= 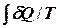 и для таких процессов II начало термодинамики записывается в виде : TdS =
и для таких процессов II начало термодинамики записывается в виде : TdS = 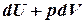 .
.
III начало термодинамики (теорема Нернста) сводится к двум утверждениям: 1) при приближении к абсолютному нулю энтропия стремится к определенному конечному пределу (этот предел полагается равным 0);
2) все процессы при абсолютном нуле температур идут без изменения энтропии.
Молярная теплоемкостьС – количество теплоты, необходимое для нагревания 1 киломоля вещества на 1К: С = d Q / dT .
Молярная теплоемкость при постоянном объеме Cv = iR /2;
при постоянномдавлении: Cp = ( i +2) R /2; 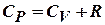 (соотношение Майера), где i – число степеней свободы молекул – число независимых компонент энергии молекулы в выражении для внутренней энергии газа. Для одноатомной молекулы i =3, двухатомной i =5, состоящей из 3-х и более молекулi =6.
(соотношение Майера), где i – число степеней свободы молекул – число независимых компонент энергии молекулы в выражении для внутренней энергии газа. Для одноатомной молекулы i =3, двухатомной i =5, состоящей из 3-х и более молекулi =6.
|
|
|
Процессы в газах
| процесс | Уравнение процесса | Теплоемкость С | ||||
| Изотермический |
| С = ¥ | ||||
| Изобарный |
|
| ||||
| Изохорный |
|
| ||||
| Адиабатический процесс без теплообмена |
g = Ср/С V = ( i+2)/ i - показатель адиабаты | С = 0 | ||||
| Политропический С = const процесс с постоянной теплоемкостью |
n=( C-Ср)/( C-С V) - показатель политропы | С = где n - показатель политропы | ||||
| процесс | Работа
| Теплота d Q = n С dT D Q = n С D T | Внутренняя энергия dU = n С V dT | Энтропия dS = d Q/T | ||
| Изотермический |
| D Q = A | D U =0 | 
| ||
| Изобарный | A = n (Cp - С V ) D T = = n R D T | D Q = n С p D T | D U = n С V D T | 
| ||
| Изохорный | A=0 | D Q = n С V D T | D U = n С V D T | 
| ||
| Адиабатический | A = - D U | D Q = 0 | D U = n С V D T | D S =0 | ||
| Политропический | A = n (C- С V ) D T | D Q = n С D T | D U = n С V D T | 
| ||
Коэффициент полезного действия тепловой машины h = А/ Q 1 =( Q 1 + Q 2 )/ Q 1 ),
Q 1 – полученное, Q 2 <0 – отданное машиной тепло в ходе цикла.
|
|
|
Коэффициент полезного действия цикла Карно h = ( T 1 - T 2 )/ T 1
Т1 – температура нагревателя, Т2 – температура холодильника.
Явления переноса в идеальных газах
1. Среднее число столкновений молекул за время  =1сек Z=
=1сек Z= 

и средняя длина свободного пробега молекул  =
= 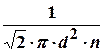 ,
,
где d – диаметр молекул, n – их число в единице объема, 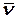 =
=  - среднеарифметическая скорость молекулы:
- среднеарифметическая скорость молекулы:
2. Явление диффузии – перенос количества молекул:
In = - D 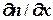 ; где D =
; где D = 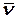
 /3 – коэффициент диффузии, In - поток молекул
/3 – коэффициент диффузии, In - поток молекул
3. Явление теплопроводности – перенос энергии:  =-
=- 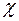
 ; где
; где 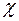 =
= 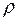
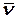

 /3- коэффициент теплопроводности, r - плотность газа.
/3- коэффициент теплопроводности, r - плотность газа.
4. Явление вязкого трения – перенос импульса:
 = -
= - 
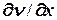 ; где
; где  =
= 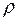
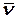
 /3 - коэффициент динамической вязкости.
/3 - коэффициент динамической вязкости.
Дата добавления: 2021-06-02; просмотров: 54; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 ,
,



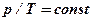

 =0
=0  ;
; 

 ;
; 

 ,
,
