Адиабатное расширение газа с совершением внешней силы.
Содержание
· Введение……………………………………………………………………..3
· Низкие температуры………………………………………………………..4
· §1. Сжижение газов…………………………………………………………5
· §2. Эффект Джоуля – Томсона…………………………………………….6
· §3. Адиабатное расширение газа с совершением внешней работы……11
· §4. Сжижение газов с использованием эффекта Джоуля – Томсона (метод Линде)………………………………………………………………………..14
· §5. Сжижение газов методом адиабатного расширения в детандерах (метод Клода)………………………………………………………………………..17
· §6. Некоторые свойства сжиженных газов……………………………….19
· §7. Сверхнизкие температуры…………………………………………….20
· §8. Свойства вещества при низких температурах……………………….22
· §9. Жидкий гелий…………………………………………………………...24
· Заключение………………………………………………………………….33
· Список литературы…………………………………………………………34
Введение.
Проблемой изучения свойств веществ при низких температурах занимались многие ученые. Для этого требовались сжиженные газы. Определенных успехов в сжижении газов добился М. Фарадей. Он получил в жидком состоянии все известные газы кроме азота, кислорода, водорода, метана, оксида азота и оксида углерода. До обнаружения критической температуры пытались сжижать и эти газы, главным образом увеличивая давление. Однако после установления критической температуры для каждого вещества стало ясно, что получение жидкого азота, кислорода и т. д. требует охлаждения любого газа ниже его критической температуры, то есть более глубокого охлаждения, чем применявшегося ранее.
|
|
|
Большой вклад в проблему сжижения газов внес Петр Леонидович Капица. В 1934 году он создал необычайно производительную установку для сжижения гелия, который кипит или сжижается при температуре около 4,3 К. В 1938 г. он усовершенствовал небольшую турбину, очень эффективно сжижавшую воздух. Капице удалось обнаружить необычайное уменьшение вязкости гелия при охлаждении температуры ниже 2,17 К, при которой он переходит в форму, называемую гелием-2. Утрата вязкости позволяет ему беспрепятственно вытекать через мельчайшие отверстия и даже взбираться по стенкам контейнера, как бы не чувствуя силы тяжести. Отсутствие вязкости сопровождается также увеличением теплопроводности. Капица назвал открытое им явление сверхтекучестью.
Построенные Капицей уже после войны установки для сжижения газов нашли широкое применение в промышленности. Использование кислорода, извлеченного из жидкого воздуха, для кислородного дутья произвело подлинный переворот в советской сталелитейной промышленности.
|
|
|
Низкие (криогенные) температуры находят все большее применение в биологии и медицине. Так, температуры жидкого азота используют для длительного хранения крови, плазмы, спинного мозга, тканей и отдельных органов человека. С успехом используется криохирургический инструмент, дающий возможность местно замораживать удаляемые участки больных органов. Возникла новая отрасль науки - криобиология, изучающая процессы в клетках и тканях при их глубоком охлаждении.
Низкие температуры.
Непрерывные хаотические тепловые движения, в которых всегда участвуют частицы любого вещества и интенсивность (энергия) которых определяет его температуру, оказывают существенное внимание на все происходящие в веществе явления. Они являются как бы фоном, на котором разыгрываются любые процессы внутри вещества. Именно поэтому почти всякое свойство вещества так или иначе зависит от температуры, т.е. от интенсивности тепловых движений частиц в нем.
Естественно, что изучение свойств вещества при очень низких температурах, когда молекулярные движения в большей или меньшей степени ослаблены, представляют большой интерес. Только при низких температурах можно исследовать те или иные явления в условиях, когда постоянный фон тепловых движений не влияет на них.
|
|
|
При низкотемпературных исследованиях изучаемое тело приводят в контакт с телом достаточно низкой температуры, с так называемым хладогентов. Задачей техники низких температур и является создание таких хладогентов. Ими обычно являются различные сжиженные газы, находящиеся в состоянии кипения. Они особенно удобны тем, что контакт с охлажденным телом не изменяет их температуру, а приводит лишь к более интенсивному испарению. Именно сжижение газов открыло для исследования область низких температур, в том числе и самых низких – близких к абсолютному нулю.
Сжижение газов.
Уравнение состояния идеальных газов Ван-дер-Ваальса показывает, что всякий газ может быть переведен в жидкое состояние, но необходимым условием для этого является предварительное охлаждение газа до температуры ниже критической. Углекислый газ, например, можно сжижить при комнатной температуре, поскольку его критическая температура равна 31,1°C. То же можно сказать и о таких газах, как аммиак и хлор.
Но есть и такие газы, которые при комнатной температуре нельзя перевести в жидкое состояние, какие бы не применять давления и до каких бы плотностей их ни доводить. К таким газам относятся, например, воздух (а так же его составные части – азот, кислород и аргон), водород и гелий, у которых критические температуры значительно ниже комнатной. До открытия критической температуры (Каньяр-де-ла-Тур, 1822 г.) их даже считали постоянными газами, т.е. газами, вообще не способными сжижаться.
|
|
|
Для сжижения таких газов их необходимо предварительно охладить, по крайней мере до температуры несколько ниже критической, после чего повышением давления газ может быть переведен в жидкое состояние. Сжиженные таким образом газы удобнее хранить под атмосферным давлением (в открытом сосуде), но в этом случае их температура должна быть еще более низкой – такой, при которой давление, соответствующее горизонтальному участку изотермы реального газа, равна 1 атм. Для азота такая изотерма соответствует температуре 77,4 К, в то время как критическая температура азота равна 126,1 К. для кислорода эти цифры соответственно равны 90 К и 154,4 К, для водорода 20,5 К и 33 К и, наконец, для гелия 4,4 К и 5,3 К. мы упомянули эти четыре газа потому, что именно они широко используются практически: и как средства получения низких температур (хладоагенты), и для других целей.
Из приведенных цифр как критических температур, так и тех конечных температур, до которых должны быть охлаждены сжижаемые газы, визно ,что охлаждение требуется весьма значительное, какое нигде в природе (в земных условиях) не встречается. Для достижения столь сильного охлаждения обычно используются два метода (по отдельности и комбинированно), которые мы здесь и рассмотрим.
Первый из них связан с использованием, так называемого эффекта Джоуля – Томсона.
Эффект Джоуля – Томсона.
Расширение идеального газа в пустоту не сопровождается изменением его температуры.
Небольшое изменение температуры, наблюдаемое при точных измерениях, объясняется неидеальностью газа. Следующее видоизменение опыта по расширению газа, предложенное Джоулем и Томсоном, позволяет достичь заметного изменения температуры газа, в частности охлаждения, обусловленного его неидеальностью.
Газ при достаточно большом, но постоянном давлении вынуждают протекать через теплоизолированную пористую перегородку. Это значит, что протекание газа происходит адиабатно.
Гидродинамическое сопротивление перегородки приводит к тому, что на ней теряется часть давления газа и газ выходит из перегородки при более низком давлении. Газ, следовательно, расширяется или, как говорят в технике, дросселируется. Дросселем называется любое устройство, представляющее сопротивление для протекания газа. В технических установках для охлаждения газов вместо пористой перегородки часто используется достаточно узкие сопла.
Для того, чтобы давление газа было стационарным, т.е. происходило при постоянных значениях давлений по обе стороны дросселя, необходим какой – либо насос (компрессор), который поддерживал бы постоянными эти давления. Этот компрессор производит внешнюю работу сжатия газа, которая расходуется на преодоление сопротивления дросселя. Этим процесс дросселирования отличается от расширения газа в пустоту, при котором внешняя работа равна нулю.
Мы покажем, что для неидеального газа процесс Джоуля – Томсона, т.е. процесс дросселирования, вообще говоря, должен сопровождаться изменением его температуры. Такое же расширение идеального газа не вызывает никакого изменения температуры.
Явление изменения температуры газа при его адиабатном расширении дросселированием от одного постоянного давления к другому называется эффектом Джоуля – Томсона.
Изменение температуры неидеального газа в процессе Джоуля – Томсона объясняется тем, что при расширении газа увеличивается расстояние между молекулами и, следовательно, совершается внутренняя работа против взаимодействия между молекулами. За счет этой работы изменяется кинетическая энергия молекул, а следовательно, и температура газа. В идеальном газе, где силы взаимодействия молекул равны нулю, эффекта Джоуля – Томсона нет.
Количественно эффект Джоуля – Томсона характеризуется дифференциальным коэффициентом Джоуля – Томсона µ, который определяется отношением изменения температуры газа ΔТ к вызвавшему его изменение давления Δр:
µ=ΔТ/Δр.
Вычислим коэффициент Джоуля – Томсона, пользуясь выделенными термодинамическими соотношениями. Это вычисление явится полезной иллюстрацией применения термодинамики для решения конкретных задач. Но прежде чем приступить к этим вычислениям, проанализируем детальнее процесс Джоуля – Томсона. Для этой цели несколько схематизируем этот процесс.
Представим себе, что определенная масса, например 1 моль газа, протекает слева направо через пористую перегородку L (рис. 1), помещенную в теплоизолированный цилиндр.
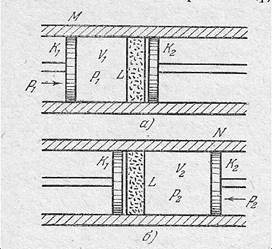 рис. 1
рис. 1
Пусть один моль газа занимает объем V1 между перегородкой L и точкой М слева (рис. 1, а), а после прохождения перегородки, т.е. после расширения, - объем V2 между перегородкой и точкой N справа (рис. 1, б). Для наглядности поместим мысленно в точке М поршень К1, перемещение которого вправо называет протекание газ через перегородку пол постоянным давлением р1. После прохождения через перегородку этот же газ перемещает воображаемый поршень К2, испытывающий противодавление (тоже постоянное) р2, до положения N. В действительности роль поршней К1 и К2 выполняет упомянутый выше компрессор.
Вычислим внешнюю работу, совершенную газом. При перемещении поршня К1 от положения М до перегородки L объем газа изменяется от значения V1 до нуля. При постоянном давлении совершенная работа равна произведению этого давления на изменение объема, следовательно, работа перемещения моля газа слева от перегородки равна –р1V1. По тем же причинам работа, совершенная газом справа от перегородки, равна р2 V2. Общая работа ΔА расширений газа
ΔA=p2V2 – p1V1.
Согласно первому началу термодинамики, работа, совершенная газом, должна быть равна изменению его внутренней энергии с обратным знаком, поскольку процесс расширения проведен адиабатно, так что ΔQ=0. Поэтому, если U1 и U2 – внутренняя энергия моля газа до и после его расширения, то
p2V2 – p1V1 = U1 – U2 , или U1 + p1V1 =U2 + p2V2.
Функция U + pV = I называется тепловой функцией или энтальпией газа. Это функция состояния, которая при изобарическом процессе играет ту же роль, какую при адиабатном процессе играет внутренняя энергия U, а при изотермическом – свободная энергия F. Значит, процесс Джоуля – Томсона происходит так, что тепловая функция газа остается постоянной по обе стороны перегородки (дросселя):
d(U + pV) = 0. (1)
Для идеального газа как внутренняя энергия, так и произведение pV зависят только от температуры (они пропорциональны Т); потому и тепловая функция U + pV зависит только от температуры. Равенство тепловых функций идеального газа по обе стороны перегородки одновременно означает и равенство температур. Значит, для идеального газа коэффициент Джоуля – Томсона равен нулю.
Для неидеального газа, как мы знаем, внутренняя энергия зависит не только от температуры, но и от объема V, занимаемого газом. Поэтому равенство тепловых функций в случае реальных газов еще не свидетельствует о равенстве температур.
Действительно, опыт показывает, что большинство газов (азот, кислород, углекислота и др.) в процессе дросселирования при комнатной температуре охлаждаются. Но такие газы ,как водород и гелий, при тех же условиях нагреваются. Это означает, что в первом случае коэффициент Джоуля – Томсона µ=ΔТ/Δр положительный (при Δр<0 и ΔT<0), во втором он отрицательный.
Заметим еще, наконец, что процесс Джоуля – Томсона является существенно необратимым, следовательно, он сопровождается увеличением энтропии, dS>0.
После приведенных замечаний нетрудно вычислить коэффициент Джоуля – Томсона.
Уравнение (1) может быть переписано в виде:
d(U + pV) = dU + p dV + V dp =0,
но dU + p dV = T dS ; следовательно,
T dS + V dp = 0. (2)
Теперь необходимо выразить изменение энтропии dS через изменение температуры dT и изменение давления dp.
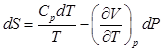 .
.
Поставив это значение dS в (2), получаем:
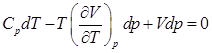 , (3)
, (3)
Откуда и получается интересующий нас коэффициент Джоуля – Томсона:
 , (4)
, (4)
где 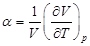 - коэффициент расширения газа.
- коэффициент расширения газа.
Все величины, входящие в (4), могут быть определены, если известно уравнение состояния газа, и во всяком случае могут быть измерены. Следовательно, коэффициент µ может быть определен.
Из уравнения (4) видно ,что знак коэффициента µ зависит от величины αТ. При αТ > 1 коэффициент µ > 0; при αТ < 1 имеем µ< 0.
Для идеальных газов 
 и µ = 0,
и µ = 0,
в чем мы убедились выше.
Для реальных газов µ может быть как положительным, так и отрицательным. Больше того, для одного и того же газа в одной области температур µ может быть положительным, а в другой – отрицательным.
Другими словами, существует температура Ti , характерная для данного газа, при которой коэффициент Джоуля – Томсона меняет свой знак. Эта температура Ti называется температурой инверсии.
Если состояние газа описывается уравнением Ван – дер –Ваальса, то, пользуясь (4), нетрудно найти и численное значение коэффициента Джоуля – Томсона. Для этого нужно вычислить производную  , входящую в (4).
, входящую в (4).
Раскрыв скобки в левой части уравнения Ван – дер –Ваальса
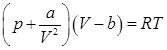
получаем:
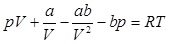 .
.
Дифференцирование обеих частей по Т при p=const дает:
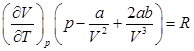 .
.
Поставив вместо р значение из уравнения Ван – дер –Ваальса 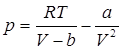 , получаем:
, получаем:
 ,
,
откуда
 . (5)
. (5)
Если давление газа не очень велико (порядка 100 – 200 атм), то
 « 1 и
« 1 и  « 1,
« 1,
и в (5) ими можно пренебречь; тогда
 . (6)
. (6)
Из этой формулы сразу видно, что коэффициент Джоуля – Томсона положителен, пока  > b, или T<
> b, или T<  . При Т>
. При Т> 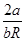 коэффициент µ< 0, т.е. газ при дросселировании нагревается.
коэффициент µ< 0, т.е. газ при дросселировании нагревается.
Очевидно, что температура инверсии определяется равенством:
 (7)
(7)
Сопоставив (7) с выражением для критической температуры

получаем следующее простое соотношение между температурой инверсии и критической температурой:
 .
.
Это соотношение, полученное в очень грубом приближении, довольно удовлетворительно подтверждается опытом. Во всяком случае, чем ниже критическая температура Тк, тем ниже и Т i . для кислорода, например, температура инверсии равна 893 К (Тк = 154,36 К). у водорода же и гелия температура инверсии равны соответственно 204,6 и 40 К (критические температуры 33 К и 5,2 К).
Тот факт, что в опыте Джоуля и Томсона, который ставился при комнатной температуре, водород при расширении нагревался, в то время как другие газы охлаждались, не является, конечно, особым свойством водорода. Любой газ обнаружит такое же свойство, если ставить опыт при более высокой, чем температура инверсии. Как мы увидим ниже, эффект Джоуля – Томсона используется именно для охлаждения водорода и гелия при их сжижении.
Рассмотрим теперь второй способ охлаждения газов, также применяемый для их сжижения.
Адиабатное расширение газа с совершением внешней силы.
При дросселировании газа (эффект Джоуля – Томсона) охлаждение достигается за счет внутренней работы, совершаемой газом против сил притяжения между молекулами. Как известно охлаждение газа происходит и в том случае, когда он адиабатно расширяется, совершая внешнюю работу (например, поднимая поршень). Это непосредственно следует из первого начала термодинамики
 ,
,
из которого видно, что при адиабатном 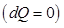 расширении
расширении
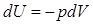 .
.
Это значит ,что газ, расширяясь и совершая при этом работу, уменьшает свою внутреннюю энергию, а значит, и температуру. Это в данной мере относится и к идеальному, и к реальному газам. Причиной охлаждения газа при совершении им внешней работы является уменьшение скоростей молекул при их ударах об удаляющийся от них поршень, которому они передают часть своей кинетической энергии.
Вообще говоря, охлаждение при адиабатном расширении с совершением внешней работы должно быть более эффективным ,чем при дросселировании, так как адиабатное расширение – процесс обратимый (или, по крайней мере, могущий быть обратимым), в то время как эффект
Джоуля – Томсона – процесс необратимый. Нам уже известно, что обратимость процессов в машине обеспечивает большой коэффициент полезного действия. Правда, этот вывод относился к машине, преобразующей тепло в механическую работу, а не в холодной воде. Но все, что говорилось о к.п.д. тепловой машины, полностью относится и к холодным аппаратам, которые можно считать устройствами, обратными тепловым двигателям.
В холодной машине тепло отбирается от холодного тела и передается более нагретому. При этом затрачивается механическая работа, за счет которой и происходит передача тепла от холодного тела к теплому. Сам собой такой процесс не может идти. «теплым» телом для холодильника служит окружающая среда, которая для теплового двигателя служит холодильником. Ей передается тепло от того тела, которое требуется охладить.
Холодильная машина является ,таким образом, обращенным двигателем. Коэффициентом полезного действия холодильной машины мы должны считать отношение количества теплоты Q , отнятого от охлаждаемого тела, к затраченной при этом работе А:
 .
.
В применении к холодильным аппаратам он называется холодильным коэффициентом. Легко показать, что для холодильной машины, работающей по циклу Карно, холодильный коэффициент равен
 ,
,
где Т1 – температура охлаждаемого тела и Т2 – температура тела, которому тепло передается. Холодильный коэффициент, разумеется, может быть и больше единицы. Лучшей машиной считается та, которая для отнятия данного количества тепла от охлаждаемого тела тратит наименьшую работу.
Подобно тому, как в тепловом двигателе его цель – совершение работы – достигается при расширении газа, в холодильном аппарате его цель – охлаждение – тоже достигается при расширении (адиабатном) газа. Поэтому самой существенной частью такой машины является та часть ,в которой происходит расширение газа. Она называется детандером. Устройство его может быть самым разнообразным.
Чтобы газ можно было подвергнуть расширению (в детандере), он должен быть сперва сжат компрессором. Работа, совершаемая компрессором, и есть та работа, за счет которой становится возможной передача тепла от холодного тела к теплому. Но при сжатии газа он нагревается, что, конечно, уменьшает эффективность последующего охлаждения при расширении. Поэтому тепло, выделяемое при сжатии, отводится (например, проточной водой), так что процесс сжатия может считаться изотермическим.
С термодинамической точки зрения сущность работы рассматриваемой нами холодильной машины, использующей адиабатное расширение газа, я яснее всего видна из диаграммы зависимости энтропии от температуры. Такая диаграмма показана на рис.2, на котором изображена зависимость энтропии газа S от температуры Т при постоянном давлении для двух различных давлений – высокого р1 и низкого р2.
 рис. 2
рис. 2
Легко видеть ,что кривые правильно передают особенности энтропии как меры беспорядка. Ясно, что беспорядок (а значит и энтропия) тем больше, чем выше температура, и тем меньше, чем выше давление. Именно это отражает этот рисунок.
Процесс изотермического сжатия от давления р2 до р1 изображается на этом рисунке вертикальной прямой АВ (энтропия уменьшается). Обратимому адиабатному расширению от давления р1 до р2 соответствует горизонтальная прямая ВС, так как при этом процесс энтропия остается постоянной. Из рисунка видно, что расширенное сопровождается понижением температуры от Т2 до Т1. Это значит, что рост энтропии, вызванный расширением, как бы компенсируется уменьшением ее, сопровождающим охлаждение.
Рассмотренное только что охлаждение газа его расширением в детандере используется , как и эффект Джоуля – Томсона, для понижения температуры газов с низкими критическими температурами перед их сжатием. Обычно расширение в детандере служит лишь для предварительного охлаждения сжигаемых газов до возможно более низкой температуры (во всяком случае ниже критической). Самое же сжижение осуществляется с помощью дросселирования уже охлажденного газа. Можно, разумеется, добиться сжижения газа в самом детандере, не прибегая к дросселированию, но при очень низких температурах сжижаемых газов это создает очень тяжелые условия для его работы. Поэтому в тех машинах, в которых применяется метод адиабатного расширения в детандерах, он комбинируется с методом дросселирования.
Рассмотрим теперь некоторые примеры машин, в которых используются описанные нами методы охлаждения – метод
Джоуля – Томсона и метод адиабатного расширения с совершением внешней работы.
Дата добавления: 2021-04-24; просмотров: 343; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
