Задачи на газовые законы. Определение количественных отношений
Фестиваль исследовательских и творческих работ
Учащихся «Портфолио»
"Алгебраические способы решения химических задач "
Автор:
Кимович Кристина Александровна
Россия, Иркутская область,
МОУ " Лицей г.Черемхово"
III курс ЕН
Руководитель:
Гошкадёра Н.А.,
учитель химии
2005 г.
Аннотация
на работу « Алгебраические способы решения задач » Климович Кристины, учащейся МОУ Лицей г. Черемхово, Иркутской обл.
В данной исследовательской работе рассмотрены алгебраические способы решения химических задач с помощью уравнений, систем уравнений и неравенств. Эти способы позволяют упростить алгоритмы решения задач усложнёнными исходными данными. В этой работе реализованы связи между предметами химии и математики; рассмотрены принципы составления алгебраических уравнений и неравенств; приведены развёрнутые решения задач и задачи для самостоятельного решения. Тексты задач взяты из книг, авторов: Н.Е. Кузьменко ( проф. химического факультета МГУ ), В.В. Ерёмина ( доцент химического факультета МГУ ), которые были включены билеты на вступительные экзамены в МГУ.
|
|
|
Работа будет полезна учащимся лицеев, гимназий, будущим абитуриентам для подготовки к вступительным экзаменам в ВУЗы.
Учитель химии: Гошкадёра Наталья Анатольевна.
Содержание:
I. Введение……………………………………………………………. 4 стр.
II. Основная часть……………………………………………….. 5-19 стр.
1) Вычисление состава соединений, смесей; выведение формул соединений………………………………………………. … 5-8 стр.
2) Задачи на газовые законы. Определение количественных отношений в газах…………………………………………… 9-13 стр.
3) Решение задач по химическим уравнениям……………….14-19 стр.
III. Задачи для самостоятельного решения…………………………… 20-21 стр.
IV. Заключение ……………………………………………………………… 22 стр.
V. Библиография………………………………………………………………23 стр.
|
|
|
I . Введение.
При изучении химии широко используется решение задач. В данной исследовательской работе рассмотрены способы решения химических задач с помощью методов алгебры: уравнений, систем уравнений, неравенств. Эти приемы позволяют упростить алгоритмы решения задач с усложненными исходными данными. Работа содержит общие положения, касающиеся способов решения расчетных задач. В каждом из следующих разделов рассмотрены принципы составления алгебраических уравнений для задач разных типов, приведены развернутые решения задач и задачи для самостоятельного решения. Широкое применение математики при решении химических задач способствует формированию у учащихся осознанного стремления к применению математических знаний на практике и реализации межпредметных связей между науками химией и математикой.
Алгебраические способы решения задач незаменимы, если задача сложна и ее нельзя решить одной - двумя пропорциями. Именно в этом случае удобно воспользоваться другими методами алгебры, чаще всего линейными уравнениями и неравенствами. Решение задач можно свести к двум этапам: составлению уравнения (системы уравнений) по условию задачи и решению полученного уравнения.
|
|
|
II . Основная часть.
Вычисление состава соединений, смесей, выведение формул соединений.
При решении химических задач часто возникает потребность проводить вычисления для нахождения соотношений составных частей в различных объектах. В качестве последних можно рассматривать химические соединения, смеси веществ, сплавы. Задачи этого типа приходиться решать не только химикам, но и представителям самых разнообразных профессий – агрономам, врачам, металлургам, геологам и т. д.
В задачах обычно рассматриваются объекты, которые состоят из компонентов. Количественный состав объектов удобно выражать в долях, которые составляют компоненты по отношению к целому объекту. Употребляют массовую, объемную и молярную доли. Массовая доля w (X 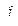 ) i-го компонента, входящего в состав объекта, равна отношению массы этого компонента m (X
) i-го компонента, входящего в состав объекта, равна отношению массы этого компонента m (X 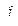 ) к массе объекта m (об) и выражается в долях единицы или в процентах:
) к массе объекта m (об) и выражается в долях единицы или в процентах:
W ( 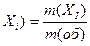 , или w(
, или w( 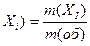 100 %
100 %
Массу компонента в объекте вычисляют, умножив массу объекта на массовую долю компонента в нем: m(x ) = m ( об ) ∙ w ( x )
Так, зная химический состав соединений, т. е. их формулы и молярные массы, можно вычислять массовые доли элементов в этих соединениях. И наоборот, зная массовые доли элементов в соединениях, можно находить молекулярную формулу соединения.
|
|
|
Ниже приведены примеры решения отдельных задач. Все они принадлежат к одному типу, поэтому алгоритмы их решения идентичны. В преобладающем большинстве случаев ход решения строится так: обозначаем буквами неизвестные величины и формулируем их физический смысл; словесно формулируем смысл уравнений и неравенств, которые затем записываем с помощью символов; подставляем числовые значения; решаем систему уравнений и неравенств и даем ответ.
Задача № 1 . Вывести формулу вещества с молярной массой 123 г/моль, если состав его , выраженный в массовых долях , следующий : углерод 58,5 %, водород 4,1 %, азот 11,4 %, кислород 26,0 %
Решение: Формулу соединения условно можно записать Cx H y Nz Ot .
Искомые величины – числа атомов в молекуле ( индексы в данной формуле- x, y, z, t).
Массовые доли химических элементов в данном веществе можно выразить:
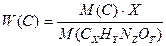 W (N) =
W (N) = 
W (H) =  W (O) =
W (O) = 
Составим уравнения, учитывая, что произведение молярной массы соединения на массовую долю данного элемента, входящего в его состав, равно молярной массе элемента, умноженной на его индекс в формуле соединения.
Решим каждое уравнение :
М ( Cx Hy Nz Ot ) ∙ w ( C ) = x∙ M ( C ) 123∙0,585 = 12 х , х = 6
М ( Cx Hy Nz Ot ) ∙w ( H ) = y ∙ M ( H ) 123 ∙ 0. 041 = у у = 5
М ( Cx Hy Nz Ot ) ∙ w (N ) = z ∙ M ( N ) 123 ∙ 0, 114 = 14 z z = 1
M ( Cx Hy Nz Ot ) ∙ w ( O ) = t∙ M (O) 123∙ 0,26 = 16t, t=2
Ответ: формула соединения 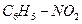 ( нитробензол).
( нитробензол).
Задача № 2 . В кристаллогидрате сульфата марганца ( II ) массовая доля марганца равна
0, 268. Определить количество вещества воды, приходящееся на 1 моль кристаллогидрата. Написать формулу соли.
Решение: Рассматриваемым объектом является 1 моль кристаллогидрата сульфата марганца (II ). Его формулу условно запишем 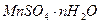 , где n- искомая величина.
, где n- искомая величина.
Составим уравнение, учитывая, что массовая доля марганца в кристаллогидрате равна отношению молярных масс марганца и данного кристаллогидрата:
W (Mn) =  .
.
Подставляя в уравнение вместо символов их числовые значения, получим: 0,268 = 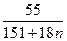 . Решая уравнение, найдём n = 3 .
. Решая уравнение, найдём n = 3 .
Ответ: 1 моль кристаллогидрата сульфата марганца ( II ) содержит 3 моль воды. Формула соли - 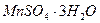 .
.
Задача № 3 . При полном сгорании 3,1 г органического вещества (М= 93 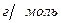 ) образовалось 8, 8 г оксида углерода ( IV) , 2,1 г воды и выделилось 0,47 г азота. Написать формулу вещества.
) образовалось 8, 8 г оксида углерода ( IV) , 2,1 г воды и выделилось 0,47 г азота. Написать формулу вещества.
Решение: В общем виде соединение можно представить формулой 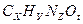 , где х , у, z и t- искомые величины.
, где х , у, z и t- искомые величины.
Составим уравнения, учитывая следующее:
1) масса углерода в сгоревшем веществе и в образовавшемся оксиде углерода
( IV) равны:
m ( Cx Hy Nz Ot ) 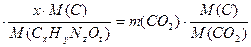
или 3,1  88
88  , откуда х=6;
, откуда х=6;
1) массы водорода в сгоревшем веществе и в образовавшейся воде равны:
m (CxHyNzOt) 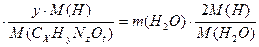
или 3,1  , откуда у=7;
, откуда у=7;
2) масса азота в 3,1 г соединения равна 0,47 г:
m ( 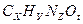 )
) 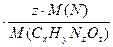 , 3,1
, 3,1 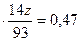 ,
,
откуда z=1;
3) молярная масса соединения равна сумме молярных масс каждого элемента, умноженных на соответствующие индексы в формуле:
М ( 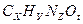 ) = х
) = х 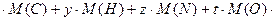 , или
, или
93=6 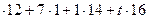 , откуда t =0.
, откуда t =0.
Ответ: формула соединения  (анилин).
(анилин).
Задача № 4 . Массовая доля серебра в соли предельной одноосновной органической кислоты составляет 70,59 %. Написать молекулярную формулу этой кислоты, если известно , что она состоит из углерода , водорода и кислорода .
Решение: Запишем химические формулы кислот и её соли в условном виде: 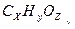 и Аg
и Аg 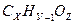 .Индексы х, у и z-искомые величины.
.Индексы х, у и z-искомые величины.
Выражая молярную массу соли серебра через молярные массы составляющих её атомов, получим:
М (Аg 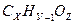 ) = х
) = х 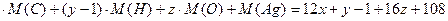
Составим уравнение, учитывая, что произведение молярной массы соли на массовую долю в ней серебра равно молярной массе серебра:
М (Аg 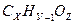 )
) 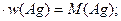
(107+12х+у+16z) 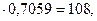 откуда 12х + у + 16z = 46.
откуда 12х + у + 16z = 46.
По условию задачи одноосновная предельная органическая кислота имеет общую формулу 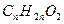 , или,
, или,  . Отсюда у =2х , z = 2.
. Отсюда у =2х , z = 2.
Искомые числа х и у одновременно удовлетворяют двум уравнениям:
12х +у +16 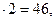
2х = у
Решая систему уравнений, получим х = 1, у = 2. Следовательно, формула кислоты - 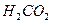 , или НСООН.
, или НСООН.
Ответ: Формула кислоты - НСООН.
Задача № 5 . После полного термического разложения 2,0 г смеси карбонатов кальция и стронция получили 1,23 г смеси оксидов этих металлов. Оксид углерода (IV) улетучился. Вычислить массу карбоната стронция в исходной смеси.
Решение: Запишем уравнение реакции:
x y
SrC  → SrO + C
→ SrO + C  (I)
(I)
148 г 104 г
2-х 1,23-у
CaC  → CaO + C
→ CaO + C  (II)
(II)
100 г 56 г
Искомую величину- массу карбоната стронция в смеси обозначим через х: m (SrC  = x. Тогда масса карбоната кальция будет равна m (CaC
= x. Тогда масса карбоната кальция будет равна m (CaC  ) = 2-x, а масса выделившегося оксида углерода (IV) составит m (C
) = 2-x, а масса выделившегося оксида углерода (IV) составит m (C  ) = (2-1,23) г = 0,77 г.
) = (2-1,23) г = 0,77 г.
Составим уравнение, учитывая, что масса углерода в исходной смеси карбонатов металлов равна массе углерода в выделившемся оксиде углерода (IV):
m ( CaC  )
) 
Подставляя числовые значения, получим:
(2-х) 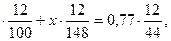 откуда х=0,75 .
откуда х=0,75 .
Ответ: масса карбоната стронция равна 0,75 г .
Задача № 6 . Рассчитать массовые доли компонентов смеси , состоящей из гидрата карбоната аммония , карбоната калия и гидрофосфата аммония, если известно , что из 38,4 г этой смеси получили 8,8 г углекислого газа и 6,8 г аммиака.
Решение:
М (  ) = 114 г/моль
) = 114 г/моль
М ( 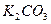 ) = 138 г/моль
) = 138 г/моль
М ( 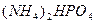 ) = 132 г/моль
) = 132 г/моль
Пусть в смеси х моль 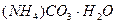 , у моль
, у моль 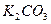 и z моль
и z моль 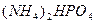 , тогда
, тогда
114х + 138у + 132z = 38,4
Из х моль гидрата карбоната аммония можно получить 2х моль аммиака и
х моль углекислого газа:
х 2х х
 → 2
→ 2 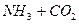

Аналогично,
у у z 2z
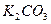 →
→ 
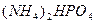 → 2
→ 2 
n (  ) = 8,8/44 = 0,2 моль х + у = 0,2
) = 8,8/44 = 0,2 моль х + у = 0,2
n (  ) = 6,8/ 17= 0,4 моль 2х+2z =0,4
) = 6,8/ 17= 0,4 моль 2х+2z =0,4
Решая систему уравнений
114х + 138у + 132z = 38,4
х + у = 0,2
2х+2z =0,4
находим х = у = z = 0,1 моль
w ( 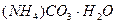 ) =
) = 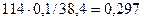
w ( 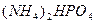 ) =
) = 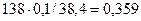
w ((NH4)HPO4 = 
Ответ: w ( 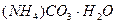 ) = 29,7 % , w(
) = 29,7 % , w( 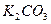 ) = 35,9 % ,
) = 35,9 % ,
w ( 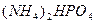 ) = 34,4 %.
) = 34,4 %.
Задачи на газовые законы. Определение количественных отношений
В газах.
Расчёты масс, количеств веществ и объёмов газов обычно проводят с помощью алгебраических уравнений, как правило, на основе закона Авогадро. Рассмотрим некоторые особенности составления таких уравнений.
Иногда в задачах требуется произвести вычисления с газами, при смешении которых не происходит химического взаимодействия, а образуется смесь исходных газов. В таких случаях при составлении алгебраических уравнений учитывают, что масса газовой смеси равна сумме масс газов смеси. В уравнении массу каждого газа, а также смеси представляют как произведение количества вещества газа на его молярную массу: m = n* M. В отдельных задачах при составлении уравнений принимают во внимание , что количество вещества в газовой смеси равно сумме количеств веществ газов, которые были смешаны.
Если в условии задачи задана относительная плотность D некоторого газа, имеющего молярную массу М ( х ), по другому газу, имеющего молярную массу М ( а ), то можно использовать существующую зависимость между этими величинами: D = М ( х ) / М ( а ) – выражать молярную массу газа М ( х ) в виде произведения  .
.
Во многих задачах рассматриваются газы, которые при смешении реагируют между собой, образуя газообразные продукты реакции. В таких случаях при составлении алгебраических уравнений учитывают, что объёмы участвующих в реакции газов относятся как коэффициенты перед формулами соединений в уравнении химической реакции. Причём объёмы газов должны быть взяты при одинаковой температуре и давлении. В алгебраических уравнениях отношение объёмов реагирующих газов иногда удобно заменять отношением количеств веществ газов.
В процессе решения задач, касающихся газов, иногда полезно использовать информацию, которую можно представить в виде неравенств. Последние иногда непосредственно следуют из условия задачи. Однако в ряде случаев их можно составлять на основе известных свойств газов. Например, для любого газа относительная плотность по водороду больше единицы: DH > 1; средняя молярная масса газа, состоящего из молекул различных соединений, находится в пределах значений молярных масс этих соединений: 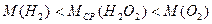 и т. п.
и т. п.
Иногда в условиях задач объём газа даётся не при нормальных, а при каких-то других условиях. В этом случае, как обычно говорят, нужно привести объём к нормальным условиям. Для этого проще всего воспользоваться объединённым газовым законом, который математически выражается так:
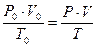 .
.
Где V0 – объём газа при н.у., т.е. при нормальной температуре T0 = 273 K и при нормальном давлении P0 =101325 Па; V- объём газа при данной температуре T и данном давлении P.
Значение молярной массы газа, а также число молей газа можно найти при использовании уравнения Клапейрона - Менделеева:
PV= 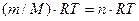
Где P - давление газа , V- объём системы , m – масса газа , Т- абсолютная температура, R- универсальная газовая постоянная: R= 8,31 Дж / ( 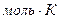 ).
).
При расчётах газовых реакций нет необходимости определять число молей веществ, а достаточно пользоваться их объёмами. Из закона Авогадро и основного закона стехиометрии вытекает следующее следствие отношение объёмов газов, вступающих в реакцию, равно отношению коэффициентов в уравнении реакции. Это утверждение называется законом объёмных отношении Гей-Люссака.
Задача № 1 . Какой объём (н.у.) озонированного кислорода с молярной долей озона 24 % требуется для сжигания 11,2 л водорода.
Решение: Реакциям горения водорода отвечают уравнения:
2 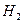 +
+  = 2
= 2 
3 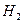 +
+  = 3
= 3 
Искомая величина V (смеси) – объём озонированного кислорода, необходимый для сжигания 11,2 л водорода. Составим уравнения, учитывая, что количество вещества водорода равно сумме удвоенного количества кислорода и утроенного количества вещества озона.
n ( 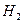 ) = 2n (
) = 2n (  )+ 3n (
)+ 3n (  ),
),
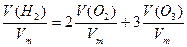 ,
,

Откуда V (смеси) =5 л.
Ответ: 5 л озонированного кислорода.
Задача № 2 . К 30 л смеси, состоящей из этана и аммиака добавили 10 л хлороводорода, после чего плотность паров газовой смеси по воздуху стало равной 0,945. Вычислить объёмные доли газов в исходной смеси.
Решение:
При добавлении хлороводорода происходит реакция
 + HCl →
+ HCl → 
с образованием твёрдого  .
.
Конечная газовая смесь имеет среднюю молярную массу
Мср = 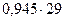 = 27,4 г/ моль
= 27,4 г/ моль
и состоит из этана ( М= 30 г/ моль) и аммиака (М= 17 г/ моль). Это означает, что аммиак в реакции - в избытке. Если бы в избытке был хлороводород , то в конечной смеси вместо аммиака был хлороводород , и средняя молярная масса была бы больше 30 г/ моль.
Пусть в исходной смеси было х л аммиака и у л этана, тогда в конечной смеси содержатся
( х- 10) л аммиака и у л этана. Значения объёма исходной смеси и молярной массы конечной смеси дают систему двух уравнений для х и у :
х + у = 30

откуда следует х=14 л , у=16 л .
φ (  ) = 14/30 = 0,47, φ (
) = 14/30 = 0,47, φ (  ) = 16/30 = 0,53.
) = 16/30 = 0,53.
Ответ: 47 %  , 53 %
, 53 %  .
.
Задача № 3 . Смесь паров пропина и изомерных монохлоралкенов при 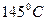 и давлении 96,5 кПа занимает объём 18 л и при сжигании в избытке кислорода образует 18 г воды. Вывести формулы монохлоралкенов. Вычислить объём 1,7 % раствора нитрата серебра (плотность 1,01 г/мл), который может прореагировать с продуктами сжигания исходной смеси, если известно, что её плотность по воздуху 1,757.
и давлении 96,5 кПа занимает объём 18 л и при сжигании в избытке кислорода образует 18 г воды. Вывести формулы монохлоралкенов. Вычислить объём 1,7 % раствора нитрата серебра (плотность 1,01 г/мл), который может прореагировать с продуктами сжигания исходной смеси, если известно, что её плотность по воздуху 1,757.
Решение: Общая формула монохлоралкенов -  .
.
Сгорание компонентов смеси происходит по уравнениям:
х 2х
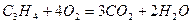
у (n -1)y
 + (1.5 n-0.5)
+ (1.5 n-0.5) 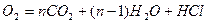 .
.
Пусть в смеси было х моль 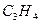 (М = 40 ) моль, y моль
(М = 40 ) моль, y моль  (М = 14n+34).
(М = 14n+34).
Общее количествo веществa в газовой смеси : n = PV/RT = 96.5 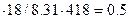 моль. Средняя молярная масса смеси равна М=29
моль. Средняя молярная масса смеси равна М=29  = 50.95 г/моль.
= 50.95 г/моль.
Отсюда масса 0.5 моль смеси составляет m = 50.95 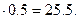
При сгорании х моль 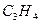 образуется 2х моль воды, а при сгорании у моль
образуется 2х моль воды, а при сгорании у моль  образуется у
образуется у 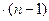 моль воды.
моль воды.
Всего получено 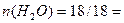 1 моль.
1 моль.
Таким образом, можно составить систему из трёх уравнений :
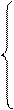
x + у = 0.5
40х + (14n + 34.5) y = 25.5
2x + y (n-1) = 1
Решение этой системы даёт х = 0.35 моль, у = 0.15 моль, n = 3.
Неизвестные монохлоралкены имеют молекулярную формулу  .
.
В смеси содержалось 0.15 моль  , при сгорании которых по уравнению
, при сгорании которых по уравнению
0,15 моль 0,15 моль
 + HCl
+ HCl
образовалось 0,15 моль HCl.
В реакцию
0,15 0,15
HCl + 
Вступило 0.15 моль 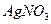 .
.
m ( 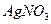 ) = 0.15
) = 0.15  г.
г.
w (AgNO3) = 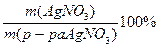
m (р-ра 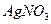 ) = 25.5/0.017= 1500 г
) = 25.5/0.017= 1500 г
V (р-ра 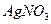 ) = 1500/1.01= 1485 мл.
) = 1500/1.01= 1485 мл.
Ответ:  , 1485 мл раствора
, 1485 мл раствора 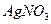 .
.
Задача № 4 . К 30 литрам смеси , состоящей из аргона и этиламина , добавили 20 литров бромоводорода, после чего плотность газовой смеси по воздуху равна 1,814. Вычислить объёмные доли газов в исходной смеси.
Решение: Пусть в исходной смеси содержалось х л Ar и у л  , тогда
, тогда
х + у = 30
При добавлении бромоводорода происходит его реакция с этиламином и образуется твёрдое вещество – бромид этиламмония.
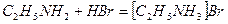
Средняя молярная масса оставшейся газовой смеси равна
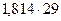 =52,6 г/моль
=52,6 г/моль
Это означает, что в газовой смеси находятся Ar и HBr ( если бы в смеси остались Ar и  , то 40 < МСР < 45).
, то 40 < МСР < 45).
Пусть объём аргона в оставшейся газовой смеси - х л V (Ar) = x , тогда
V (HBr) = 20-y.
МСР = 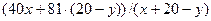 = 52,6
= 52,6
Решим систему уравнений:
х + у = 30

находим: х = 18, у =12.
Объёмные доли равны w (Ar) = 18/ 30 = 0,6 ( или 60 %)
W (  ) = 12/ 30 = 0,4 (или 40 % ).
) = 12/ 30 = 0,4 (или 40 % ).
Ответ: 60 % Ar , 40 %  .
.
Задача № 5. Рассчитайте массовую долю более лёгкого газа в смеси состоящей из аммиака и азота имеющий плотность 1,03 г/л при давлении 90 кПа и температуре 263 К.
Решение: Возьмём 1 моль смеси , которая содержит х моль  и у моль
и у моль  , то есть
, то есть
х + у =1
Средняя молярная масса смеси газов может быть рассчитана с помощью уравнения Клайперона - Менделеева: PV = 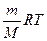 ; ρ =
; ρ =  ; M = ρ
; M = ρ 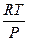
M = 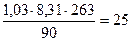 г/моль
г/моль 
В таком случае масса 1 моля смеси равна 25 г:
17х + 28 у =25 
Решая систему уравнений:
х + у =1
17х + 28 у =25 

находим х = 0,273 моль, у = 0,727 моль
w (  ) = 17
) = 17  ( 18,6 % )
( 18,6 % )
Ответ: w (  ) = 18,6 %.
) = 18,6 %.
Задача № 5. При нормальных условиях 12 л газовой смеси, состоящей из аммиака и оксида углерода (IV), имеют массу 18 г. Сколько литров каждого из газов содержит
смесь?
Решение: Стандартный способ решения расчётных задач на установление состава смеси – обозначить количества веществ через неизвестные переменные и составить для них систему уравнений.
Пусть n ( NH3) = х моль, n ( CO2) = у моль. Массы газов равны: m (NH3) = x 17 г,
m ( CO2) = у 44 г. Общее число молей газов в смеси равно 12/22,4 = 0,536 моль.
Составим систему уравнение:
х + у = 0,536 (количество смеси),
17x + 44y = 18 (масса смеси)
Решая систему, находим: х = 0,207 л, у=0,329 л. Объёмы газов равны:
Ответ: 4,64 л NH3, 7,36 л. CO2.
Дата добавления: 2021-04-15; просмотров: 131; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
