Синтетические трансформации динитрофуроксана
Московский государственный университет имени М.В. Ломоносова
Химический факультет
Институт органической химии им. Н.Д. Зелинского РАН
Лаборатория азотсодержащих соединений №19
Иодометрическое определение динитрофуроксана
Курсовая работа
студента 203 группы
Тесленко Фёдора Евгеньевича
Научный руководитель:
д.х.н., в.н.с. Л.Л. Ферштат
Преподаватель:
к.х.н., доцент С.В. Смирнова
| |
Оглавление
Введение . 3
Обзор литературы .. 5
Синтез динитрофуроксана . 5
Синтетические трансформации динитрофуроксана . 6
Иодометрия . 7
Применения иодометрии .. 9
Экспериментальная часть . 10
Оборудование . 10
Синтез динитрофуроксана . 10
Приготовление и стандартизация растворов . 10
Методика титрования динитрофуроксана . 11
Обсуждение результатов . 12
Расчёт концентрации динитрофуроксана и вывод формул .. 12
Анализ полученных данных . 14
Выводы .. 17
Список литературы .. 18
Введение
3,4-Динитро-1,2,5-оксадиазол-2-оксид (динитрофуроксан) DNFO (рис. 1) является важным прекурсором в синтезе гетероциклических соединений. Вследствие сильной электронодефицитности, обусловленной электроноакцепторным эффектом как фуроксанового цикла, так и нитрогрупп, связи С(1)-С(2), С(1)-N(3), С(2)-N(4) и N(1)-O(2) являются довольно слабыми [1], что позволяет проводить реакции как замещения обоих нитрогрупп [2], так и использовать DNFO в качестве источника своего мономера – нитроформонитрилоксида [3].
|
|
|

Рис. 1. Динитрофуроксан DNFO
Однако динитрофуроксан является малостабильным и крайне взрывоопасным веществом. Это накладывает два серьезных ограничения на работу с ним: во-первых, невозможно точно определить количество вещества, взятого в реакцию (оно определяется, исходя из литературного выхода), а во-вторых, масштабирование реакций с участием DNFO становится сложной и рискованной с техногенной точки зрения задачей. При этом известно, что динитрофуроксан для синтетических целей может храниться в сухих растворителях в морозильной камере больше месяца [3].
Иодометрия является одним из самых удобных методов определения концентраций веществ [4]. К числу ее преимуществ следует отнести экспрессность, а также легкодоступность расходных материалов (иодид калия, тиосульфат натрия и дихромат калия). Основываясь на литературном прецеденте окисления тиолов в соответствующие дисульфиды под действием нитрофуроксанов [5], можно предположить, что иодид анион также будет окисляться до молекулярного иода, что откроет возможность проведения титриметрического анализа DNFO и позволит точно определять количество вещества, не выделяя его в чистом виде и обеспечивая таким образом необходимый уровень безопасности. Поэтому целью данной работы является разработка метода иодометрического определения DNFO.
|
|
|
Обзор литературы
Синтез динитрофуроксана
Динитрофуроксан DNFO может быть синтезирован двумя путями (схема 1), соответствующими двум «классическим» методам синтеза фуроксанового цикла. Верхняя часть схемы демонстрирует синтез из калиевой соли динитрометана KDNM в двухфазной системе серная кислота – хлорорганический растворитель [6]. На первой стадии происходит генерация аци-формы динитрометана, которая может быть дегидратирована серной кислотой в нитроформнитрилоксид, вступающий в гомо-[3+2] диполярное циклоприсоединение, формируя продукт реакции. Побочным продуктом реакции является сам динитрометан, который может быть легко удалён с помощью раствора пищевой соды. Литературный выход этой методики – 34% Второй метод – окисление глиоксимов – отличается более простой методикой. Побочные продукты разрушения фуроксанового цикла и избыток окислителя также легко удаляются с помощью промывки пищевой содой. Литературный выход этой методики – 81% [2].
|
|
|
Калиевая соль динитрометана может быть легко получена по описанной методике действием метанольного раствора гидроксида калия на смесь тетранитрометана и нитрометана при пониженной температуре. Динитроглиоксим также является легкодоступным исходником, получаемым из коммерчески доступного глиоксима.
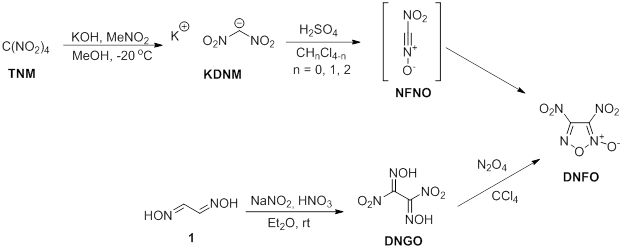
Схема 1. Синтез DNFO
Вследствие отсутствия количественного метода определения динитрофуроксана, после очистки и осушения растворителя и в первом, и во втором случае необходимо удалить растворитель на роторном испарителе. Вследствие крайней взрывоопасности, процесс проводят не при повышенной температуре, что является широко распространённой практикой, а наоборот, при охлаждении льдом.
Синтетические трансформации динитрофуроксана
Динитрофуроксан является важным прекурсором для получения функционально замещенных 3-нитрофуроксанов (схема 2). Известно, что С(4) положение фуроксанового цикла является электрофильным центром, поэтому нитрогруппа может быть замещена на нуклеофил с получением новых производных фуроксана, что было показано на многочисленных примерах [7-9]. Замещение в С(3) положении цикла описано только для крайне реакционно способных нуклеофилов (например, метилат-анион). Тем не менее, из динитрофуроксана были получены 4-азидо-3-нитрофуроксан 2a, обладающий нулевым кислородным балансом (брутто-формула C2N6O4) [2], а также диметоксифуроксан 3а, синтез которого классическими способами так и не был осуществлён.
|
|
|

Схема 2. Нуклеофильное замещение в DNFO
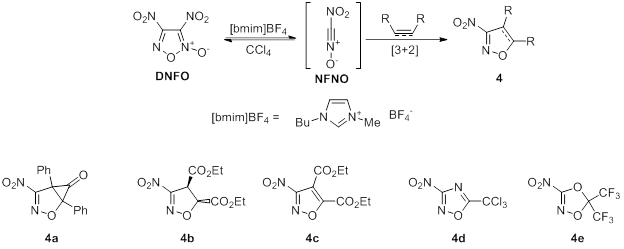
Схема 3. [3+2] диполярное циклоприсоединение нитроформнитрилоксида NFNO
Перициклические реакции по праву считаются одними из самых мощных методов конструирования гетероциклических соединений [10-12]. Как уже было сказано ранее, один из классических методов синтеза фуроксанов является димеризация нитрилоксидов. Эта реакция является необратимой для всех известных фуроксанов, кроме DNFO, который вследствие сильной электронодефицитности обратимо распадается до нитроформонитрилоксида NFNO под действием каталитических количеств ионных жидкостей (схема 3) [3]. NFNO в свою очередь является активным диполем и может быть перехвачен разными диполярофилами с образованием изоксазолинов (4a,b), изоксазолов (4с) 1,2,4-оксадиазолов (4d) и даже 1,4,2-диоксазолов (4e). Во всех случаях получаются 3-нитропроизводные данных гетероциклов, что открывает широкие возможности для дальнейшей функционализации получаемых веществ практически важных классов.
Иодометрия
Иодометрия – метод окислительно-восстановительного титрования, основанный на обратимой реакции окисления иодид-аниона до молекулярного иода (уравнение 1) [4]. Вследствие плохой растворимости иода в воде, в растворе генерируется трииодид калия KI3, что также влияет и на потенциал реакции (уравнение 2).
I2 + 2 e- = 2 I- EoI2/2I- = 0.62 В (уравнение 1)
I3- + 2 e- = 3 I- EoI3-/3I- = 0.54 В (уравнение 2)
Приведенные потенциалы показывают, что иодометрическое титрование может быть использовано для определения как окислителей, так и восстановителей. Действительно, иодид-ион довольно часто является эффективным мягким одноэлектронным восстановителем (что, например, используется для весьма точного иодометрического определения меди), иод же является галогеном и способен выступать в качестве окислителя. В этом случае различают два вида титриметрического анализа – иодиметрию (I2 – окислитель, определяют восстановитель) и иодометрию (I- - восстановитель, определяют окислитель). В обоих случаях анализ основан на реакции иода с тиосульфатом натрия (уравнение 3). Реакция идёт быстро и стехиометрично, что позволяет определить либо избыток иода, либо количество образовавшегося иода. Конечную точку титрования определяют по исчезновению окраски комплекса иода с крахмалом.
2 Na2S2O3 + I2 = 2 NaI + Na2S4O6 (уравнение 3)
Ограничения в иодометрии накладываются двумя факторами – медленностью реакций окисления иодид-аниона и побочными реакциями иода. Вследствие первого (кинетического) фактора проведение иодометрии прямым титрованием окислителя зачастую представляется невозможным. Также иодид-анион может окисляться кислородом воздуха, что влияет на сам результат и его воспроизводимость. Поэтому зачастую применяется заместительное титрование: определяемое вещество вводится в реакцию с заведомым избытком иодида калия, выдерживается, и затем проводится титрование иода тиосульфатом натрия (таким образом, в некотором роде достигается «замещение» окислителя на иод). Выдержка преимущественно должна проводиться в тёмном месте при рН < 10 для предотвращения побочных реакций (уравнения 4, 5) [13].
I2 + hυ = 2 I· Eдис = 149 кДж/моль (уравнение 4)
I2 + 2 OH- = IO- + I- + H2O (уравнение 5)
Применения иодометрии
Иодометрия находит применение как в определении металлов, так и как метод анализа органических веществ. Как уже было отмечено, она является одним из точнейших методов определения меди в растворе [4]. Оно основано на реакции двухвалентной меди с иодид анионом, в результате которой образуется не CuI2, а CuI, вследствие протекания процесса, показанного в уравнении 6.
2 Cu2+ + 4 I- = 2 CuI + I2 EoCu2+, I2 / CuI = 0.86 В (уравнение 6)
Также на этой реакции основано определение сахаров [13]. Сначала определяют концентрацию меди в исходном растворе, и вводят его к раствору глюкозы в избыточном количестве. Глюкоза реагирует с тартратным комплексом меди, восстанавливая двухвалентную медь до оксида меди (I). Затем титруют избыток меди, по разнице находят концентрацию сахара в растворе.
Конечно, нельзя не упомянуть о иодиметрическом определении аскорбиновой кислоты (витамина С). Основанная на реакции окисления, представленной на схеме 4, она представляет собой пример прямого титрования, так как окисление проходит быстро и полностью. Разработаны методики, позволяющие определять витамин С даже в различных объектах: начиная от таблеток и заканчивая соками, овощами и фруктами [14].

Схема 4. Реакция иода с аскорбиновой кислотой 5
Экспериментальная часть
Оборудование
Все взвешивания были проведены на весах KERN ABJ-NM/ABS 220-4N с точностью 0.2 мг.
Синтез динитрофуроксана
1) К смеси 95% H2SO4 (10 мл, ρ = 1.84 г/мл) и CCl4 (10 мл, ρ = 1.60 г/мл) в течение 1.5 минут маленькими порциями прибавляют KDNM (1.0077 г, 7.00 ммоль) при 20 oC. После растворения KDNM, смесь 1 час нагревают на кипящей водяной бане, затем выливают в 15 г раздробленного льда, экстрагируют 3x20 мл СCl4, органические слои объединяют, промывают 2x10 мл 1% NaHCO3 затем 10 мл H2O и сушат над MgSO4.
После фильтрования, раствор переносят в мерную колбу на 200.0 мл и доводят до метки CCl4. Полученный раствор хранится при -18 оС в морозильной камере более месяца.
2) К раствору динитроглиоксима DNGO (0.6230 г, 3,5 ммоль) в 10 мл CCl4 при 20 oC приливают раствор 0.75 мл N2O4 (12.5 ммоль) в 5 мл ССl4. Через 3.5 часа реакционную массу промывают 3x30 мл 1% NaHCO3 затем 30 мл H2O и сушат над MgSO4.
После фильтрования, раствор переносят в мерную колбу на 200.0 мл и доводят до метки CCl4. Полученный раствор хранится при -18 оС в морозильной камере более месяца.
Дата добавления: 2021-07-19; просмотров: 87; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
