Биоэнергетика живого организма (роль АТФ в энергетических превращениях, характеристические реакции).
Термодинамика биологических систем
1. Что называется системой в термодинамике, их виды (перечислить, дать определение, особенности для живых объектов)?
Система-произвольно выбранная часть пространства, заполненная веществом или совокупностью веществ между которыми внутри системы возможен тепловой обмен или обмен массой.
В зависимости от характера взаимодействия системы с окружающей средой:
1.Изолированные-системы,которые не обениваются с окр.средой ни веществом, ни энергией(термос)2.Закрытые-системы,которые обмениваются с окр.средой энергией,но не обмениваются веществом(колба)3.Открытыесистемы-системы,которые обмениваются с окр.средой и веществом и энергией (организм человека)Гетерогенные(состоят из нескольких фаз,вещества отделены поверхностью раздела, реакции идут на поверхности.(вода) Гомогенные(одна фаза,нет полверхности раздела,реакции идут в полном объеме(плазма)
2. Определение энергии в термодинамике, её виды (перечислить, дать определение, виды в живом организме).
Энергия- это количественная мера определенного вида движения и взаимодействия материи при ее превращении из одного вида в другой.
Механическая энергия - форма энергии, характеризующая движение макротел и способность совершать механическую работу по перемещению макротел. Механическая энергия разделяется на кинетическую, определяемую скоростью движения тел, и потенциальную, определяемую расположением макротел друг относительно друга.Тепловая энергияпредставляет собой сумму кинетической энергии хаотического теплового движения всех атомов и молекул вещества. Показателем теплового движения частиц является температураХимическая энергия - энергия взаимодействия атомов в молекуле. Электрическая энергия - энергия взаимодействия электрически заряженных частиц, вызывающая движение этих частиц в электрическом поле.
|
|
|
3. Сформулировать первый закон термодинамики для неживых и живых объектов (определение, примеры).
Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: 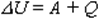 2)Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
2)Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами: 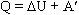 В первой формулировке А - работа, совершаемая над системой (над газом), во второй А' - это работа, совершаемая системой (газом).
В первой формулировке А - работа, совершаемая над системой (над газом), во второй А' - это работа, совершаемая системой (газом).

4. Перечислить и определить основные виды работ, совершающиеся в живых организмах.
Работа - это мера превращения энергии из одной формы в другую. Численно работа равна изменению энергии. Химическая работа - работа, совершаемая при синтезе высокомолекулярных соединений из низкомолекулярных, а также при протекании химических реакций.Механическая работа - работа по перемещению частей и органов тела против механических сил. Механическая работа также совершается мышцами при их сокращении.Осмотическая работа - работа по переносу различных веществ через мембраны или мембранную оболочку из области низкой концентрации этих веществ в область более высокой концентрации. Перенос осуществляется механизмами активного транспорта против сил диффузии и требует затраты энергии
|
|
|
Электрическая работа - это работа по переносу заряженных частиц (ионов) в электрическом поле. В организме электрическая работа совершается при генерировании клетками биопотенциалов и проведении возбуждения по клеткам. Равна изменению энергии.
Биоэнергетика живого организма (роль АТФ в энергетических превращениях, характеристические реакции).
Всем клеткам для выполнения их работы необходима энергия и для всех клеток любого организма источником этой энергии служит АТФ. Поэтому АТФ называют «универсальным носителем энергии» или «энергетической валютой» клеток. За счет энергии АТФ происходит мышечное сокращение и выполняется механическая работа.
|
|
|
Значение АТФ
При расщеплении АТФ на АДФ и неорганический фосфат (Фн) высвобождается энергия:

Реакция идет с поглощением воды, т. е. представляет собой. Отщепившаяся от АТФ третья фосфатная группа остается в клетке в виде неорганического фосфата (Фн). Выход свободной энергии при этой реакции составляет 30,6 кДж на 1 моль АТФ.
Из АДФ и фосфата может быть вновь синтезирован АТФ, но для этого требуется затратить 30,6 кДж энергии на 1 моль вновь образованного АТФ.

В этой реакции, называемой реакцией конденсации, вода выделяется. Присоединение фосфата к АДФ называется реакцией фосфорилирования. Оба приведенных выше уравнения можно объединить:

Катализирует данную обратимую реакцию фермент, называемый АТФазой.
6. Сформулировать и записать закон Гесса (примеры).
Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с ее поглощением (Q < 0; ΔH > 0) - к эндотермическим.
|
|
|
Закон Гесса. Тепловой эффект реакции, протекающей при постоянном давлении или постоянном объеме не зависит от пути протекания реакции и определяется только природой и состоянием исходных веществ и конечных продуктов.
Рассмотрим процесс получения оксида углерода (IV) из графита:
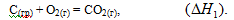
Эту же реакцию можно осуществить в две стадии через образование оксида углерода (II):
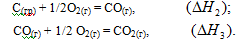
Эти реакции можно представить следующей схемой:
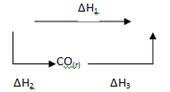
В соответствии с законом Гесса можно записать:
ΔН1 = ΔН2 + ΔН3 или ΔН1 - ΔН2 - ΔН3 = 0.
7. Рассмотреть в общем и на примерах энергетический баланс организма (ввести понятие первичной и вторичной теплоты для живых систем).
В живом организме на протяжении всей жизни происходит образование тепла (тепловой энергии). В настоящее время условно различают два вида тепла, продуцируемого организмом: первичную, или основную, теплоту и вторичную, или активную, теплоту. Первичная теплота- теплота, которая выделяется как результат неизбежного теплового рассеивания энергии в ходе обмена веществ из-за необратимо протекающих биохимических и биофизических процессов.
Теплота, в которую превращается энергия всех процессов в организме, называется вторичной теплотой. Основная часть вторичной теплоты образуется в результате мышечной деятельности.
Таким образом, первичная теплота — результат непосредственного теплового рассеивания энергии, а вторичная — итог перехода в теплоту той части энергии, которая вначале использовалась для совершения работы.
8. Ввести понятие об обратимом и необратимом процессах (определения, примеры).
Обратимым называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность. Примеры: незатухающее движение маятника, течение жидкости без трения и другие явления, часто рассматриваемые в физике. 2. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия , теплопроводность , вязкое течение .
Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы.
9. Что называется энтропией (определение, формула).
Энтропи́я —мера беспорядка системы. Энтропия-однозначная функция состояния системы,полный дифференциал которой равен отношению бесконечно малого кол-ва теплоты,сообщенного системе к абсолютной температуре,при которой эта теплопередача осуществляется.
 , где
, где  — приращение энтропии;
— приращение энтропии; 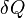 — минимальная теплота, подведённая к системе; T — абсолютная температура процесса.
— минимальная теплота, подведённая к системе; T — абсолютная температура процесса.
10. Записать первый закон термодинамики, используя понятие свободной и связанной энергии (формулы, определения).
ΔQ = ΔU + ΔA
Внутренняя энергия системы U равна сумме свободной (F) и связанной энергии (TS):
 . .
|
Следовательно, свободная энергия есть та работа, которую могло бы совершить тело в обратимом изотермическом процессе, или это максимальная возможная работа, которую может совершить система, обладая каким-то запасом внутренней энергии.Связанная энергия – та часть внутренней энергии, которая не может быть превращена в работу
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе, то есть, оно зависит только от начального и конечного состояния системы и не зависит от способа, которым осуществляется этот переход. Иными словами, внутренняя энергия является функцией состояния. В циклическом процессе внутренняя энергия не изменяется.

Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты 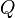 , сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества
, сообщённому системе, в сумме с изменением энергии, связанной с количеством вещества 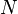 при химическом потенциале
при химическом потенциале 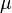 , и работы
, и работы  , совершённой над системой внешними силами и полями, за вычетом работы
, совершённой над системой внешними силами и полями, за вычетом работы 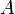 , совершённой самой системой против внешних сил
, совершённой самой системой против внешних сил
 .
.
Для элементарного количества теплоты 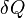 , элементарной работы
, элементарной работы  и малого приращения
и малого приращения 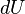 внутренней энергии первый закон термодинамики имеет вид:
внутренней энергии первый закон термодинамики имеет вид:
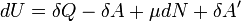 .
.
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая — работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Важно заметить, что 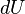 и
и  являются полными дифференциалами, а
являются полными дифференциалами, а  и
и 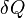 — нет.
— нет.
11. Сформулировать и записать второй закон термодинамики (для обратимых и необратимых процессов, примеры).
1.Любая изолированная система, представленная самой себе, изменяется в направлении состояния, обладающего максимальной вероятностью.
2.Энтропия изолированной системы возрастает в необратимом процессе и остаётся неизменной в обратимом.
Например, все виды энергии в организме превращаются в теплоту, которая уже не может быть использована для совершения работы и выводится из организма. Рассеивание энергии в тепло обусловлено тем, что тепло не может быть полностью превращено в другие виды энергии, которые, напротив, могут полностью переходить в тепло.
12. Рассмотреть энтропию как меру вероятности состояния системы (формула, формулировка).
Энтропия выражает меру неупорядоченности процесса. Система переходит из менее вероятного состояния в более вероятное. Характеризовать состояние системы удобнее не самой вероятностью, а величиной, пропорциональной ее логарифму. Эта величина и есть энтропия. S = K б* lnW ( S -энтропия, W -вероятность, K б-константа Больцмана(k = R\NA=1.38*10-23 )) Соотношение означает, что энтропия есть мера неупорядоченности системы: стремление энтропии к росту связано с тенденцией системы перейти в состояние с большей термодинамической вероятностью, т.е. менее упорядоченное.При обратимой химической реакции в состоянии равновесия она соответствует вероятному состоянию начальных веществ и продуктов реакции.
13. Термодинамические потенциалы (определение, виды, примеры, формулы).Термодинами́ческие потенциа́лы (термодинамические функции) — характеристические функции в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.Выделяют следующие термодинамические потенциалы:1) внутренняя энергия U(S,V), 2) энтальпия H(S,p) = U + pV, 3) энергия Гельмгольца F(T,V) = U - TS, 4) энергия Гиббса G(T,p) = H - TS = F + pV. Зависимость термодинамических потенциалов от их естественных переменных описывается основным уравнением термодинамики, которое объединяет первое и второе начала. Это уравнение можно записать в четырех эквивалентных формах: dU = TdS - pdV , dH = TdS + Vdp , dF = - pdV - SdT , dG = Vdp - SdT . Любой термодинамический потенциал в необратимых процессах при постоянстве естественных переменных уменьшается и достигает минимума при равновесии:
Дата добавления: 2021-07-19; просмотров: 164; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
