Работа, совершаемая идеальным газом при различных процессах
Если известна для некоторого обратимого процесса зависимость давления газа от объема, т.е. функция 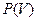 , то работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования:
, то работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования:
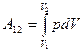 . (8.31)
. (8.31)
Здесь 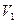 и
и  - объем газа в начальном и конечном состояниях.
- объем газа в начальном и конечном состояниях.
При изохорическом процессе  , т.е.
, т.е.  и
и  .
.
При изобарическом процессе  , поэтому
, поэтому
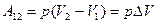 . (8.32)
. (8.32)
При изотермическом процессе 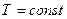 , учитывая, что
, учитывая, что  , получим
, получим
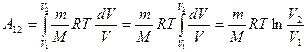 .
.
Учитывая, что 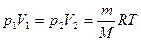 , работа идеального газа при изотермическом процессе равна
, работа идеального газа при изотермическом процессе равна
 или (8.33)
или (8.33)
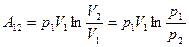 .
.
Работа, совершаемая при адиабатическом процессе, проще всего вычисляется из уравнения первого начала термодинамики, так как  . Тогда
. Тогда
 , (8.34)
, (8.34)
т.е. работа совершается за счет убыли внутренней энергии. Интегрирование уравнения (8.34) дает, что
 .
.
Подставив выражение (8.20) для 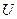 , найдем
, найдем
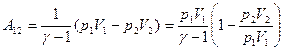 .
.
Напишем эту формулу в виде
 .
.
Для адиабатического процесса 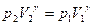 ,поэтому окончательно
,поэтому окончательно
 . (8.35)
. (8.35)
Учитывая, что 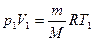 , получим еще одно выражение для работы
, получим еще одно выражение для работы
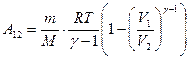 . (8.36)
. (8.36)
Подчеркнем, что работа газа при расширении положительна 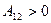 , а при сжатии отрицательна
, а при сжатии отрицательна  .
.
|
|
|
Классическая теория теплоемкости идеального газа
Молекулярно-кинетическая теория позволяет установить связь между теплоемкостью идеального газа и числом степеней свободы молекул. Ранее отмечалось, что молекулы идеального газа не взаимодействуют между собой. Поэтому внутреннюю энергию одного моля идеального газа можно найти, умножив среднюю энергию одной молекулы 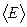 на постоянную Авогадро.
на постоянную Авогадро.
Согласно формуле (8.18)  . Следовательно,
. Следовательно,
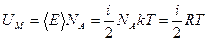 . (8.37)
. (8.37)
Сравнение выражений (8.12) и (8.37) дает для
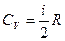 . (8.38)
. (8.38)
В соответствии с формулой (8.16)
 . (8.39)
. (8.39)
Отсюда следует, что постоянная адиабаты 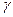 равна
равна
 . (8.40)
. (8.40)
Таким образом, значение 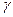 определяется числом и характером степеней свободы молекул идеального газа.
определяется числом и характером степеней свободы молекул идеального газа.
В таблице даны значения 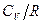 ,
,  и
и 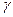 , вычисленные для различных молекул по формулам (8.38), (8.39), (8.40).
, вычисленные для различных молекул по формулам (8.38), (8.39), (8.40).
Таблица 1Теоретические значения теплоемкости идеального газа
|
|
|
| молекула | Число степеней свободы |
|
|
|
| ||
| посту-патель-ные | враща- тельные | колеба- тельные | |||||
| одноатомная | 3 | - | - | 3 | 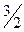
| 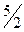
| 1,67 |
| двухатомная жесткая | 3 | 2 | - | 5 | 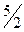
| 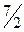
| 1,40 |
| двухатомная упругая | 3 | 2 | 1 | 7 | 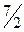
| 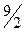
| 1,29 |
| трехатомная жесткая | 3 | 3 | - | 6 | 
| 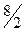
| 1,33 |
Развитая теория теплоемкости газов является приближенной и дает хорошие результаты лишь в ограниченном диапазоне температур. Эксперименты показывают, что теплоемкость газов зависит от температуры. На рис. 8.5 представлена зависимость теплоемкости двухатомного газа от температуры.
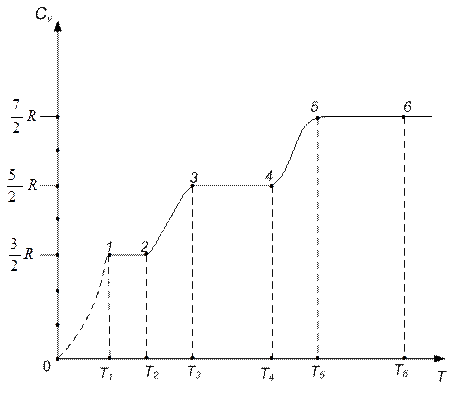
Рис. 8.5
Объяснение характера и причины зависимости теплоемкости газов от температуры дает квантовая механика. Согласно квантовой механике как энергия вращения молекул, так и энергия их колебаний, может изменяться только скачками, причем уровни вращательной энергии разделены энергетическими интервалами примерно на порядок меньшими, чем интервалы между уровнями колебательной энергии  .
.
На рис. 8.6 представлена схема энергетических уровней двухатомной молекулы: 1 – основной (т.е. самый низкий) колебательный уровень, 2 – первый возбужденный уровень. В промежутке между колебательными уровнями находятся вращательные уровни.
|
|
|
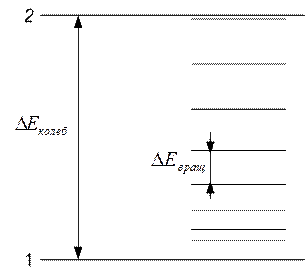
Рис. 8.6
Обсудим рис.8.5. При низких температурах 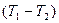 средняя энергия, приходящаяся на одну степень свободы молекулы, меньше первого разрешенного уровня вращательной энергии
средняя энергия, приходящаяся на одну степень свободы молекулы, меньше первого разрешенного уровня вращательной энергии 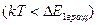 . Поэтому практически учитывается только поступательное движение (чему соответствует
. Поэтому практически учитывается только поступательное движение (чему соответствует 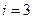 и
и 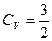 - участок 1-2).
- участок 1-2).
При повышении температуры и увеличении средней энергии молекулы вовлекаются во вращательное движение (участок 2-3). При температуре в интервале  все молекулы, кроме поступательного, совершают еще и вращательное движение:
все молекулы, кроме поступательного, совершают еще и вращательное движение:  и
и  (участок 3-4). Однако средняя энергия молекул ~
(участок 3-4). Однако средняя энергия молекул ~  все еще меньше, чем
все еще меньше, чем  (
(  ), и поэтому молекулы еще не совершают колебаний.
), и поэтому молекулы еще не совершают колебаний.
Молекулы вовлекаются в колебательное движение при дальнейшем повышении температуры (участок 4-5). При температурах (  ) все молекулы участвуют в колебательном движении и
) все молекулы участвуют в колебательном движении и  и
и 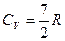 .
.
Задачи
Задача 1 Идеальный двухатомный газ, находившийся первоначально при температуре 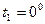 С, подвергается сжатию, в результате чего объем газа уменьшается в 10 раз. Считая процесс сжатия адиабатическим, определить, до какой температуры
С, подвергается сжатию, в результате чего объем газа уменьшается в 10 раз. Считая процесс сжатия адиабатическим, определить, до какой температуры  нагревается газ.
нагревается газ.
|
|
|
Решение
Уравнение адиабаты в переменных 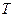 и
и 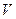 имеет вид
имеет вид 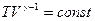 . Следовательно,
. Следовательно,
 , откуда
, откуда
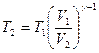 .
.
Для двухатомного газа 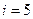 и постоянная адиабаты
и постоянная адиабаты 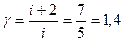 .
.
Подстановка числовых значений дает 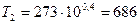 К или
К или  С.
С.
Задача 2 Идеальный газ расширяется изотермически от объема 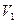 = 0,1 м3 до объема
= 0,1 м3 до объема  = 0,3 м3. Конечное давление газа
= 0,3 м3. Конечное давление газа  Па. Определить: 1) приращение внутренней энергии газа
Па. Определить: 1) приращение внутренней энергии газа 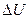 , 2) совершенную газом работу
, 2) совершенную газом работу 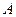 , 3) количество полученной газом теплоты
, 3) количество полученной газом теплоты 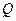 .
.
Решение
1. Внутренняя энергия идеального газа равна
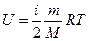
Так как процесс изотермический 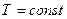 , то
, то 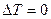 , поэтому
, поэтому 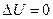 .
.
2. Работа, совершаемая идеальным газом при изотермическом процессе, определяется формулой
 .
.
Так как 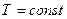 , то
, то 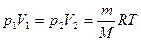 . Поэтому
. Поэтому
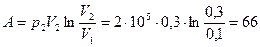 кДж
кДж
3. В соответствии с первым началом термодинамики 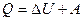 . Следовательно,
. Следовательно,
 кДж.
кДж.
Задача 3 Водород массой  = 6,5 г, находящийся при температуре 270 С, расширяется вдвое при
= 6,5 г, находящийся при температуре 270 С, расширяется вдвое при  за счет притока тепла извне. Найти:
за счет притока тепла извне. Найти:
1) работу расширения 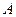 ;
;
2) изменение внутренней энергии газа 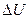 ;
;
3) количество тепла 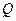 , сообщенное газу при расширении.
, сообщенное газу при расширении.
Решение
1) Водород 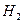 - двухатомный газ, поэтому
- двухатомный газ, поэтому 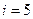 .
.
Работа расширения при  равна
равна
 .
.
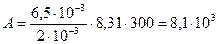 Дж.
Дж.
2) Изменение внутренней энергии

Учитывая, что 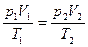 , получим
, получим
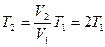 , так что
, так что 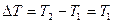 .
.
Таким образом,
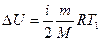
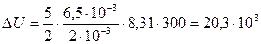 Дж.
Дж.
3) Количество тепла 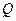 определим из первого начала термодинамики
определим из первого начала термодинамики
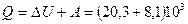 Дж =
Дж =  Дж.
Дж.
Задача 4 Кислород массой 2 кг занимает объем 1 м3 и находится под давлением  = 0,2 МПа. Сначала газ был нагрет при постоянном давлении до объема
= 0,2 МПа. Сначала газ был нагрет при постоянном давлении до объема  = 3 м3, а затем при постоянном объеме до давления
= 3 м3, а затем при постоянном объеме до давления 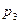 = 0,5 МПа. Найти изменение внутренней энергии газа
= 0,5 МПа. Найти изменение внутренней энергии газа 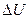 , совершенную им работу
, совершенную им работу 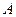 и теплоту
и теплоту 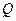 , переданную газу. Построить график процесса.
, переданную газу. Построить график процесса.
Решение
Изменение внутренней энергии газа
 .
.
Из уравнения Клапейрона – Менделеева найдем начальную  и конечную
и конечную  температуру газа
температуру газа

Работа расширения газа при постоянном давлении
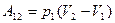
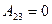 , т.к.
, т.к.  .
.
Полная работа
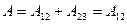 .
.
Теплота 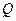 , переданная газу, определяется из первого начала термодинамики.
, переданная газу, определяется из первого начала термодинамики.
График процесса приведен на рис.8.7
Рис.8.7
Приведем вычисления, учитывая, что кислород  - двухатомный газ,
- двухатомный газ,  ,
,  .
.
 К
К
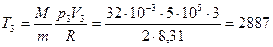 К
К
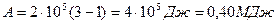


Задача 5 В цилиндре под поршнем находится водород массой  = 0,02 кг при температуре
= 0,02 кг при температуре 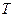 = 300 К. Водород сначала расширился адиабатически, увеличив свой объем в
= 300 К. Водород сначала расширился адиабатически, увеличив свой объем в  раз, а затем был сжат изотермически, причем объем газа уменьшился в
раз, а затем был сжат изотермически, причем объем газа уменьшился в 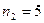 раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
раз. Найти температуру в конце адиабатического расширения и работу, совершенную газом при этих процессах. Изобразить процесс графически.
Решение
Изобразим график процесса (рис.8.8).
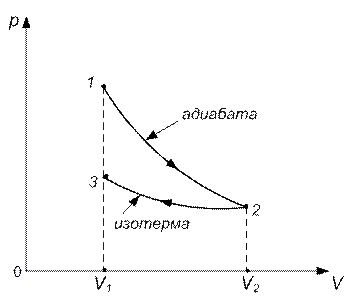
Рис.8.8
Температура и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением
 ,
,
или  ,
,
где 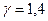 для водорода (
для водорода ( 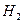 ),
), 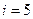 ;
;

Отсюда 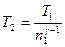 ;
; 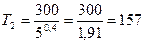 К.
К.
Работа 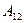 газа при адиабатическом расширении может быть определена по формуле
газа при адиабатическом расширении может быть определена по формуле
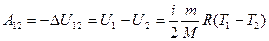 .
.
или
 Дж
Дж
Работа  газа при изотермическом процессе может быть выражена в виде
газа при изотермическом процессе может быть выражена в виде
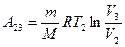 или
или 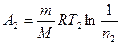 , где
, где 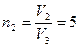 .
.
Произведем вычисления
 Дж
Дж
Знак минус показывает, что при сжатии работа совершается над газом внешними силами.
Задача 6Колебания В закрытом с обоих торцов горизонтальном цилиндре, заполненном идеальным газом с показателем адиабаты 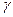 , находится поршень массы
, находится поршень массы  с площадью сечения
с площадью сечения 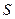 . В положении равновесия давление газа равно
. В положении равновесия давление газа равно  и поршень делит цилиндр на две одинаковые части, каждая объемом
и поршень делит цилиндр на две одинаковые части, каждая объемом  . Найти частоту
. Найти частоту 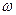 малых колебаний поршня около положения равновесия, считая процесс адиабатическим и трение ничтожно малым.
малых колебаний поршня около положения равновесия, считая процесс адиабатическим и трение ничтожно малым.
Решение
Запишем основное уравнение динамики для случая, когда поршень находится, например, справа от положения равновесия на расстоянии 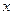 (рис.8.9):
(рис.8.9):

Рис.8.9
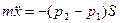 . (1)
. (1)
Из условия 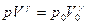 следует, что
следует, что
 ,
,
где принято во внимание, что
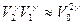 , т.к.
, т.к. 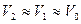 .
.
Теперь учтем, что
 ,
,
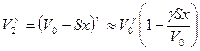 .
.
Тогда
 .
.
Подстановка этого выражения в исходное уравнение (1) дает
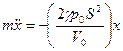 .
.
Мы пришли к уравнению гармонических колебаний  , из которого следует, что искомая частота
, из которого следует, что искомая частота
 .
.
Тесты
1. Внутренняя энергия 1 моля инертного газа равна:
(1)  ; (2)
; (2) 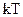 ; (3)
; (3) 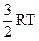 ; (4)
; (4) 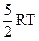 ; (5)
; (5) 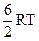 .
.
2. Работа 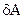 , совершаемая газом за малое время
, совершаемая газом за малое время 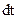 , равна:
, равна:
(1) произведению давления на время его действия 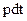 ; (2) произведению давления на изменение объема
; (2) произведению давления на изменение объема 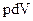 ; (3) произведению давления на объем и на время действия давления
; (3) произведению давления на объем и на время действия давления  ; (4) произведению изменения объема на время изменения
; (4) произведению изменения объема на время изменения 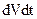 ; (5) произведению температуры на изменение объема
; (5) произведению температуры на изменение объема  .
.
3. Показатель политропы при изохорическом процессе равен:
(1) 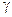 ; (3)
; (3)  ; (3)
; (3)  ; (4) 0; (5)
; (4) 0; (5)  . Здесь
. Здесь 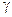 – коэффициент Пуассона;
– коэффициент Пуассона;  – удельная теплоемкость при постоянном давлении;
– удельная теплоемкость при постоянном давлении;  – универсальная газовая постоянная.
– универсальная газовая постоянная.
4. Каково соотношение между полученным количеством теплоты Q и работой A, совершаемой идеальным газом при изотермическом расширении?
(1) Q=A; (2) Q>A; (3) Q<A; (4) Q=0, A>0; (5) Q=0, A<0.
5. Молярная теплоемкость определяется формулой:
(1)  ; (2)
; (2)  ; (3)
; (3) 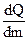 ; (4)
; (4)  ; (5)
; (5) 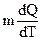 .
.
6. От каких физических величин не зависит внутренняя энергия тела?
(1) от средней скорости теплового движения молекул в теле; (2) от количества молекул в теле; (3) от температуры и массы тела; (4) от высоты тела над поверхностью Земли и от его скорости.
7. Молярные теплоемкости гелия в процессах 1–2 и 1–3 равны С1 и С2 соответственно. Тогда  составляет…
составляет…
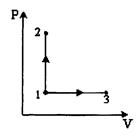 Рис.8.10
Рис.8.10
(1) 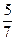 ; (2)
; (2) 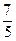 ; (3)
; (3) 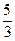 ; (4)
; (4) 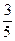 .
.
8. На рисунке 8.11 схематически представлена температурная зависимость молярной теплоемкости Cv от температуры T для двухатомного газа. Молекула газа ведет себя как система, обладающая тремя поступательными, двумя вращательными и колебательной степенями свободы, на участке…

Рис.8.11
(1) 1 – 1'; (2) 2 – 2'; (3) 3 – 3'.
9. Теплоемкость при постоянном давлении равна:
(1) 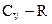 ; (2)
; (2) 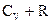 ; (3)
; (3) 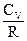 ; (4)
; (4) 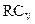 ; (5)
; (5) 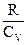 .
.
10. Показатель политропы при адиабатном процессе равен:
(1)  ; (2)
; (2)  ; (3)
; (3)  ; (4)
; (4)  ; (5)
; (5) 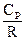 .
.
11. Чему равно изменение внутренней энергии  тела, если ему передано количество теплоты
тела, если ему передано количество теплоты 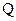 и внешние силы совершили над ним работу
и внешние силы совершили над ним работу  ?
?
(1) 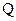 ; (2)
; (2)  ; (3)
; (3) 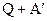 ; (4)
; (4)  ; (5)
; (5)  .
.
12. Газ адиабатно сжимается. Как изменяются при этом температура T и давление p газа?
(1) T и p увеличиваются; (2) T увеличивается, p уменьшается; (3) T уменьшается, p увеличивается; (4) T и p уменьшаются; (5) T и p не изменяются.
13. На (p, V)-диаграмме (рис.8.12) изображены два циклических процесса. Отношение работ, совершенных в каждом цикле, AI/AII равно:

Рис.8.12
(1) 0,5; (2) 2; (3) (–0,5); (4) (–2).
14. Средняя кинетическая энергия молекулы идеального газа при температуре  равна
равна  . Здесь
. Здесь  , где
, где 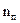 ,
, 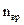 и
и 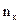 – число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для азота N2 число
– число степеней свободы поступательного, вращательного и колебательного движений молекулы. Для азота N2 число 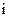 равно:
равно:
(1) 1; (2) 7; (3) 3; (4) 5; (5) 6.
15. Показатель политропы при изотермическом процессе равен:
(1) единице (1); (2) нулю (0); (3) бесконечности (∞);(4) половине числа степеней свободы ( i /2); (5) универсальной газовой постоянной R .
16. Выражение pdV (p – давление, dV – изменение объема) в термодинамике может быть представлено как:
(1) приращение импульса; (2) импульс тела; (3) мощность газового потока; (4) полную работу газа; (5) элементарную работу газа.
17. Внутренняя энергия 2 молей идеального одноатомного газа равна 5000 Дж. В результате изотермического расширения газ совершил работу 1000 Дж. Внутренняя энергия газа после расширения равна:
(1) 3000 Дж; (2) 4000 Дж; (3) 5000 Дж; (4) 6000 Дж; (5) 7000 Дж.
18. Циклический процесс состоит из изотермы, изобары и изохоры. Определите знак работы, совершаемой системой в каждом из процессов.
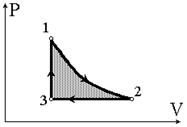
Рис.8.13
(1) A12 = 0, A23 < 0, A31 > 0; (2) A12 > 0, A23 < 0, A31 < 0; (3) A12 > 0, A23 = 0, A31 < 0; (4) A12 < 0, A23 < 0, A31 = 0; (5) A12 > 0, A23 < 0, A31 = 0.
19. Показатель политропы при изобарическом процессе равен:
(1) нуль (0); (2) единице (1); (3) теплоемкости при постоянном давлении Cp ; (4) бесконечности; (5).– универсальной газовой постоянной R .
20. Работу, совершаемую газом при его расширении от объема  до
до 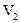 можно вычислить по формуле:
можно вычислить по формуле:
(1) 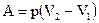 ; (2)
; (2)  ; (3)
; (3) 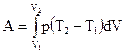 ; (4)
; (4) 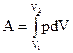 ; (5)
; (5) 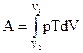 .
.
21. Работа идеального газаравна нулюпри…
(1) адиабатическом процессе; (2) изотермическом процессе; (3) циклическом процессе; (4) изохорическом процессе; (5) изобарическом процессе.
22. Если воздух – идеальный газ, и связь между атомами имеет жесткий характер, то молярная теплоемкость воздуха при постоянном объеме 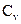 равна:
равна:
(1) 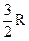 ; (2)
; (2) 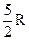 ; (3)
; (3) 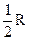 ; (4)
; (4)  ; (5)
; (5)  .
.
23. На рисунке 8.11 схематически представлена температурная зависимость молярной теплоемкости Cv от температуры T для двухатомного газа. На участке 3 – 3' молекула ведет себя как система, обладающая…
(1) тремя поступательными, двумя вращательными и колебательной степенями свободы; (2) тремя поступательными и двумя вращательными степенями свободы; (3) только тремя поступательными степенями свободы.
24. Определите показатель адиабаты g = CP/CV для гелия.
(1) 5/2; (2) 3/2; (3) 4/3; (4) 7/5; (5) 5/3.
25. Укажите, какие изопроцессы представлены на графике (U – внутренняя энергия, V – объем).

Рис.8.14
(1) 1-изобара, 2-изохора, 3-изотерма; (2) 1-изохора, 2-изобара, 3-изотерма; (3) 1-изобара, 2-изотерма, 3-изохора; (4) 1-изотерма, 2-изохора, 3-изобара; (5) 1-изохора, 2-изотерма, 3-изобара.
26. Площадь какой из отмеченных фигур соответствует работе, совершаемой идеальным газом в процессе 1 – 2?

Рис.8.15
(1) А; (2) В; (3) С; (4) D ; (5) Е.
27. В какой строке представлены: уравнения адиабаты, изотермы, Менделеева-Клапейрона?
(1) PV = const, P = nkT, P 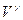 = const; (2) P
= const; (2) P 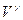 = const, PV = const, PV = mRT/ m ; (3) P
= const, PV = const, PV = mRT/ m ; (3) P 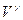 = const,
= const,  ,
, 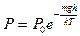 ; (4) P = nkT,
; (4) P = nkT,  , PV = mRT/ m ; (5) P/
, PV = mRT/ m ; (5) P/ 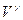 = const, P/V = const, P = nkT.
= const, P/V = const, P = nkT.
Дата добавления: 2021-03-18; просмотров: 470; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!



