Внутренняя энергия и теплоемкость идеального газа
Модуль 1.8
ГЛАВА 8 Первое начало термодинамики
Внутренняя энергия термодинамической системы
Внутренняя энергия 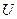 какого-либо тела слагается из кинетической энергии поступательного и вращательного движения молекул, кинетической и потенциальной энергий колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии (т.е. энергии электронных оболочек атомов и внутриядерной энергии). Кинетическая энергия тела как целого и его потенциальная энергия во внешнем силовом поле во внутреннюю энергию тела не входят.
какого-либо тела слагается из кинетической энергии поступательного и вращательного движения молекул, кинетической и потенциальной энергий колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии (т.е. энергии электронных оболочек атомов и внутриядерной энергии). Кинетическая энергия тела как целого и его потенциальная энергия во внешнем силовом поле во внутреннюю энергию тела не входят.
Внутренняя энергия является функцией состояния системы. Это означает, что она не зависит от того, каким путем мы привели систему в данное состояние. При изменении состояния приращение внутренней энергии 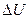 определяется только конечным
определяется только конечным  и начальным
и начальным 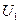 значением внутренней энергии
значением внутренней энергии 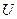 и не зависит от процесса, который перевел систему из одного состояния в другое.
и не зависит от процесса, который перевел систему из одного состояния в другое.
Работа, совершаемая газом при изменении его объема
Рассмотрим газ, находящийся в цилиндре, закрытом поршнем (рис 8.1).

Рис.8.1
Элементарная работа, совершаемая газом при перемещении поршня на  , равна
, равна
 , где
, где  - сила, с которой газ действует на поршень сечением
- сила, с которой газ действует на поршень сечением 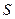 . Отсюда
. Отсюда
 , (8.1)
, (8.1)
где  .
.
При поднятии поршня давление газа может уменьшаться. Поэтому работа, совершаемая газом при изменении объема от 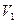 до
до  , должна быть представлена в виде интеграла:
, должна быть представлена в виде интеграла:
|
|
|
 (8.2)
(8.2)
Мы знаем, что геометрическая интерпретация интеграла (8.2) – это площадь под кривой  (рис.8.2),а эта площадь зависит от вида кривой 1-2, т.е. от процесса.
(рис.8.2),а эта площадь зависит от вида кривой 1-2, т.е. от процесса.

Рис.8.2
Если в результате изменений система возвращается в исходное состояние, то говорят, что она совершила круговой процесс или цикл. На диаграмме  такой процесс имеет вид замкнутой кривой (рис.8.3). Работа, совершаемая системой за цикл, численно равна площади внутри цикла
такой процесс имеет вид замкнутой кривой (рис.8.3). Работа, совершаемая системой за цикл, численно равна площади внутри цикла  , взятой со знаком плюс, если обход по кривой совершается по часовой стрелке, и со знаком минус, если – против часовой стрелки.
, взятой со знаком плюс, если обход по кривой совершается по часовой стрелке, и со знаком минус, если – против часовой стрелки.
Знак работы зависит от знака  : на тех участках процесса, где
: на тех участках процесса, где 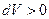 , работа
, работа  , на тех же участках, где
, на тех же участках, где  , тогда
, тогда  .
.

Рис.8.3
Из рис.8.3 следует, что  , причем
, причем 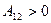 . Работа
. Работа  , т.е.
, т.е.  . Таким образом, работа за цикл равна
. Таким образом, работа за цикл равна  , т.е. численно равна площади цикла. При обратном направлении цикла знаки работ изменяются на обратные.
, т.е. численно равна площади цикла. При обратном направлении цикла знаки работ изменяются на обратные.
Первое начало термодинамики
|
|
|
Изменение внутренней энергии может происходить за счет двух различных процессов: совершения над телом работы внешними силами  и передачи ему теплоты
и передачи ему теплоты 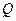 . Работу, совершаемую данным телом (газом) над внешними телами будем обозначать буквой
. Работу, совершаемую данным телом (газом) над внешними телами будем обозначать буквой 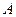 . Будем иметь в виду, что
. Будем иметь в виду, что  .
.
Совершение работы сопровождается перемещением внешних тел, действующих на систему (так, например, ведет себя поршень в цилиндре с газом).
Теплота 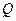 определяет количество энергии, переданное от одного тела другому посредством теплопередачи.
определяет количество энергии, переданное от одного тела другому посредством теплопередачи.
Первое начало термодинамики формулируется следующим образом: количество теплоты 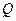 , сообщенное системе, идет на приращение
, сообщенное системе, идет на приращение 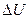 ее внутренней энергии и на совершение системой работы
ее внутренней энергии и на совершение системой работы 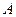 над внешними телами.
над внешними телами.
Уравнение имеет вид:
 , (8.3)
, (8.3)
где  .
.
Все входящие в (8.3) величины являются алгебраическими, т.е. могут иметь как положительные, так и отрицательные знаки.
Если  , то это значит, что тепло отводится от системы, если
, то это значит, что тепло отводится от системы, если  , то работа производится над системой. Приращение
, то работа производится над системой. Приращение 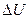 внутренней энергии может иметь любой знак, в частности быть равной нулю.
внутренней энергии может иметь любой знак, в частности быть равной нулю.
Подчеркнем, что можно говорить о приращении внутренней энергии 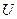 , но нельзя говорить о приращении работы или теплоты. Говорят только о количестве
, но нельзя говорить о приращении работы или теплоты. Говорят только о количестве 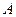 и
и 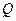 в том или ином процессе, т.е.
в том или ином процессе, т.е. 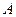 и
и 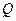 являются функциями процесса.
являются функциями процесса.
|
|
|
Первое начало термодинамики в дифференциальной форме имеет вид
 , (8.4)
, (8.4)
где  - элементарное количество теплоты,
- элементарное количество теплоты, 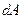 - элементарная работа,
- элементарная работа,  - бесконечно малое приращение внутренней энергии.
- бесконечно малое приращение внутренней энергии.
С учетом (8.1) это уравнение можно записать в виде
 (8.5)
(8.5)
В такой форме этот закон наиболее удобно использовать для решения задач.
Внутренняя энергия и теплоемкость идеального газа
Теплоемкостью  тела (газа) называют количество теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин:
тела (газа) называют количество теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин:
 , (8.6)
, (8.6)
 .
.
Эта величина, как и  зависит от процесса. Без указания процесса выражение (8.6) не имеет смысла. Еще раз: теплоемкость
зависит от процесса. Без указания процесса выражение (8.6) не имеет смысла. Еще раз: теплоемкость  является функцией процесса.
является функцией процесса.
Теплоемкость единицы массы вещества называется удельной теплоемкостью:
 , (8.7)
, (8.7)
|
|
|
 .
.
Мы будем пользоваться в основном молярной теплоемкостью – теплоемкостью одного моля вещества  , которая равна
, которая равна
 , (8.8)
, (8.8)
 . Здесь
. Здесь  - количество вещества или число молей,
- количество вещества или число молей,  - молярная масса.
- молярная масса.
Удельная и молярная теплоемкости связаны соотношением
 . (8.9)
. (8.9)
Особое значение имеют теплоемкости для двух процессов: при постоянном объеме  и при постоянном давлении
и при постоянном давлении  . При постоянном объеме
. При постоянном объеме  , и согласно (8.4) имеем
, и согласно (8.4) имеем
 (
(  ). (8.10)
). (8.10)
В термодинамике подобные выражения принято записывать в виде
 . (8.11)
. (8.11)
Символ производной, снабженный индексом 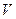 , указывает на то, что при дифференцировании функции
, указывает на то, что при дифференцировании функции  по
по 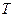 объем
объем 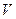 следует считать постоянным.
следует считать постоянным.
Опыт показывает, что во многих случаях теплоемкость  в широком интервале температур почти не меняется. Если считать, что
в широком интервале температур почти не меняется. Если считать, что  совсем не зависит от
совсем не зависит от 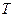 , то из (8.11) следует, что
, то из (8.11) следует, что
 .
.
Проинтегрировав это соотношение, получим выражение для внутренней энергии моля идеального газа
 . (8.12)
. (8.12)
Внутренняя энергия массы газа  будет равна
будет равна
 . (8.13)
. (8.13)
Напишем уравнение (8.5) для моля газа, предположив, что теплота сообщается газу при постоянном давлении:
 , (8.14)
, (8.14)
где  - объем моля.
- объем моля.
Молярная теплоемкость при постоянном давлении равна:
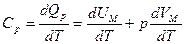 (
(  ).
).
Согласно формуле (8.11),  (
(  ).
).
Учтя это и использовав применяемый в термодинамике способ записи формул, придем к соотношению:
 . (8.15)
. (8.15)
Если процесс изобарический (  ), то из уравнения состояния
), то из уравнения состояния  следует, что
следует, что  .
.
Подстановка этого значения производной в (8.15) приводит к соотношению
 . (8.16)
. (8.16)
Отсюда следует физический смысл универсальной газовой постоянной  :
:  равна работе, совершаемой молем идеального газа при повышении его температуры на один кельвин при постоянном давлении.
равна работе, совершаемой молем идеального газа при повышении его температуры на один кельвин при постоянном давлении.
Подчеркнем, что соотношение (8.16) справедливо только для идеального газа.
Отношение теплоемкостей
 (8.17)
(8.17)
называют постоянной адиабаты – это важная характеристика газов.
Имея в виду (8.16), запишем
 ,
,
отсюда молярная теплоемкость
 . (8.18)
. (8.18)
Подставив это выражение для  в (8.13), получим для внутренней энергии моля идеального газа формулу
в (8.13), получим для внутренней энергии моля идеального газа формулу
 . (8.19)
. (8.19)
Для внутренней энергии  молей газа
молей газа
 (8.20)
(8.20)
Дата добавления: 2021-03-18; просмотров: 133; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
