Давление газа на стенку сосуда
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
Модуль 1.7
ГЛАВА 7 Молекулярно-кинетическая теория
Состояние термодинамической системы. Процесс
Термодинамической системой называется совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой.
Термодинамическая система может находиться в различных состояниях, отличающихся температурой 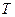 , давлением
, давлением 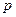 , объемом
, объемом 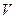 , плотностью
, плотностью 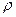 . Подобные величины, характеризующие состояние системы, называются параметрами состояния.
. Подобные величины, характеризующие состояние системы, называются параметрами состояния.
Состояние, в котором хотя бы один из параметров не имеет определенного значения, называется неравновесным.
Состояние термодинамической системы будет равновесным, если все параметры состояния  имеют определенные значения, не изменяющиеся с течением времени.
имеют определенные значения, не изменяющиеся с течением времени.
Термодинамические системы, которые не обмениваются с внешней средой ни энергией, ни веществом, называются изолированными (или замкнутыми).
Если систему, находящуюся в неравновесном состоянии, предоставить самой себе, то она перейдет в равновесное состояние. Такой переход называется процессом релаксации или просто релаксацией (латинское слово relaxatio означает уменьшение напряжения, ослабление). Время, за которое первоначальное отклонение какой-либо величины от равновесного значения уменьшается в  раз, называется временем релаксации.
раз, называется временем релаксации.
Термодинамическим процессом называется переход системы из одного состояния в другое. Любой процесс происходит благодаря внешнему воздействию и проходит через последовательность неравновесных состояний. Но если такое воздействие осуществляется достаточно медленно, то можно сказать, что процесс проходит через последовательность равновесных состояний. Такой процесс называют равновесным или квазистатическим. Он может быть изображен, например, на диаграмме 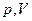 соответствующей кривой (рис.7.1). Направление процесса показывают стрелкой.
соответствующей кривой (рис.7.1). Направление процесса показывают стрелкой.
|
|
|

Рис. 7.1
Неравновесные процессы мы будем изображать штриховой линией (рис.7.1). Равновесный процесс может быть проведен в обратном направлении через ту же совокупность равновесных состояний, т.е. по той же сплошной кривой  (рис.7.1), но в обратном направлении
(рис.7.1), но в обратном направлении  . По этой причине равновесные процессы называют обратимыми.
. По этой причине равновесные процессы называют обратимыми.
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым. Обратимый цикл изображается на координатной плоскости замкнутой кривой.
Уравнение состояния идеального газа
Соотношение, определяющее связь между параметрами состояния какого-либо тела, называется уравнением состояния этого тела.
|
|
|
В простейшем случае равновесное состояние тела определяется значениями трех параметров: давления 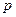 , объема
, объема 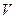 и температуры
и температуры 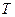 . Установим связь между этими тремя параметрами
. Установим связь между этими тремя параметрами
Вначале остановимся на понятии температуры. В технике и быту используется температура, отсчитанная по шкале Цельсия. Единица этой шкалы называется градусом Цельсия (0С). В физике пользуются термодинамической температурой, которая более удобна и имеет глубокий физической смысл. Далее мы установим, что термодинамическая температура определяется средней кинетической энергией, приходящейся на одну молекулу газа. Единица термодинамической температуры – кельвин (К) является одной из основных единиц СИ, причем 10С = 1К. Термодинамическая температура 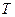 по шкале Кельвина, связана с температурой
по шкале Кельвина, связана с температурой 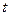 по шкале Цельсия соотношением
по шкале Цельсия соотношением
 (К). (7.1)
(К). (7.1)
Температура, равная 0 К, называется абсолютным нулем температуры, ему соответствует 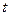 = -273,150 С. Температуре
= -273,150 С. Температуре 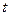 = 00 С соответствует
= 00 С соответствует 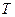 = 273,15 К.
= 273,15 К.
Опытным путем было установлено, что при обычных условиях (т.е.при комнатной температуре и атмосферном давлении) параметры состояния таких газов, как кислород и азот, довольно хорошо подчиняются уравнению
|
|
|
 , (7.2)
, (7.2)
где 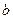 - константа, пропорциональная массе газа. Оказалось также, что чем разреженнее газ (чем меньше его плотность), тем точнее выполняется это уравнение.
- константа, пропорциональная массе газа. Оказалось также, что чем разреженнее газ (чем меньше его плотность), тем точнее выполняется это уравнение.
У разреженных газов молекулы практически не взаимодействуют друг с другом. Они лишь иногда сталкиваются друг с другом. Однако эти столкновения происходят настолько редко, что большую часть времени молекулы движутся свободно.
Идеальным называется газ, в котором можно пренебречь взаимодействием между молекулами. Такой газ строго подчиняется уравнению (7.2), которое, следовательно, является уравнением состояния идеального газа.
Одна из основных единиц СИ является единица количества вещества, называемая молем. Моль – это количество вещества, в котором содержится число частиц (атомов, молекул, ионов и т.д.), равное числу атомов в 12 г изотопа углерода 12С.
Число частиц, содержащееся в моле вещества, называется постоянной Авогадро:
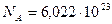 моль-1. (7.3)
моль-1. (7.3)
Следовательно, в одном моле железа содержится  атомов железа, в одном моле воды содержится
атомов железа, в одном моле воды содержится  молекул воды, в одном моле электронов содержится
молекул воды, в одном моле электронов содержится  электронов и т.д.
электронов и т.д.
|
|
|
Массу моля обозначают буквой  и называют молярной массой. Она равна
и называют молярной массой. Она равна
 , (7.4)
, (7.4)
где  - масса молекулы,
- масса молекулы, 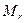 - относительная молекулярная масса молекулы,
- относительная молекулярная масса молекулы,  кг = 1 а.е.м. – атомная единица массы.
кг = 1 а.е.м. – атомная единица массы.
Таким образом,
 .
.
Это означает, что молярная масса, выраженная в граммах на моль, численно равна относительной молекулярной массе.
Согласно закону Авогадро при нормальных условиях, т.е. при  = 0 0С или
= 0 0С или
 = 273,15 К и давлении
= 273,15 К и давлении  = 1 атм = 1,013·105 Па, объем моля любого газа равен
= 1 атм = 1,013·105 Па, объем моля любого газа равен  = 22,4 л/моль = 22,4·10-3 м3/моль. Отсюда следует, что константа
= 22,4 л/моль = 22,4·10-3 м3/моль. Отсюда следует, что константа 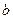 (в уравнении 7.2) будет одинаковой для всех газов. Обозначив константу
(в уравнении 7.2) будет одинаковой для всех газов. Обозначив константу 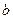 для одного моля буквой
для одного моля буквой  , напишем уравнение состояния идеального газа следующим образом:
, напишем уравнение состояния идеального газа следующим образом:
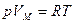 , (7.5)
, (7.5)
где  - молярный объем (объем одного моля газа).
- молярный объем (объем одного моля газа).
Константа  называется универсальной газовой постоянной. Согласно закону Авагадро
называется универсальной газовой постоянной. Согласно закону Авагадро
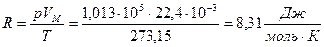 (7.6)
(7.6)
Чтобы получить уравнение состояния для произвольной массы  идеального газа, умножим обе части уравнения на число молей
идеального газа, умножим обе части уравнения на число молей 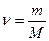 , которое называется количеством вещества
, которое называется количеством вещества
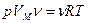 .
.
Учитывая, что объем газа  , мы приходим к уравнению:
, мы приходим к уравнению:
 или
или  . (7.7)
. (7.7)
Это есть уравнение состояния идеального газа, его называют уравнением Клапейрона – Менделеева.
Умножим и разделим правую часть уравнения (7.7) на постоянную Авагадро  :
:
 .
.
Здесь  - число молекул, содержащихся в массе
- число молекул, содержащихся в массе  газа.
газа.
Величина
 (7.8)
(7.8)
называется постоянной Больцмана.
В результате получим
 (7.9)
(7.9)
Разделим обе части уравнения на объем газа 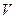 , обозначим
, обозначим  , тогда
, тогда
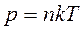 (7.10)
(7.10)
где  - концентрация молекул.
- концентрация молекул.
Уравнения (7.7), (7.9) и (7.10) представляют собой различные формы уравнения состояния идеального газа.
Давление газа на стенку сосуда
При своем движении молекулы газа ударяют о стенку сосуда, создавая тем самым давление газа на стенку. Вычислим это давление. При этом будем использовать статистический метод, интересуясь движением не отдельных молекул, а лишь такими средними величинами, которые характеризуют движение колоссальной совокупности молекул.
Первый шаг на этом пути – выбор модели данной макросистемы.
Простейшей моделью обладает идеальный газ. Будем считать, что
1. молекулы идеального газа не взаимодействуют друг с другом,
2. в равновесном состоянии движение молекул полностью хаотично. Это позволяет в грубом приближении считать, что все молекулы движутся только в направлениях  , т.е. если в единице объема имеется
, т.е. если в единице объема имеется  молекул, то в каждом из этих направлений движутся по
молекул, то в каждом из этих направлений движутся по  молекул или
молекул или  в одну сторону.
в одну сторону.
Рассчитаем число ударов молекул о стенку. Разобьем молекулы в каждой единице объема на группы  , в каждой из которых скорости молекул можно считать одинаковыми и равными
, в каждой из которых скорости молекул можно считать одинаковыми и равными  , так что
, так что  - полное число молекул в единице объема.
- полное число молекул в единице объема.
Число  молекул
молекул 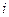 -ой группы, которые достигают за малый промежуток времени
-ой группы, которые достигают за малый промежуток времени  элемента стенки площадью
элемента стенки площадью  , двигаясь перпендикулярно к нему, равно числу таких молекул в цилиндре длиной
, двигаясь перпендикулярно к нему, равно числу таких молекул в цилиндре длиной  и сечением
и сечением  (рис.7.2) , то есть
(рис.7.2) , то есть
 .
.
. 
Рис. 7.2
Отсюда следует, что число ударов в единицу времени о единицу поверхности стенки
 , или
, или
 . (7.11)
. (7.11)
Суммируя по всем группам, находим
 .
.
Разделим и умножим последнюю сумму на  . В результате приходим к тому, что полное число ударов молекул о единицу поверхности стенки за единицу времени равно
. В результате приходим к тому, что полное число ударов молекул о единицу поверхности стенки за единицу времени равно
 , (7.12)
, (7.12)
где  - среднее значение скорости молекул.
- среднее значение скорости молекул.
Оценим число 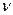 для воздуха при нормальных условиях. Считая, что
для воздуха при нормальных условиях. Считая, что  ~ 1019 см-3 и
~ 1019 см-3 и  ~ 1 км/с, получим
~ 1 км/с, получим
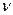 ~ 1019·105 = 1024 с-1см-2 .
~ 1019·105 = 1024 с-1см-2 .
А теперь определим давление газа на стенку. Для простоты будем считать, что каждая молекула, налетая на стенку нормально, в результате столкновения с ней отлетает в противоположном направлении. До столкновения со стенкой молекула имела импульс  и после столкновения – импульс
и после столкновения – импульс  .
.
Приращение импульса молекулы в результате столкновения
 .
.
Такой же импульс, но в противоположном направлении, получила стенка согласно закону сохранения импульса.
Импульс, передаваемый в единицу времени единице поверхности стенки молекулами 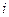 -й группы, найдем с помощью (7.11):
-й группы, найдем с помощью (7.11):
 .
.
Результирующее давление получим, просуммировав по всем группам  молекул:
молекул:
 .
.
Разделив и умножив последнюю сумму в этой формуле на  , приходим к выражению:
, приходим к выражению:
 , (7.13)
, (7.13)
где  - среднее значение квадрата скорости молекул.
- среднее значение квадрата скорости молекул.
Выражение (7.13) можно переписать иначе:
 , (7.14)
, (7.14)
где  - средняя энергия поступательного движения молекулы.
- средняя энергия поступательного движения молекулы.
Формулу (7.14) называют основным уравнением кинетической теории газов. Она раскрывает физический смысл макропараметра 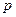 : давление газа на стенку определяется средним значением поступательной кинетической энергии молекул.
: давление газа на стенку определяется средним значением поступательной кинетической энергии молекул.
Дата добавления: 2021-03-18; просмотров: 135; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
