Уравнение Фрейндлиха как уравнение для аналитического выражения изотермы адсорбции.
12. Адсорбция растворѐнного в жидкости вещества на твѐрдом адсорбенте, молекулярная адсорбция и ионная адсорбция.
Различают молекулярную и ионную адсорбцию.
Молекулярная адсорбция – это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твёрдого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворённым веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворённого вещества его молекулы должны вытеснять с поверхности молекулы растворителя.
Экспериментально величину адсорбции «а» изучают измеряя молярную концентрацию раствора до контакта с адсорбентом (с0) и после наступления адсорбционного равновесия (сs):
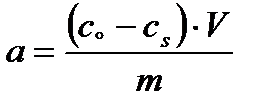 моль/г,
моль/г,
а – количество адсорбированного вещества, приходящееся на 1 г адсорбента; m – масса адсорбента, г: V – объём раствора, из которого идёт адсорбция, л.
На молекулярную адсорбцию влияют:
· равновесная концентрация растворённого вещества;
· природа растворителя;
· природа адсорбента;
· природа растворённого вещества;
· температура, время адсорбции.
Ионная адсорбция – это адсорбция из растворов сильных электролитов; в этом случае адсорбируется растворённое вещество на поверхности твёрдого адсорбента в виде ионов.
Ионная адсорбция – процесс более сложный, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворённого вещества и молекулы растворителя.
|
|
|
Особенности ионной адсорбции:
· Адсорбируются заряженные частицы (ионы), а не молекулы.
· Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией.
· Адсорбция сопровождается образованием двойного электрического слоя (ДЭС).
· Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково.
· В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима.
· Для ионной адсорбции характерно явление обменной адсорбции.
13. Молекулярная адсорбция на твѐрдом адсорбенте, факторы, влияющие на неѐ.
Различают молекулярную и ионную адсорбцию.
Молекулярная адсорбция – это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твёрдого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворённым веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворённого вещества его молекулы должны вытеснять с поверхности молекулы растворителя.
|
|
|
Экспериментально величину адсорбции «а» изучают измеряя молярную концентрацию раствора до контакта с адсорбентом (с0) и после наступления адсорбционного равновесия (сs):
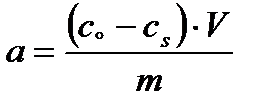 моль/г,
моль/г,
а – количество адсорбированного вещества, приходящееся на 1 г адсорбента; m – масса адсорбента, г: V – объём раствора, из которого идёт адсорбция, л.
На молекулярную адсорбцию влияют:
· равновесная концентрация растворённого вещества;
· природа растворителя;
· природа адсорбента;
· природа растворённого вещества;
· температура, время адсорбции.
14. Ионная адсорбция на твѐрдом адсорбенте, еѐ особенности.
Ионная адсорбция – это адсорбция из растворов сильных электролитов; в этом случае адсорбируется растворённое вещество на поверхности твёрдого адсорбента в виде ионов.(процесс более сложный, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворённого вещества и молекулы растворителя.)
Особенности ионной адсорбции:
· Адсорбируются заряженные частицы (ионы), а не молекулы.
· Адсорбция происходит только на полярных адсорбентах, поэтому её часто называют полярной адсорбцией.
· Адсорбция сопровождается образованием двойного электрического слоя (ДЭС).
|
|
|
· Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково.
· В основе ионной адсорбции лежат химические силы, и она чаще всего кинетически необратима.
· Для ионной адсорбции характерно явление обменной адсорбции.
Факторы, влияющие на ионную адсорбцию: химическая природа адсорбента, химическая природа ионов (лиотропные ряды Гофмейстера, влияние заряда иона на адсорбцию, правило Панетта – Фаянса).
Дата добавления: 2019-11-16; просмотров: 178; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
