Задание 8-1 контрольной работы
Задание 1 контрольной работы
Определите эквивалент Э, фактор эквивалентности f, число эквивалентности z и молярную массу эквивалента вещества, рассматривая его а) как кислоту, соль или основание (в зависимости от номера задания) и б) этого же вещества в конкретной реакции.
| № | Вещество | Реакция |
| 1 | ВаCl2 | ВаCl2 + H2SO4 → ВаSO4+ 2HCl |
| 2 | ВаCl2 | ВаCl2+ Na2SO4 → ВаSO4+ 2NaCl |
| 3 | Na2S | Na2S + НBr → 2NaBr + Н2S |
| 4 | H2S | H2S + 2NaOH→ Na2S + 2H2O |
| 5 | H2S | H2S + NaOH → NaHS + H2O |
| 6 | Na2CO3 | Na2CO3+ H2SO4 → Na2SO4+ H2O+CO2 |
| 7 | Na2CO3 | Na2CO3 + 2H2SO4 → 2NaНSO4+ H2O+CO2 |
| 8 | AgNO3 | AgNO3 + HCl → AgCl + HNO3 |
| 9 | NaOH | 2NaOH + H2S → Na2S + H2O |
| 10 | NaOH | NaOH + H2S → NaHS + H2O |
| 11 | ZnCl2 | ZnCl2+ NaOH → ZnClOH+ NaCl |
| 12 | ZnCl2 | ZnCl2+ 2NaOH → Zn(OH)2+ 2NaCl |
| 13 | AlCl3 | AlCl3+ NaOH → AlCl(OH)2+ NaCl |
| 14 | AlCl3 | AlCl3+ 2NaOH → AlCl2(OH) + 2NaCl |
| 15 | AlCl3 | AlCl3+ 3NaOH → Al(OH)3+ 3NaCl |
| 16 | AlCl3 | AlCl3+ 4NaOH → Na[Al(OH)4]+ 3NaCl |
| 17 | H2SO4 | H2SO4+Fe(OH)2 → Fe(HSO4)2+ H2O |
| 18 | H2SO4 | H2SO4+ Fe(OH)2 → FeSO4+ 2H2O |
| 19 | H2SO4 | H2SO4+Fe(OH)3 → Fe(HSO4)3+ H2O |
| 20 | KMnO4 | 2KMn+7O4+5Na2SO3+3H2SO4→2Mn+2SO4+K2SO4+5Na2SO4+3H2O |
| 21 | KMnO4 | 2KMn+7O4+3Na2SO3+H2O→2Mn+4O2+KOH+ 3Na2SO4 |
| 22 | KMnO4 | 2KMn+7O4+Na2SO3+2KOH → 2K2Mn+6O4+Na2SO4+H2O |
| 23 | FeCl3 | 5Fe+3Cl3+MnCl2+KCl+4H2O→5Fe+2Cl2+KMnO4+8HCl |
| 24 | K2Cr2O7 | K2Cr+62O7+6KI+7H2SO4→Cr+32(SO4)3+3I2+4K2SO4+7H2O |
| 25 | HCl | HCl + Ni(OH)2 → HCl + Ni(OH)2 |
| 26 | Na2CO3 | Na2CO3+ H2O → Na2CO3+ H2O |
| 27 | ZnCl2 | ZnCl2+ NaOH → ZnCl2+ NaOH |
| 28 | Na2CO3 | Na2CO3+СаCl2 → Na2CO3+СаCl2 |
| 29 | MnSO4 | 2MnSO4+5S+K2SO4+8H2O → 2KMnO4+5H2S+3H2SO4 |
| 30 | MnSO4 | MnSO4+ ВаCl2 → ВаSO4+ MnCl2 |
Задание 2 контрольной работы
Составьте уравнения цепочки реакций:
|
|
|
| Номер задания | Цепочки реакций |
| 1 | Fe(OH)3 → Fe2O3 → Fe → FeCl3 → FeOHCl2 |
| 2 | Fe → FeCl3 → FeOHCl2 → Fe2(SO4)3 → Fe(NO3)3 |
| 3 | P → P2O5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2 |
| 4 | Сu(OH)2 → CuO → Cu → CuSO4 → Cu2(OH)2 |
| 5 | Al2O3 → KAlO2 → Al(OH)3 → Al2(SO4)3→ ВаSO4 |
| 6 | Zn → Zn(НSO4)2 → ZnSO4 →Zn(OH)2 → Na2[Zn(OH)4] |
| 7 | Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3 → ZnO |
| 8 | CO2 → CaCO3 → CaCl2 → CaCO3 → CO2 |
| 9 | НCl → CaCl2 → Ca(OH)2 → CaCO3 → CO2 |
| 10 | Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2 |
| 11 | AlCl3 → AlOHCl2 → Al(OH)3 → Na[Al(OH)4] → Na3[Al(OH)6] |
| 12 | CaCl2 → Ca(OH)2 → CaCO3 → CO2 → CaCO3 |
| 13 | Fe(OH)3 → FeOHSO4 → Fe2(SO4)3 → Fe(HSO4)2 → Fe(OH)3 |
| 14 | CrCl3 → Cr(OH)3 → Na3[Cr(OH)6] → CrCl3 →AgCl |
| 15 | Al → NaAlO2 → HAlO2 → K[Al(OH)4] → Al2O3 |
| 16 | NaHCO3 → Na2CO3 → Na2O → Na2SO4 → NaOH |
| 17 | Ва(OH)2 → ВаCO3 → ВаO → ВаCl2 → ВаSO4 |
| 18 | NaOH→ Cr(OH)3 → Na3[Cr(OH)6] → Na2CrO4 → Na2Cr2O7 |
| 19 | Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2 |
| 20 | Fe → FeO → Fe(NO3)2 → FeSO4 → Fe(HSO4)2 |
| 21 | NH3 → NO → NO2 → HNO3 → KNO3 |
| 22 | CuSO4 → Cu → CuSO4→ Cu (OH)2 → CuO |
| 23 | B → B2O3 → H3BO3 → HBO2 → KBO2 |
| 24 | Cu → CuO → Cu (OH)2 → Na2[Cu(OH)4] → CuSO4 |
| 25 | CuSO4 → CuCl2 → CuOHCl → Cu(OH)2 →Na2[Cu(OH)4] |
| 26 | NH3 → NO → NO2 → HNO3 → H2SO4 |
| 27 | Na2CO3 → Na2SO4 → NaOH → Cr(OH)3 → CrOHSO4 |
| 28 | K2S → KHS → H2S → SO2 → H2SO3 |
| 29 | CuSO4 → [Cu (H2O)4]SO4·H2O → CuCl2 → CuOHCl → Cu(OH)2 |
| 30 | N2 → NH3 → NH4Cl → NH4OH → NH4NO3 |
Задание 3 контрольной работы
|
|
|
Для химического элемента: определить в какой группе и каком периоде Периодической таблицы находится, к какому семейству относится, записать электронную формулу для нормального и возбужденного состояния атома, перечислить валентные электроны и возможные степени окисления, привести примеры соединений элемента в этих степенях окисления.
| Номер задания | Химический элемент | Номер задания | Химический элемент | Номер задания | Химический элемент |
| 61 | 5B | 71 | 56Ba | 81 | 19K |
| 62 | 79Au | 72 | 32Ge | 82 | 82Pb |
| 63 | 56Ba | 73 | 105Db | 83 | 40Zr |
| 64 | 55Cs | 74 | 34Se | 84 | 39Y |
| 65 | 67Ho | 75 | 48Cd | 85 | 30Zn |
| 66 | 66Dy | 76 | 50Sn | 86 | 81Tl |
| 67 | 74W | 77 | 46Pd | 87 | 20Ca |
| 68 | 56Ba | 78 | 52Te | 88 | 103Lr |
| 69 | 16S | 79 | 44Ru | 89 | 84Po |
| 70 | 62Sm | 80 | 37Rb | 90 | 38Sr |
Задание 4 контрольной работы
Определить пространственную структуру молекулы, тип гибридизации центрального атома (если есть), число σ- и π-связей, полярность связей и полярность молекулы в целом.
| Вариант | Молекула | Вариант | Молекула | Вариант | Молекула |
| 91 | H2O | 101 | AsH3 | 111 | CO2 |
| 92 | PH3 | 102 | [PtСl4]2– | 112 | BeI2 |
| 93 | Cl2 | 103 | BeBr2 | 113 | SO2 |
| 94 | CO32– | 104 | SCl6 | 114 | H2Te |
| 95 | NH3 | 105 | N2 | 115 | HI |
| 96 | CF4 | 106 | SiH4 | 116 | I2 |
| 97 | C2H2 | 107 | BCl3 | 117 | [АlF6]33– |
| 98 | SiF4 | 108 | H2Se | 118 | CCl4 |
| 99 | OF2 | 109 | HBr | 119 | AlCl3 |
| 100 | TiCl4 | 110 | C2H4 | 120 | COCl2 |
|
|
|
Задание 5 контрольной работы
Напишите выражения скорости прямой и обратной реакций по закону действующих масс, выражение константы равновесия реакции. Определите порядок и молекулярность прямой реакции. Как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 2 раза, в сторону какой реакции при этом сместится (если сместится) химическое равновесие?
| № | Уравнение реакции | № | Уравнение реакции |
| 121 | H2 (г) + I2 (г) ⇄ 2HI | 136 | FeO (тв)+CO(г)⇄ Fe (тв)+CO2 (г) |
| 122 | Ba2+ (p) + SO42- ⇄ BaSO4 (тв) | 137 | H2 (г) + S (ж) ⇄ H2S (г) |
| 123 | CaO (тв)+CO2 (r)⇄CaCO3(тв) | 138 | Si (тв)+2H2O (r) ⇄ SiO2(тв)+2H2(г) |
| 124 | CO (г)+H2O(r) ⇄CO2(г)+H2(г) | 139 | 2NO (г) + H2 (г) ⇄ N2O (r) + H2O (r) |
| 125 | PCl5 (г) ⇄ PCl3 (r) + Cl2 (г) | 140 | 2H2(г) + O2 (г) = 2H2O(г) |
| 126 | 2SO2 (г) + O2 (г) = SO3 (г) | 141 | Cu2O(тв)+2HCl(г)⇄2CuCl(г)+H2O(г) |
| 127 | C2H2 (г) +H2 (г) ⇄ C2H4 (г) | 142 | C(тв) +CO2 (г) = 2CO(г) |
| 128 | 2NO2 (г) = N2O4 (г) | 143 | COCl2(г) = Cl2(г) + CO (г) |
| 129 | 2CO (г) + O2 (г) = 2CO2 (г) | 144 | S(тв) + 2CO2(г) = SO2(г) + 2CO(г) |
| 130 | SO2 (г) + Cl2 (г) = SO2Cl2 (г) | 145 | Fe2O3(тв)+3CO(г)=2Fe(тв)+3CO2(г) |
| 131 | 4HCl(г)+O2(г)=2Cl2(г)+2H2O(г) | 146 | Cu2S(тв)+2O2 = 2CuO(тв)+SO2(г) |
| 132 | C(тв)+H2O(г) = CO(г)+H2(г) | 147 | 2NO(г)+O2(г) = 2NO2(г) |
| 133 | Fe(тв)+H2S(г) = H2(г)+FeS(тв) | 148 | 2N2(г)+6H2(г) = 4NH3(г)+3O2(г) |
| 134 | N2(г)+3H2(г) = 2NH3(г) | 149 | 2CO(г)+2H2(г) = CH4(г)+CO2(г) |
| 135 | Fe2O4(тв)+H2(г)=3FeO(тв)+H2O(г) | 150 | H2(г)+Br2(г) = 2HBr(г) |
|
|
|
Задание 6 контрольной работы
Найдите массу соли, необходимую для приготовления раствора объемом V л с массовой долей 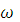 . Плотность раствора
. Плотность раствора 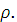 Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора.
| Вариант | Соль | V, л | 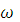 ,% ,%
| ρ, кг/м3 |
| 151 | AlCl3 | 0,5 | 6 | 1052 |
| 152 | AgNO3 | 1,5 | 8 | 1069 |
| 153 | AgNO3 | 0,8 | 6 | 1050 |
| 154 | Al2(SO4)3 | 0,8 | 6 | 1061 |
| 155 | Al2(SO4)3 | 1,5 | 4 | 1040 |
| 156 | BaCl2 | 3,0 | 4 | 1034 |
| 157 | BaCl2 | 0,3 | 2 | 1015 |
| 158 | CaCl2 | 0,5 | 12 | 1083 |
| 159 | CaCl2 | 0,9 | 4 | 1031 |
| 160 | CuSO4 | 2,5 | 8 | 1084 |
| 161 | CuSO4 | 0,65 | 2 | 1019 |
| 162 | FeCl3 | 0,9 | 12 | 1085 |
| 163 | FeCl3 | 1,7 | 6 | 1049 |
| 164 | FeSO4 | 1,5 | 4 | 1037 |
| 165 | FeSO4 | 3,5 | 8 | 1078 |
| 166 | K2CO3 | 2,0 | 12 | 1090 |
| 167 | K2CO3 | 0,6 | 2 | 1016 |
| 168 | K2Cr2O7 | 2,5 | 8 | 1055 |
| 169 | K2Cr2O7 | 0,4 | 6 | 1040 |
| 170 | K2SO4 | 3,0 | 6 | 1047 |
| 171 | K2SO4 | 1,2 | 12 | 1081 |
| 172 | MgSO4 | 4,0 | 4 | 1039 |
| 173 | MgSO4 | 1,6 | 6 | 1060 |
| 174 | Na2CO3 | 0,5 | 12 | 1102 |
| 175 | Na2CO3 | 3,5 | 2 | 1019 |
| 176 | Na2SO4 | 3,5 | 8 | 1072 |
| 177 | Na2SO4 | 1,7 | 6 | 1053 |
| 178 | Pb(NO3)2 | 1,5 | 6 | 1052 |
| 179 | Pb(NO3)2 | 2,5 | 8 | 1072 |
| 180 | Pb(NO3)2 | 0,5 | 12 | 1016 |
Задание 7 контрольной работы
Напишите уравнение электролитической диссоциации раствора слабой кислоты и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе, если известны константа диссоциации Кдисс. И нормальность Сн
| Вариант | Формула кислоты | Название кислоты | Сн,моль/л | Кдисс |
| 181 | HCOOH | Муравьиная | 0,005 | 1,8  10-4 10-4
|
| 182 | CH3COOH | Уксусная | 0,005 | 1,74  10-5 10-5
|
| 183 | HNO2 | Азотистая | 0,05 | 5,1  10-4 10-4
|
| 184 | C6H6COOH | Бензойная | 0,05 | 6,6  10-5 10-5
|
| 185 | HIO4 | Иодная | 0,005 | 2,8  10-2 10-2
|
| 186 | HIO3 | Иодноватая | 0,001 | 1,6  10-1 10-1
|
| 187 | HF | Плавиковая | 0,01 | 6,8  10-4 10-4
|
| 188 | HCN | Синильная | 0,1 | 6,2  10-10 10-10
|
| 189 | HBrO | Бромноватистая | 0,1 | 2,5  10-9 10-9
|
| 190 | C2H5COOH | Пропионовая | 0,01 | 1,35  10-5 10-5
|
| 191 | HCNS | Роданисто-водородная | 0,001 | 1,4  10-1 10-1
|
| 192 | C6H4(OH)COOH | Салициловая | 0,001 | 1,1  10-3 10-3
|
| 193 | HClO2 | Хлористая | 0,001 | 1,1  10-2 10-2
|
| 194 | HClO | Хлорноватистая | 0,05 | 5,0  10-8 10-8
|
| 195 | HCNO | Циановая | 0,01 | 3,5  10-4 10-4
|
| 196 | HCOOH | Муравьиная | 0,02 | 1,8  10-4 10-4
|
| 197 | CH3COOH | Уксусная | 0,01 | 1,74  10-5 10-5
|
| 198 | HNO2 | Азотистая | 0,01 | 5,1  10-4 10-4
|
| 199 | C6H5COOH | Бензойная | 0,01 | 6,6  10-5 10-5
|
| 200 | HIO4 | Йодная | 1,0 | 2,8  10-2 10-2
|
| 201 | HIO3 | Йодноватая | 2,0 | 1,6  10-1 10-1
|
| 202 | HF | Плавиковая | 0,05 | 6,8  10-4 10-4
|
| 203 | HCN | Синильная | 0,5 | 6,2  10-10 10-10
|
| 204 | HBrO | Бромноватистая | 0,5 | 2,5  10-9 10-9
|
| 205 | C2H5COOH | Пропионовая | 0,05 | 1,35  10-5 10-5
|
| 206 | HNO2 | Азотистая | 2,0 | 5,1  10-4 10-4
|
| 207 | C6H4(OH)COOH | Салициловая | 1,0 | 1,1  10-3 10-3
|
| 208 | HClO2 | Хлористая | 1,0 | 1,1  10-2 10-2
|
| 209 | HClO | Хлорноватистая | 0,1 | 5,0  10-5 10-5
|
| 210 | HCNO | Циановая | 0,05 | 3,5  10-4 10-4
|
Задание 8-1 контрольной работы
Рассчитайте концентрации ионов Н+ и ОН– и рН раствора сильной кислоты или сильного основания, V мл которого содержит m г кислоты или основания (  = 1).
= 1).
| Номер задания | Соеди-нение | V, мл | m, г | Номер задания | Соеди-нение | V, мл | m, г |
| 211 | HCl | 1000 | 1,46 | 226 | HI | 250 | 0,0256 |
| 212 | HCl | 500 | 0,365 | 227 | HBr | 1000 | 1,62 |
| 213 | HCl | 2000 | 0,73 | 228 | HBr | 500 | 0,81 |
| 214 | HCl | 250 | 0,365 | 229 | HBr | 250 | 0,81 |
| 215 | NaOH | 500 | 0,04 | 230 | HBr | 2000 | 0,162 |
| 216 | NaOH | 100 | 0,02 | 231 | NaOH | 500 | 0,2 |
| 217 | NaOH | 250 | 0,1 | 232 | NaOH | 250 | 0,4 |
| 218 | NaOH | 1000 | 0,40 | 233 | NaOH | 1000 | 0,8 |
| 219 | KOH | 1000 | 0,56 | 234 | NaOH | 1500 | 6,0 |
| 220 | KOH | 500 | 0,112 | 235 | KOH | 1500 | 8,4 |
| 221 | KOH | 250 | 0,112 | 236 | KOH | 500 | 2,8 |
| 222 | KOH | 2000 | 1,12 | 237 | KOH | 750 | 1,68 |
| 223 | HI | 2000 | 2,56 | 238 | KOH | 1000 | 0,28 |
| 224 | HI | 1000 | 0,256 | 239 | HCl | 500 | 1,46 |
| 225 | HI | 500 | 1,28 | 240 | HCl | 250 | 0,73 |
Дата добавления: 2019-11-16; просмотров: 186; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
