Термохимические расчеты. Закон Гесса
| Энтальпии реакций, протекающих при постоянном давлении или при постоянном объеме, не зависят от пути протекания процесса (то есть от характера и числа промежуточных стадий), а определяются лишь начальным и конечным состояниями системы. |
Проиллюстрировать закон Гесса можно на примере реакции образования оксида углерода (IV):
C(к) + O2(г) = CO2(г), 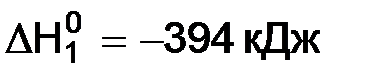 .
.
Эта же реакция может осуществляться другим путем, с образованием промежуточного продукта – оксида углерода (II):
С(к) + 1/2O2(г) = СO(г), 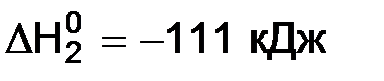 ;
;
СО(г) + 1/2O2(г) = СО2(г), 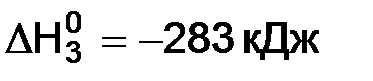 .
.
Схема химических реакций

С(к) СО2(к)
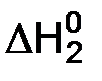
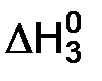
СO(г)
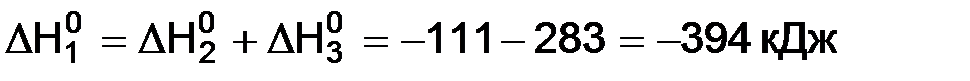 .
.
Энтальпия реакции, протекающей разными путями, одинакова.
При проведении термохимических расчетов пользуются следствиями закона Гесса.
| Следствие 1. Энтальпия реакции равна разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов. |
Стандартная энтальпия реакции
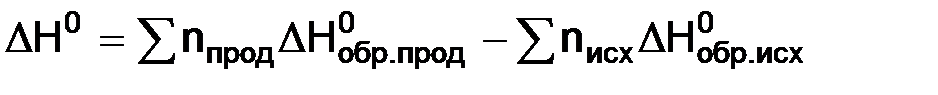 ,
,
где 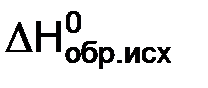 ,
, 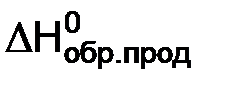 – стандартные энтальпии образования исходных веществ и продуктов реакции;
– стандартные энтальпии образования исходных веществ и продуктов реакции;
nпрод., nисх – стехиометрические коэффициенты
(коэффициенты в уравнении реакции).
Таким образом, стандартную энтальпию любой реакции можно рассчитать по имеющимся в таблицах термодинамических величин стандартным энтальпиям образования веществ.
| Следствие 2. Энтальпия прямой реакции равна по модулю и противоположна по знаку энтальпии обратной реакции. |
К примеру, термохимическое уравнение реакции разложения карбоната кальция
|
|
|
СаСO3(к) = CaO(к) + CO2(г), DH0 = 178 кДж.
Обратной реакции соответствует термохимическое уравнение
CaO(к) + CO2(г) = СаСO3(к), DH0 = ‑178 кДж.
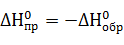
Задача. Рассчитайте количество теплоты, выделяющейся (или поглощающейся) при гашении 1 кг извести в стандартных условиях.
Решение
Уравнение реакции гашения извести:
CaO(т) + Н2О(ж) = Са(ОН)2(т).
Из справочной таблицы выписываем стандартные энтальпии образования веществ.
| Вещество | DH0обр , кДж/моль |
| CaO(т) Н2О(ж) Са(ОН)2(т) | –635 –286 –987 |
Тепловой эффект реакции равен энтальпии реакции, значение которой находим по первому следствию закона Гесса:
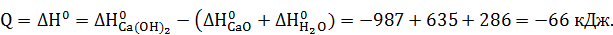
Энтальпия реакции отрицательна, т.е. при гашении извести теплота выделяется. Количество теплоты соответствует гашению 1 моль СаО. Рассчитываем количество вещества, содержащееся в 1 кг оксида кальция:
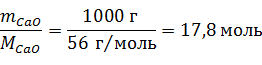
Количество теплоты, выделяющейся при гашении 1 кг извести,
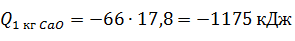
Дата добавления: 2019-09-13; просмотров: 222; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
