Основы термохимии. Термохимические уравнения
Основная литература
1. Коровин Н.В. Общая химия: Учебник. 2014. – 496 с.
2. Сидоров В.И. и др. Общая химия. 2014.– 440 с.
3. А.Б. Никольский, А.В. Суворов. Химия. 2017. – 507 с.
Электронная библиотечная система biblio-online.ru
4. Антропова О.А., Вайтнер В.В., Печёрских Е.Г. Химия: учебно-метод. пособие. Изд-во Урал. ун-та, 2018. – 119 с.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ.
Основные понятия химической термодинамики
Химическая термодинамика – дисциплина, которая изучает энергетические эффекты, сопровождающие различные химические и физические процессы.
Объектами изучения химической термодинамики являются разнообразные системы.
| Система – вещество или совокупность веществ, находящихся во взаимодействии, реально или мысленно обособленных от внешней среды. |
| Фаза – совокупность всех однородных по составу и свойствам частей системы, отделенная от остальных частей системы поверхностью раздела. |
Пример однофазной системы – лед; двухфазной – кипящая вода (жидкая и газообразная фазы); трехфазной – насыщенный водный раствор соли (кристаллическая соль, водный раствор соли и пары воды над раствором).
Систему, состоящую из нескольких фаз, называют гетерогенной, однофазную систему –гомогенной.
По характеру взаимодействия с внешней средой выделяют три типа систем:
v открытая– система, для которой возможен обмен веществом и энергией с внешней средой;
v закрытая – система, для которой исключен обмен веществом и возможен обмен энергией с внешней средой;
|
|
|
v изолированная – система, для которой исключен обмен веществом и энергией с внешней средой.
Самый распространенный тип систем – открытые. Примеры: сосуд с кипящей водой, горящая спичка и т.п. Примером закрытой системы является запаянный сосуд с взаимодействующими веществами. Изолированные системы в природе не существуют. Воображаемые изолированные системы используют в науке для различных теоретических построений.
Внутренняя энергия. Первое начало термодинамики
Внутренняя энергия ( U ) – сумма кинетической энергии движения и потенциальной энергии взаимодействия структурных единиц (молекул, атомов, ядер, электронов и др.) в системе.
Внутренняя энергия системы зависит от ее природы, агрегатного состояния и массы образующих систему веществ, температуры. Единица измерения – кДж.
Определение абсолютного значения внутренней энергии системы невозможно. В ходе химических реакций происходит изменение внутренней энергии системы. Его можно определить, пользуясь первым началом термодинамики.
Изменение внутренней энергии закрытой системы определяется количеством переданной теплоты и совершенной работой.
|
|
|
Соответствующее математическое выражение:
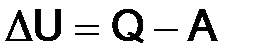 ,
,
где Q – количество переданной теплоты;
A – совершенная работа.
Работу, совершаемую системой над внешней средой, считают положительной, а совершаемую над системой – отрицательной. Теплоту, полученную системой, считают положительной, а отданную системой во внешнюю среду – отрицательной.
| Внешняя среда |
| ‑А |
| -Q |
| +А |
| Система |
| +Q |
| Система |
Схема взаимодействия системы с внешней средой
Тепловые эффекты химических реакций. Энтальпия
В ходе химической реакции за счет изменения внутренней энергии может выделяться или поглощаться теплота и совершаться работа.
Количество теплоты, которое выделяется или поглощается в результате химической реакции, называют ее тепловым эффектом.
Единица измерения тепловых эффектов – кДж.
В соответствии с первым началом термодинамики
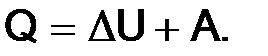
В большинстве химических реакций
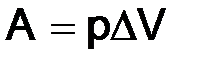 ,
,
где ∆V – изменение объема системы.
Тогда количество теплоты
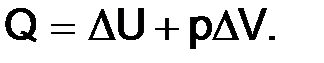
Для процессов, протекающих при постоянном давлении (изобарных),

Условно будем считать, что при химической реакции система переходит из состояния 1 в состояние 2, т. е.
|
|
|
DU = U2 – U1, DV = V2 – V1,
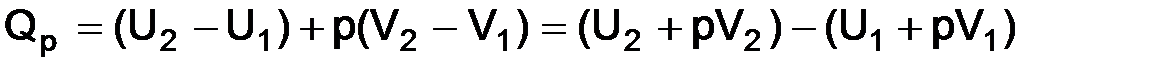
В термодинамике введена функция, которую называют энтальпией и обозначают H. Эта функция имеет только математическое определение.

Таким образом,
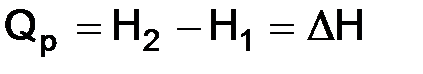 .
.
Тепловой эффект реакции при постоянном давлении (Qp) равен изменению энтальпии.
Большинство химических реакций проходит в условиях постоянства давления, тепловые эффекты выражают величиной DH, которую называют энтальпией химической реакции.
Основы термохимии. Термохимические уравнения
Термохимия – раздел химической термодинамики, изучающий тепловые эффекты химических реакций.
В соответствии с тепловыми эффектами реакции можно разделить на две группы:
v экзотермические – идут с выделением теплоты (DH < 0);
v эндотермические – идут с поглощением теплоты (DH > 0).
Уравнения химических реакций, записанные с указанием значения энтальпии DH (кДж) и агрегатного состояния участвующих в реакции веществ, называют термохимическими уравнениями.Агрегатные состояния веществ обозначают подстрочными индексами: т – твердое или к – кристаллическое, ж – жидкое, г – газообразное, р – раствор.
Значение DH зависит от природы и агрегатного состояния веществ, участвующих в реакции, температуры, давления. Как правило, значение энтальпии химической реакции указывают для стандартных условий.
|
|
|
| Стандартные условия: участвующие в реакции вещества чистые, температура 298 К, парциальные давления газов или атмосферное давление, если газы не участвуют в реакции, 1,013∙105 Па, концентрация частиц для реакций в растворах 1 моль/л. |
Стандартные термодинамические величины, определенные для стандартного состояния вещества, отмечают надстрочным индексом "0", т.е. DH0 - стандартная энтальпия реакции.
Примеры термохимических уравнений:
эндотермическая реакция CaCO3(к) = CaO(к) + CO2(г), DH0 = 178 кДж;
экзотермическая реакция N2(г) + 3H2(г) = 2NH3(г), DH0 = ‑ 92 кДж.
В справочных таблицах термодинамических величин приводят не энтальпии конкретных реакций, а стандартные энтальпии образования веществ.
Энтальпией образования вещества называют энтальпию реакции образования 1 моль данного вещества из простых веществ, устойчивых в стандартных условиях.
Из определения следует, что энтальпии образования простых веществ равны нолю. В обозначении энтальпии образования вещества, как правило, указывают его формулу, например 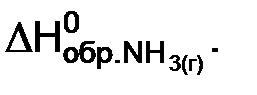 В дальнейшем индекс “обр” записывать не будем:
В дальнейшем индекс “обр” записывать не будем: 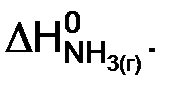
Используя справочные значения энтальпий образования веществ, можно рассчитать энтальпию любой химической реакции. Основой таких расчетов служит закон Гесса.
Дата добавления: 2019-09-13; просмотров: 129; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
