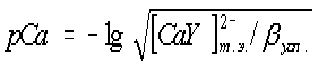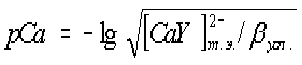Расчет значения рCа в точке эквивалентности при построении кривой титрования хлорида кальция комплексоном III проводят по формуле
| c)
| 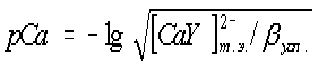
|
| Вопрос №1138
|
Расчет значения рCа до точки эквивалентности при построении кривой титрования хлорида кальция комплексоном III проводят по формуле
| b)
| pCa = – lgC(CaCl 2 ), ост.
|
| Вопрос №1139
|
Расчет значения рCа до начала титрования при построении кривой титрования хлорида кальция комплексоном III проводят по формуле
| b)
| pCa = – lgC(CaCl2), исх.
|
| Вопрос №1140
|
Расчет значения рCа после точки эквивалентности при построении кривой титрования хлорида кальция комплексоном III проводят по формуле
| b)
| 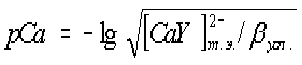
|
| Вопрос №1141
|
На кривой титрования сульфата магния комплексоном (III)
| d)
| 1 линия эквивалентности и 1 скачок титрования
|
На кривой титрования сульфата магния комплексоном (III) точка эквивалентности
| b)
| делит скачок титрования пополам
|
На величину скачка титрования на комплексонометрической кривой влияют
| c)
| все перечисленное
|
| Вопрос №1144
|
Комплекса с комплексоном III не образует
2,5 г МgSO4·7H2O растворили в мерной колбе вместимостью 500 мл. Титр полученного раствора равен
Молярная концентрация сульфата магния в растворе 1 М. Молярная концентрация эквивалента (N) сульфата магния в этом же растворе равна
Навеску сульфата цинка массой 0,2500 г растворили в воде и оттитровали 16,00 мл раствора комплексона III с Т (к.III/ZnSO4·7H2O)=0,01500 г/мл. Рассчитайте массовую долю в % ZnSO4·7H2O в образце.
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 200 мл, а 15,00 мл полученного раствора оттитровали 17,00 мл раствора комплексона III с Т (к.III/CaCl2)=0,006000 г/мл. Рассчитайте массу хлорида кальция в анализируемом растворе.
Навеску сульфата меди (II) массой 0,2000 г растворили в воде и оттитровали 15,00 мл раствора комплексона III с Т (к.III/CuSO4·5H2O)=0,01250 г/мл. Рассчитайте массовую долю в % CuSO4·5H2O в образце.
Навеску хлорида кобальта растворили и довели до метки в мерной колбе вместимостью 250 мл, а 20,00 мл полученного раствора оттитровали 10,5 мл раствора комплексона III с Т (к.III/CоCl2)=0,006400 г/мл. Рассчитайте массу хлорида кобальта в анализируемом растворе.
Навеску сульфата железа (II) массой 0,2000 г растворили в воде и оттитровали 12,00 мл раствора комплексона III с Т (к.III/FeSO4·7H2O)=0,01400 г/мл. Рассчитайте массовую долю в % FeSO4·7H2O в образце.
Навеску хлорида кадмия растворили и довели до метки в мерной колбе вместимостью 100 мл, а 20,00 мл полученного раствора оттитровали 25,00 мл раствора комплексона III с Т (к.III/CdCl2)=0,009000 г/мл. Рассчитайте массу хлорида кадмия в анализируемом растворе.
Навеску сульфата марганца (II) массой 0,1400 г растворили в воде и оттитровали 17,00 мл раствора комплексона III с Т (к.III/MnSO4)=0,007700 г/мл. Рассчитайте массовую долю в % MnSO4 в образце.
Навеску хлорида магния растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 11,25 мл раствора комплексона III с Т (к.III/MgCl2)=0,005000 г/мл. Рассчитайте массу хлорида магния в анализируемом растворе.
Навеску сульфата магния массой 0,08000 г растворили в воде и оттитровали 12,00 мл раствора комплексона III с Т (к.III/MgSO4)=0,006000 г/мл. Рассчитайте массовую долю в % MgSO4 в образце.
Навеску сульфата цинка массой 0,2000 г растворили в воде и оттитровали 20,00 мл раствора комплексона III с Т (к.III/ZnSO4)=0,008000 г/мл. Рассчитайте массовую долю в % ZnSO4 в образце.
Навеску нитрата свинца растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 22,00 мл раствора комплексона III с Т (к.III/Pb(NO3)2)=0,01600 г/мл. Рассчитайте массу нитрата свинца в анализируемом растворе.
Навеску хлорида цинка растворили и довели до метки в мерной колбе вместимостью 200 мл, а 15,00 мл полученного раствора оттитровали 10,00 мл раствора комплексона III с Т (к.III/ZnCl2)=0,006000 г/мл. Рассчитайте массу хлорида цинка в анализируемом растворе.
Навеску сульфата железа (II) массой 1,5000 г растворили в воде и довели до метки в мерной колбе вместимостью 100 мл, а 15,00 мл полученного раствора оттитровали 12,75 мл раствора комплексона III с Т (к.III/FeSO4·7H2O)=0,01500 г/мл. Рассчитайте массовую долю в % FeSO4·7H2O в образце.
Навеску хлорида кобальта растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 11,50 мл раствора комплексона III с Т (к.III/CоCl2)=0,007500 г/мл. Рассчитайте массу хлорида кобальта в анализируемом растворе.
Навеску сульфата меди (II) массой 0,2500 г растворили в воде и оттитровали 20,50 мл раствора комплексона III с Т (к.III/CuSO4·5H2O) = 0,01200 г/мл. Рассчитайте массовую долю в % CuSO4·5H2O в образце.
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 20,00 мл раствора комплексона III с Т (к.III/CaCl2) = 0,006000 г/мл. Рассчитайте массу хлорида кальция в анализируемом растворе.
К раствору соли алюминия прибавили 15,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 6,50 мл 0,09000 н. раствора сульфата магния. Рассчитайте массу алюминия (А) в анализируемом растворе. Известно, что М (Al)=27 г/моль.
Навеску ацетата свинца массой 0,3000 г растворили в воде; к полученному раствору прибавили 30,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 12,00 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М (Pb(CH3COO)2)=325,00 г/моль.
К раствору соли железа (III) прибавили 20,00 мл 0,09000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу железа (А) в анализируемом растворе. Известно, что М (Fe)=56 г/моль.
Навеску карбоната натрия массой 0,04000 г растворили в воде; к полученному раствору прибавили 20,00 мл 0,05000 н. раствора сульфата магния, а на титрование избытка сульфата магния затратили 9,00 мл раствора комплексона III. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массовую долю в % Na2CO3 (А) в образце. Известно, что М (Na2CO3)=106 г/моль.
К раствору соли никеля (II) прибавили 20,00 мл 0,09500 н. раствора комплексона III, а на титрование избытка комплексона III затратили 10,55 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу никеля (А) в анализируемом растворе. Известно, что М (Ni) = 59 г/моль.
Навеску ацетата ртути (II) массой 0,2000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 13,50 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Hg(CH3COO)2 (А) в образце. Известно, что М (Hg(CH3COO)2) = 319 г/моль.
К раствору соли висмута (III) прибавили 25,00 мл 0,08500 н. раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу висмута (А) в анализируемом растворе. Известно, что М (Bi)=209 г/моль.
Навеску карбоната калия массой 0,05000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,05000 н. раствора сульфата магния, а на титрование избытка сульфата магния затратили 16,00 мл раствора комплексона III. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массовую долю в % К2CO3 (А) в образце. Известно, что М (К2CO3)=138 г/моль.
К раствору соли олова (II) прибавили 30,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 17,00 мл 0,09000 н. раствора сульфата цинка. Рассчитайте массу олова (А) в анализируемом растворе. Известно, что М (Sn)=119 г/моль.
К раствору соли хрома (III) прибавили 20,00 мл раствора комплексона III (К=0,9500 к 0,1 н. раствору), а на титрование избытка комплексона III затратили 8,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу хрома (А) в анализируемом растворе. Известно, что М (Cr)=51,00 г/моль.
Навеску соли алюминия массой 0,1000 г растворили в воде; к полученному раствору прибавили 25,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 14,80 мл 0,1000 н. раствора MgSO4. Рассчитайте массовую долю в % Al2(SO4)3 (А) в образце. Известно, что М (Al2(SO4)3)=342,15 г/моль.
Навеску нитрата висмута (III) массой 0,1800 г растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III, а на титрование избытка комплексона III затратили 12,00 мл 0,1000 н. раствора MgSO4. 1,00 мл раствора сульфата магния эквивалентен 0,95 мл раствора комплексона III. Рассчитайте массовую долю в % Bi(NO3)3 (А) в образце. Известно, что М (Bi(NO3)3)=394,00 г/моль.
К раствору хлорида алюминия AlCl3 прибавили 25,00 мл 0,09800 н. раствора комплексона III, а на титрование избытка комплексона III затратили 16,50 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу хлорида алюминия (А) в анализируемом растворе. Известно, что М (AlCl3)=133 г/моль.
Навеску ацетата свинца массой 0,2000 г растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III (К=1,1000 к 0,1 н. раствору), а на титрование избытка комплексона III затратили 10,60 мл 0,1000 н. раствора ZnSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М ( Pb(CH3COO)2)=325 г/моль.
Навеску нитрата свинца растворили в воде; к полученному раствору прибавили 20,00 мл раствора комплексона III, а на титрование избытка комплексона III затратили 11,50 мл 0,1000 н. раствора MgSO4. 1,00 мл раствора сульфата магния эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массу Pb(NO3)2 (А) в анализируемом растворе. Известно, что М (Pb(NO3)2)=331 г/моль.
Навеску хлорида олова (II) массой 0,1000 г растворили в воде; к полученному раствору прибавили 30,00 мл 0,1100 н. раствора комплексона III, а на титрование избытка комплексона III затратили 24,00 мл 0,1000 н. раствора сульфата цинка. Рассчитайте массовую долю в % хлорида олова (А) в образце. Известно, что М (SnCl2) = 190 г/моль.
Навеску хлорида кальция растворили и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 9,00 мл раствора AgNO3 (К=1,1000 к 0,1 н. раствору). Рассчитайте массу хлорида кальция (А) в анализируемом растворе. Известно, что М (CaCl2)=111 г/моль.
Навеску бромида калия массой 0,3500 г растворили в воде. К полученному раствору прибавили 30,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 5,00 мл раствора KNCS (К=0,9000 к 0,1 н. раствору). Рассчитайте массовую долю в % бромида калия (А) в образце. Известно, что М (KBr)=119,00 г/моль.
Навеску х.ч. NaCl массой 0,5850 г растворили и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 0,05000 н. раствором AgNO3. Рассчитайте объём раствора AgNO3 (А), пошедший на титрование. Известно, что М (NaCl)=58,5 г/моль.
К раствору хлорида аммония прибавили 25,00 мл 0,1800 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 18,00 мл раствора NH4NCS с Т=0,01520 г/мл. Рассчитайте массу NH4Cl (А) в анализируемом растворе. Известно, что М (NH4Cl)=53,50 г/моль, а М (NH4NCS)=76 г/моль.
Навеску х. ч. хлорида калия массой 0,7000 г растворили и довели до метки в мерной колбе вместимостью 200 мл, а 14,90 мл полученного раствора оттитровали 14,00 мл раствора нитрата серебра. Рассчитайте титр раствора AgNO3 (А). Известно, что М (AgNO3)=170 г/моль, а М (KCl)=74,5 г/моль.
Навеску йодида калия массой 0,1800 г растворили в воде. К полученному раствору прибавили 20,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 11,50 мл 0,09000 н. раствора KNCS. Рассчитайте массовую долю в % KI (А) в образце. Известно, что М (KI)=166,00 г/моль.
Навеску бромида натрия растворили и довели до метки в мерной колбе вместимостью 250 мл, а 20,00 мл полученного раствора оттитровали 19,20 мл раствора нитрата серебра с Т (AgNO3/NaBr)=0,01056 г/мл. Рассчитайте массу бромида натрия (А) в анализируемом растворе.
Для количественного определения нитрата серебра 20,00 мл его раствора оттитровали 15,25 мл раствора NH4NCS с Т = 0,01520 г/мл. Рассчитайте массу нитрата серебра (А) в анализируемом растворе. Известно, что М (AgNO3) = 170 г/моль, а М (NH4NCS) = 76 г/моль.
Навеску тиоцианата калия KNCS массой 4,5000 г растворили в воде и довели до метки в мерной колбе вместимостью 200 мл, а 10,00 мл полученного раствора оттитровали 15,00 мл раствора нитрата серебра (К= 1,2000 к 0,1 н. раствору). Рассчитайте массовую долю в % KNCS в образце. Известно, что М (KNCS)=97 г/моль.
Навеска х. ч. хлорида натрия (А) массой 1,7550 г помещена в мерную колбу и доведена водой до метки. Рассчитайте, какую реальную вместимость (номинальный объём) должна иметь мерная колба, чтобы на 10,00 мл полученного раствора было бы затрачено при титровании 15,00 мл 0,1000 н. раствора AgNO3? Известно, что М (NaCl)=58,5 г/моль.
Навеску хлорида кальция массой 4,0000 г растворили в воде и довели до метки в мерной колбе вместимостью 500 мл. К 15,00 мл полученного раствора прибавили 25,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 12,00 мл 0,09500 н. раствора KNCS. Рассчитайте массовую долю в % хлорида кальция (А) в образце. Известно, что М (CaCl2)=111 г/моль.
Навеску хлорида натрия растворили в воде и довели до метки в мерной колбе вместимостью 100 мл, а 10,00 мл полученного раствора оттитровали 14,00 мл раствора нитрата серебра с Т (AgNO3)=0,01700 г/мл. Рассчитайте массу NaCl (А) в анализируемом растворе. Известно, что М (NaCl)=58,5 г/моль, а М(AgNO3)= 170 г/моль.
Навеску бромида калия растворили в воде и довели до метки в мерной колбе вместимостью 250 мл, а 25,00 мл полученного раствора оттитровали 28,00 мл раствора AgNO3 с Т=0,01700 г/мл. Рассчитайте массу KBr (А) в анализируемом растворе. Известно, что М (KBr)=119,00 г/моль, а М (AgNO3)=170 г/моль.
Навеску хлорида калия массой 0,06000 г растворили в воде. К полученному раствору прибавили 25,00 мл 0,1000 н. раствора нитрата серебра, а избыток AgNO3 оттитровали 15,50 мл раствора KNCS (К= 1,1000 к 0,1 н. раствору). Рассчитайте массовую долю в % хлорида калия (А) в образце. Известно, что М (КCl)=74,50 г/моль.
Навеску хлорида натрия (А) массой 1,7530 г растворили в воде и довели до метки в мерной колбе вместимостью 200 мл. Рассчитайте номинальную вместимость пипетки, которой следует отобрать номинальный объём приготовленного раствора, чтобы при титровании затратить приблизительно 15,00 мл 0,1000 н. раствора AgNO3. Известно, что М (NaCl)=58,44 г/моль.
Навеску сплава серебра массой 3,6000 г растворили в кислоте и раствор довели до метки в мерной колбе вместимостью 1000 мл, а 15,00 мл полученного раствора оттитровали 20,00 мл раствора KNCS с Т=0,001940 г/мл. Рассчитайте массовую долю в % серебра (А) в сплаве. Известно, что М (Ag)=108 г/моль, а М (KNCS)=97 г/моль.
К 20,00 мл раствора перманганата калия (А) прибавили серную кислоту и раствор иодида калия, а выделившийся йод оттитровали 18,00 мл 0,09900 н. раствора Na2S2O3. Рассчитайте массу в граммах KMnO4 в анализируемом растворе. Известно, что М (KMnO4)=158,00 г/моль.
Раствор серной кислоты с Т=0,009800 г/мл объемом 15,00 мл оттитровали 12,50 мл раствора NaOH (А). Рассчитайте молярную концентрацию эквивалента раствора NaOH. Известно, что М (H2SO4)=98,00 г/моль.
К раствору соли кальция (А) прибавили 20,00 мл 0,1000 н. раствора комплексона III, а на титрование избытка комплексона III затратили 9,00 мл 0,1100 н. раствора сульфата магния. Рассчитайте массу кальция в анализируемом растворе. Известно, что М (Са)=40,00 г/моль.
Навеску сульфата железа (II) массой 50,0000 г растворили и довели до метки в мерной колбе вместимостью 500 мл, а 10,00 мл полученного раствора оттитровали 13,00 мл 0,1000 н. раствора дихромата калия. Рассчитайте массовую долю в % FeSO4·7H2O (А) в образце. Известно, что М (FeSO4·7H2O)=278,00 г/моль.
К раствору хлорида бария прибавили растворы дихромата калия и ацетата натрия; выделившийся осадок отфильтровали, промыли и растворили в серной кислоте. Последний раствор оттитровали 22,65 мл 0,05000 н. раствора FeSO4. Рассчитайте массу хлорида бария (А) в анализируемом растворе. Известно, что М (BaCl2)=208,23 г/моль.
Навеску сульфата магния (А) массой 4,1000 г растворили и довели до метки в мерной колбе вместимостью 500 мл. Рассчитайте номинальную вместимость пипетки, которой следует отобрать номинальный объём приготовленного раствора, чтобы при титровании затратить приблизительно 20 мл 0,05000 н. раствора комплексона III. Известно, что М (MgSO4·7H2O)=246,48 г/моль.
К раствору аммиака прибавили 25,00 мл 0,1000 н. раствора хлороводородной кислоты, а избыток кислоты оттитровали 12,50 мл раствора NaOH (К=0,9500 к 0,1 н. раствору). Рассчитайте массу NH3 (А) в анализируемом растворе. Известно, что М (NH3)=17,00 г/моль.
Навеску ацетата свинца массой 12,0000 г растворили и довели до метки в мерной колбе вместимостью 1000 мл. К 20,00 мл полученного раствора прибавили растворы дихромата калия и ацетата натрия; выделившийся осадок отфильтровали, промыли и растворили в серной кислоте. Последний раствор оттитровали 18,00 мл 0,1000 н. раствора FeSO4. Рассчитайте массовую долю в % Pb(CH3COO)2 (А) в образце. Известно, что М (Pb(CH3COO)2)=325,30 г/моль.
К раствору сульфата цинка прибавили 20,00 мл раствора комплексона III, а избыток комплексона III оттитровали 11,50 мл 0,05000 н. раствора сульфата магния. Известно, что 1,00 мл раствора MgSO4 эквивалентен 1,25 мл раствора комплексона III. Рассчитайте массу ZnSO4 в анализируемом растворе, если М (ZnSO4)=161,50 г/моль.
К раствору хлорида железа (III) прибавили серную кислоту и раствор йодида калия, а выделившийся йод оттитровали 15,00 мл раствора тиосульфата натрия с Т=0,01240 г/мл. Рассчитайте массу FeCl3·6H2O (А) в анализируемом растворе. Известно, что М (FeCl3·6H2O)=270,00 г/моль, а М (Na2S2O3·5H2O)=248 г/моль.
Раствор гидроксида натрия с концентрацией 0,1000 н. объемом 15,00 мл оттитровали 12,50 мл раствора серной кислоты. Рассчитайте титр раствора H2SO4 (А). Известно, что М (H2SO4)=98,00 г/моль.
К раствору перманганата калия прибавили 20,00 мл 0,1000 н. раствора сульфата железа (II), а избыток FeSO4 оттитровали 8,00 мл 0,12500 н. раствора K2Cr2O7. Рассчитайте массу KMnO4 (А) в анализируемом растворе. Известно, что М (KMnO4)=158 г/моль.
Навеску сульфата бария массой 0,1500 г растворили в 30,00 мл 0,05000 н. раствора комплексона Ш, а избыток комплексона Ш оттитровали 5,00 мл 0,04500 н. раствора сульфата магния. Рассчитайте массовую долю в % BaSO4 (А) в образце. Известно, что М (BaSO4)=233 г/моль.
Навеска х. ч. Na2B4O7·10H2O (А) массой 6,3560 г помещена в мерную колбу и доведена водой до метки. Рассчитайте, какую реальную вместимость (номинальный объём) должна иметь мерная колба, чтобы на 15,00 мл полученного раствора было бы затрачено при титровании 20,00 мл 0,1000 н. раствора H2SO4? Известно, что М (Na2B4O7·10H2O)=381,37 г/моль.
К раствору хлорида алюминия прибавили 30,00 мл 0,09000 н. раствора комплексона Ш, а избыток комплексона Ш оттитровали 10,00 мл 0,1000 н. раствора сульфата магния. Рассчитайте массу AlCl3 (А) в анализируемом растворе. Известно, что М (AlCl3)=133 г/моль.
Дата добавления: 2019-07-15; просмотров: 1449; | Поделиться с друзьями:
|

Мы поможем в написании ваших работ!