Модуль 2. Фазовые равновесия в силикатных системах и диаграммы состояния
Фазовые равновесия в гетерогенных системах. Основные понятия учения о фазовых равновесиях. Основные понятия и определения. Система. Параметры системы. Независимые компоненты. Степени свободы. Правило фаз. Общие представления о диаграммах состояния.
Диаграммы состояния. Однокомпонентные системы. Элементы строения диаграмм состояния однокомпонентных систем. Энантиотропные и монотропные полиморфные превращения. Система SiO2.
Двухкомпонентные системы. Методы построения диаграмм состояния. Термический анализ. Элементы строения диаграмм состояния двухкомпонентных систем. Основные типы диаграмм состояния двухкомпонентных систем и правила работы с ними. Применение правила рычага в двухкомпонентных системах. Система CaO – SiO2. Система Al2O3 – SiO2. Система MgO – SiO2. Система Na2O – SiO2.
Трехкомпонентные системы. Элементы строения диаграмм состояния трехкомпонентных систем. Основные типы диаграмм состояния трехкомпонентных систем и правила работы с ними. Применение правила рычага в трехкомпонентных системах. Система CaO – SiO2 – Al2O3. Система MgO – Al2O3 – SiO2. Система CaO – MgO – SiO2. Система Na2O – CaO – SiO2.
Задание 2.1 Построение диаграмм состояния двухкомпонентных систем
На основании данных о температурах начала кристаллизации системы (табл. 4) выполните следующие задания:
1. Постройте диаграмму состояния.
2. Определите составы химических соединений.
3. Определите качественные и количественные составы эвтектик.
|
|
|
4. Определите, в каком физическом состоянии находятся системы, содержащие b, c, d % вещества А при температуре Т1? Что произойдет с этими системами, если их охладить до температуры Т2?
5. Определите число фаз и число степеней свободы системы при эвтектической температуре и содержании А: а) 95%; б) 5%.
6. При какой температуре начнет отвердевать расплав, содержащий b % вещества А? При какой температуре он отвердеет полностью? Каков состав первых выпавших кристаллов?
7. При какой температуре начнет плавиться сплав, содержащий c % вещества А? При какой температуре он расплавится полностью? Каков состав первых капель расплава?
8. Какой компонент и в каком количестве выкристаллизуется, если 2 кг расплава, содержащего а % вещества А, охладить от Т1 до Т2?
Таблица 4
| Номер система | Содержание вещества А, мол. % | Темпер. начала крист., К | Содержание вещества А, мол. % | Темпер. начала крист., К | Т1, К | Т2, К | Содержание вещества А, мол. % | |||
| a | b | c | d | |||||||
| 1 А – NaCl; В – ZnCl2 | 0 5 10 15 25 27 30 | 595 589 577 573 543 535 569 | 35 46 52,5 58 67,7 100 | 623 683 769 813 882 1073 | 723 | 583 | 35 | 10 | 50 | 60 |
| 2 А – KCl; В – PbCl2 | 0 10 20 25 30 33,5 40 | 769 748 713 701 710 713 707 | 45 50 55 65 75 90 100 | 693 703 733 811 893 1003 1048 | 753 | 703 | 30 | 5 | 25 | 75 |
| 3 А – KCl; В – MnCl2 | 0 8 15 25 34 36 38 40 | 923 895 865 715 745 722 735 747 | 50 60 65 66 75 85 100 | 769 731 705 701 705 925 1047 | 873 | 733 | 40 | 10 | 40 | 80 |
| 4 А –Li2CO3; В – K2CO3 | 0 9 20 33 39,5 44,2 | 1133 1050 955 765 773 778 | 50 54,5 62 66,6 83,5 100 | 788 778 765 798 911 983 | 923 | 768 | 40 | 10 | 40 | 86 |
| 5 А – RbCl; В – СаCl2 | 0 10 20 30 40 50 | 772(*) 745 683 790 850 859 | 60 70 81,5 90 100 | 825 760 570 670 720 | 800 | 650 | 70 | 10 | 40 | 90 |
| 6 А –CaF2; В – KF | 0 15 30 50 | 857(*) 782 1000 1069 | 57,5 67,5 80 100 | 1061 1151 1300 1418 | 1200 | 900 | 40 | 25 | 70 | 90 |
| 7 А – MgF2; В – KF | 0 12,5 18,5 35 50 | 857(*) 783 833 1000 1070 | 64 70 85 100 | 1004 1100 1225 1263 | 975 | 800 | 25 | 5 | 50 | 70 |
| 8 А – CsCl; В – SrCl2 | 0 10 15 20 25 35 40 | 1147 1124 1089 1059 1102 1155 1166 | 50 60 70 80 85 95 100 | 1180 1158 1071 877 862 875,8 876,8 | 1173 | 1093 | 35 | 10 | 50 | 75 |
| 9 А – RbCl; В – SrCl2 | 0 10 20 30 40 45 50 | 1147 1089 1004 906 964 975 978 | 55 65 70 75 80 90 100 | 969 896 827 853 879 960 999 | 1073 | 923 | 35 | 5 | 35 | 85 |
| 10 А – KCl; В – CaCl2 | 0 5 10 18,5 20 25 35 | 1043 1023 978 911 828 980 1022 | 40 45 55 67 70 90 100 | 1027 1015 961 873 899 1021 1049 | 1023 | 923 | 25 | 5 | 25 | 85 |
| 11 А – LiNO3; В – RbNO3 | 0 10 20 22 32,5 36 40 | 585 535,5 489 479 424 438 449,5 | 50 60 65 70 80 90 100 | 464 457,6 449 567 598 519,5 527 | 523 | 443 | 40 | 10 | 40 | 95 |
| 12 А – MgCl2; В – RbCl | 0 17,5 22,7 23,7 25,9 28 29 30,4 33,1 35,5 | 991 868 800 764 746 736 732 743 749 745 | 36,2 37,5 43,8 50 58,1 65 68,3 78,7 100 | 759 784 816 823 809 783 821 898 984 | 873 | 793 | 40 | 10 | 40 | 75 |
Примечание: (*) в вариантах 5 – 7 температуры заданы в °С.
|
|
|
|
|
|
Задание 2.2 Диаграммы состояния двухкомпонентных силикатных систем
Вариант 1
С помощью диаграммы состояния системы MgO – SiO2 (рис. 3) выполните следующие задания:
1. Охарактеризуйте данную систему. Укажите, сколько химических соединений образуется в данной системе, каковы их составы и температуры плавления.
2. Определите составы равновесных фаз, соответствующих эвтектическим точкам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 35% MgO и 65% SiO2; б) 55% MgO и 45% SiO2.
4. Определите содержание жидкой фазы ( в масс.%) в огнеупоре состава 85% MgO и 15% SiO2 при температурах 1950 и 2100 °С.
5. Определите какое количество форстерита Mg2SiO4 выделится из расплава, содержащего 60% MgO и 40% SiO2, при охлаждении до температуры 1650°С?
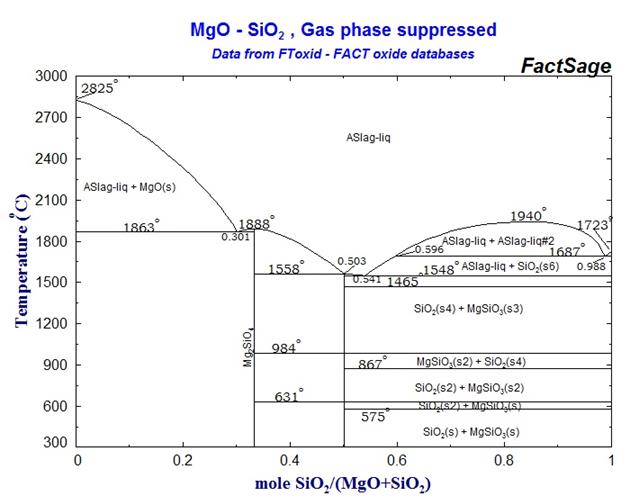
Рис. 3 Диаграмма состояния системы MgO – SiO2
Вариант 2
С помощью диаграммы состояния системы MnO – SiO2 (рис. 4) выполните следующие задания:
|
|
|
1. Охарактеризуйте данную систему. Укажите, какие фазы находятся в равновесии в каждой области диаграммы. Какое из химических соединений плавится инконгруэнтно?
2. Определите составы равновесных фаз, соответствующих эвтектическим точкам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 65% MnO и 35% SiO2; б) 20% MnO и 80% SiO2.
4. Какие фазы будут находиться в равновесии в смеси состава 10% MnO и 90% SiO2 при температуре 1900°С? Сколько степеней свободы имеет система в этом состоянии? При какой температуре исчезнет жидкая фаза при охлаждении смеси указанного состава?
5. Какое твердое вещество и в каком количестве выделится из 1 кг расплава состава 40% MnO и 60% SiO2 при охлаждении его до 1375°С? При какой температуре полностью завершится кристаллизация данного расплава?

Рис. 4 Диаграмма состояния системы MnO – SiO2
Вариант 3
С помощью диаграммы состояния системы Na2O – SiO2 (рис.5) выполните следующие задания:
1. Охарактеризуйте данную систему. Сколько химических соединений образуется в данной системе? Какие из них устойчивы в ограниченном интервале температур?
2. Обозначьте на диаграмме эвтектические точки и определите составы равновесных фаз, соответствующих эвтектическим температурам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 45% Na2O и 55% SiO2; б) 15% Na2O и 85% SiO2.
4. Исходная смесь содержит 30% SiO2 и 70% Na2O. Определите содержание жидкой фазы при 950°С и соотношение между фазами ( в мас. %) при полной кристаллизации расплава.
5. Какие фазы будут находиться в равновесии в смеси состава 30% SiO2 и 80% Na2O при температуре 900°С? Сколько степеней свободы имеет система в этом состоянии? При какой температуре исчезнет жидкая фаза при охлаждении смеси указанного состава?
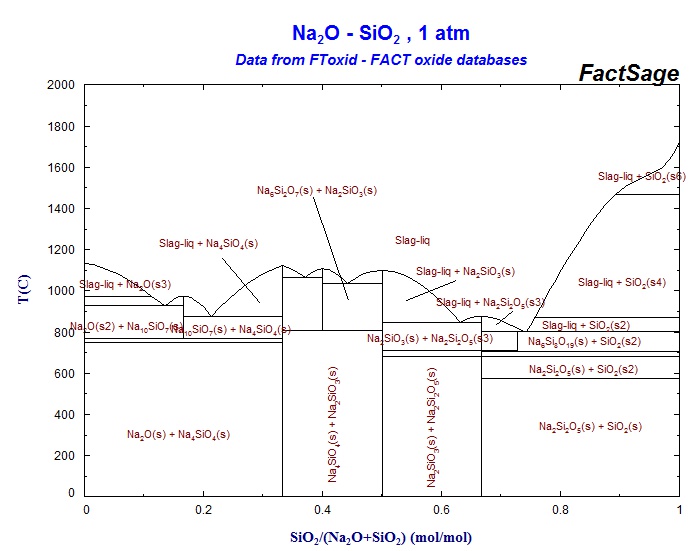
Рис. 5 Диаграмма состояния системы Na2O – SiO2.
Вариант 4
С помощью диаграммы состояния системы Al2O3 – SiO2 (рис.6) выполните следующие задания:
1. Охарактеризуйте данную систему. Какое химическое соединение образуется в данной системе? Какова его температура плавления?
2. Определите составы равновесных фаз, соответствующих эвтектическим точкам.
3. Определите соотношение между муллитом и SiO2 в огнеупоре состава 50% Al2O3 и 50% SiO2, эксплуатирующемся при 1550°С.
4. Опишите процесс кристаллизации расплавов следующих составов: а) 80% Al2O3 и 20% SiO2; б) 40% Al2O3 и 60% SiO2.
5. Какое количество жидкой фазы (в мас.%) образуется при 1760°С в огнеупоре состава 45% Al2O3 и 55% SiO2? Определите фазовый состав этого огнеупора.

Рис. 6 Диаграмма состояния системы Al2O3 – SiO2
Вариант 5
С помощью диаграммы состояния системы ZnO – SiO2 (рис. 7) выполните следующие задания:
1. Охарактеризуйте данную систему. Укажите, какие фазы находятся в равновесии в каждой области диаграммы.
2. Определите составы равновесных фаз, соответствующих эвтектическим точкам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 70% ZnO и 30% SiO2; б) 20% ZnO и 80% SiO2.
4. Какие фазы будут находиться в равновесии в смеси состава 20% ZnO и 80% SiO2 при 1850°С? Определите составы этих равновесных фаз. Сколько степеней свободы имеет система в этом состоянии? При какой температуре полностью исчезнет жидкая фаза при охлаждении указанного состава?
5. Какое твердое вещество и в каком количестве выделится из 1 кг расплава состава 60% ZnO и 40% SiO2 при охлаждении его до 1450°С? При какой температуре полностью завершится кристаллизация данного расплава?
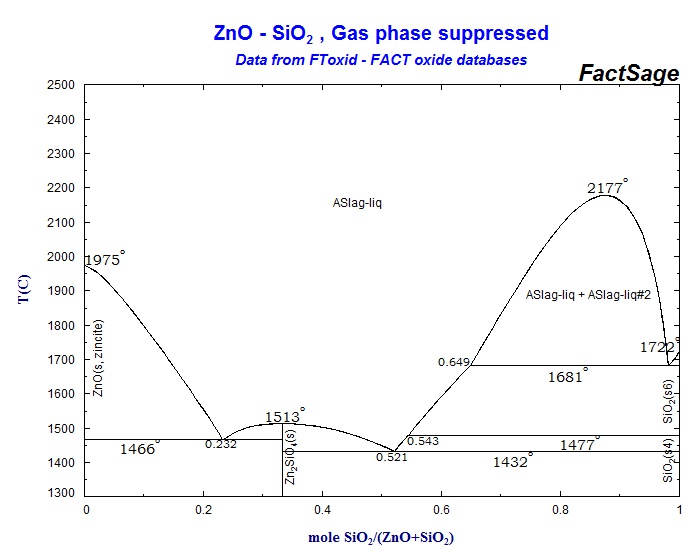
Рис. 7 Диаграмма состояния системы ZnO – SiO2
Вариант 6
С помощью диаграммы состояния системы CaO – Fe2O3 (рис. 8) выполните следующие задания:
1. Охарактеризуйте данную систему. Сколько химических соединений образуется в данной системе? Какие из них устойчивы в ограниченном интервале температур?
2. Обозначьте на диаграмме эвтектические точки и определите составы равновесных фаз, соответствующих эвтектическим температурам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 40% Fe2O3 и 60% CaO; б) 80% Fe2O3 и 20% CaO.
4. Какие фазы будут находиться в равновесии в смеси состава 60% Fe2O3 и 40% CaO при 1200°С? Сколько степеней свободы имеет система в этом состоянии? При какой температуре появится жидкая фаза при нагревании смеси указанного состава?
5. Исходная смесь содержит 90% Fe2O3 и 10% CaO. Определите соотношение между фазами (в мас. %) при полной кристаллизации.
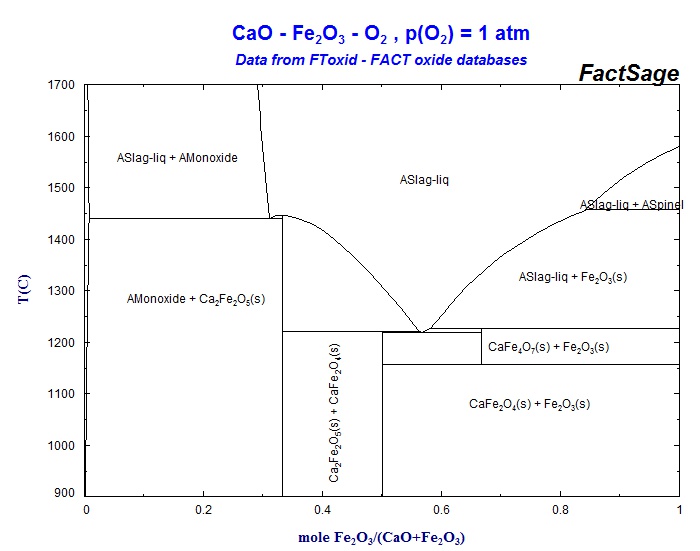
Рис. 8 Диаграмма состояния системы CaO – Fe2O3
Вариант 7
С помощью диаграммы состояния системы K2O – SiO2 (рис. 9) выполните следующие задания:
1. Охарактеризуйте данную систему. Сколько химических соединений образуется в данной системе? Определите их составы (в мас. %) и температуры плавления.
2. Определите составы легкоплавких расплавов и фазовый состав продуктов их кристаллизации.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 30% K2O и 70% SiO2; б) 45% K2O и 55% SiO2.
4. Определите соотношение между фазами (в мас.%), образующимися при полном охлаждении расплава, имеющего состав 70% K2O и 30% SiO2.
5. Какие фазы будут находиться в равновесии в смеси состава 60% SiO2 и 40% K2O при 500°С? Сколько степеней свободы имеет система в этом состоянии? При какой температуре появится жидкая фаза при нагревании смеси указанного состава?

Рис. 9 Диаграмма состояния системы K2O – SiO2
Вариант 8
С помощью диаграммы состояния системы CaO – Al2O3 (рис. 10) выполните следующие задания:
1. Охарактеризуйте данную систему. Укажите, какие фазы находятся в равновесии в каждой области диаграммы. Какие из химических соединений в данной системе плавятся инконгруэнтно?
2. Определите составы равновесных фаз, соответствующих эвтектическим точкам и перитектическим точкам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 20% CaO и 80% Al2O3; б) 40% CaO и 60% Al2O3.
4. Определите соотношение между фазами (в мас. %), образовавшимися при охлаждении расплава, содержащего 55% CaO и 45% Al2O3, до температуры 1500°С.
5. Какие фазы будут находиться в равновесии в смеси состава 80% CaO и 20% Al2O3 при 1700°С? Сколько степеней свободы имеет система в этом состоянии? При какой температуре исчезнет жидкая фаза при охлаждении указанного состава?
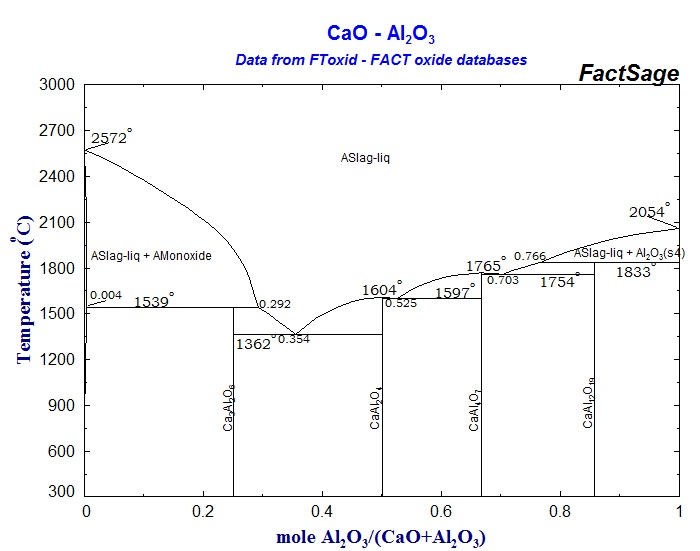
Рис. 10 Диаграмма состояния системы CaO – Al2O3
Вариант 9
С помощью диаграммы состояния системы Na2O – B2O3 (рис. 11) выполните следующие задания:
1. Охарактеризуйте данную систему. Укажите, какие фазы находятся в равновесии в каждой области диаграммы.
2. Сколько химических соединений образуется в данной системе? Какое из соединений плавится инконгруэнтно? Опишите процесс плавления данного соединения.
3. Определите составы равновесных фаз, соответствующих эвтектическим точкам. Какая эвтектическая смесь является самой легкоплавкой?
4. Опишите процесс кристаллизации расплавов следующих составов: а) 80% B2O3 и 20% Na2O; б) 55% B2O3 и 45% Na2O.
5. Какое твердое вещество и в каком количестве выделится из 1 кг расплава состава 80% Na2O и 20% B2O3 при охлаждении его до 500°С?
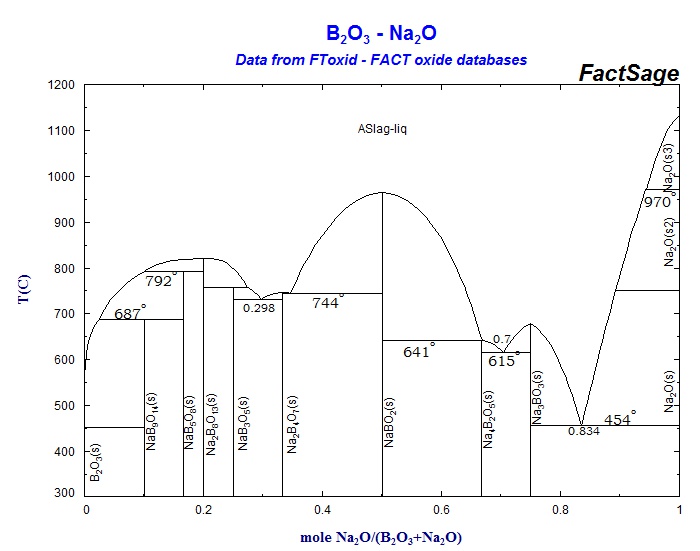
Рис. 11 Диаграмма состояния системы Na2O – B2O3
Вариант 10
С помощью диаграммы состояния системы NiO – SiO2 (рис. 12) выполните следующие задания:
1. Охарактеризуйте данную систему. Определите составы равновесных фаз, соответствующих эвтектическим точкам.
2. Опишите процесс кристаллизации расплавов следующих составов: а) 30% NiO и 70% SiO2; б) 70% NiO и 30% SiO2.
3. Определите состав химического соединения. Опишите процесс его нагревания. При каких температурах будут происходить фазовые превращения?
4. Какое твердое вещество и в каком количестве выделится из 1 кг расплава состава 65% NiO и 35% SiO2 при охлаждении его до 1700°С?
5. Определите соотношение между фазами (в мас. %), образовавшимися при полной кристаллизации и завершении всех фазовых превращений в расплаве состава 80% NiO и 20% SiO2.
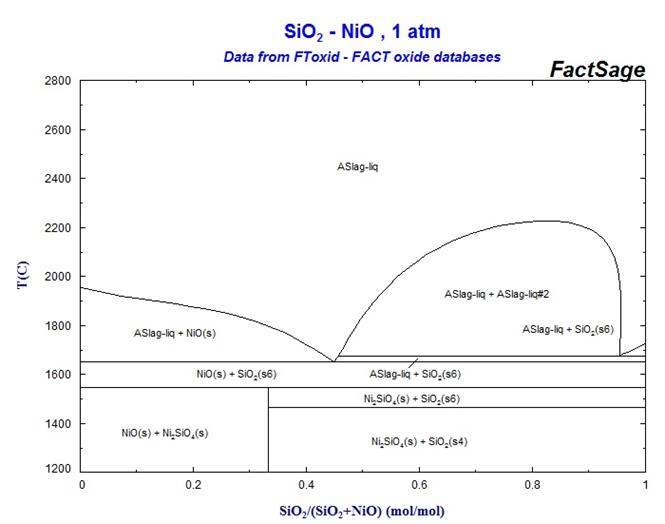
Рис. 12 Диаграмма состояния системы NiO – SiO2
Вариант 11
С помощью диаграммы состояния системы BaO – SiO2 (рис. 13) выполните следующие задания:
1. Охарактеризуйте данную систему. Укажите, какие фазы находятся в равновесии в каждой области диаграммы.
2. Сколько химических соединений образуется в данной системе? Укажите их составы и запишите химические формулы. Какие из химических соединений в данной системе устойчивы в ограниченном интервале температур? Какое химическое соединение имеет самую низкую температуру плавления?
3. Обозначьте на диаграмме эвтектические точки. Определите составы равновесных фаз, отвечающих самой высокой эвтектической температуре.
4. Опишите процесс кристаллизации расплавов следующих составов: а) 15% BaO и 85% SiO2; б) 60% BaO и 40% SiO2.
5. Определите соотношение между фазами (в мас. %), образовавшимися при полной кристаллизации и завершении всех фазовых превращений в расплаве состава 25% BaO и 75% SiO2.

Рис. 13 Диаграмма состояния системы BaO – SiO2
Вариант 12
С помощью диаграммы состояния системы ZrO2 – SiO2 (рис. 14) выполните следующие задания:
1. Охарактеризуйте данную систему. Запишите формулу химического соединения и рассмотрите процесс его нагревания. При каких температурах происходят фазовые превращения при нагревании данного соединения? В чем они заключаются?
2. Обозначьте на диаграмме эвтектические точки. Определите составы равновесных фаз, отвечающих эвтектическим температурам.
3. Опишите процесс кристаллизации расплавов следующих составов: а) 35% ZrO2 и 65% SiO2; б) 85% ZrO2 и 15% SiO2.
4. Какое твердое вещество и в каком количестве выделится из 1 кг расплава состава 60% ZrO2 и 40% SiO2 при охлаждении его до 2200°С?
5. Определите соотношение между фазами (в мас. %), образовавшимися при полной кристаллизации и завершении всех фазовых превращений в расплаве состава 20% ZrO2 и 80% SiO2.

Рис. 14 Диаграмма состояния системы ZrO2 – SiO2
Пример 2.1. На рис. 15 изображена диаграмма состояния системыCaO – SiO2. Опишите процесс кристаллизации расплава состава 15% CaO и 85% SiO2.
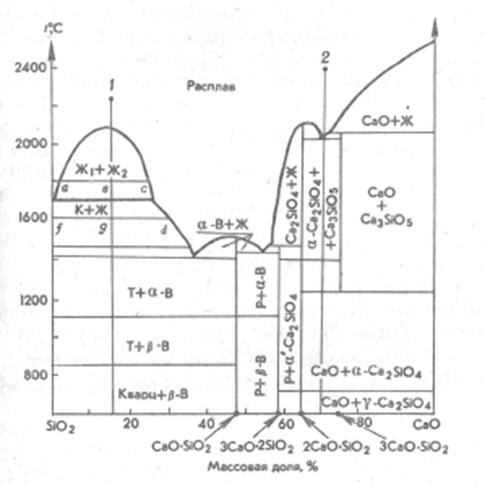
Рис. 15 Диаграмма состояния системы CaO – SiO2.
Обозначения: К – кристобалит; Т – тридимит;
Р – ранкинит; В – волластонит
Решение . Расположим фигуративную точку заданного состава в области однофазного состояния (точка 1). Химический состав исходной смеси относится к области составов, проявляющих стабильную ликвацию, т.е. расслоение в жидкой фазе. При охлаждении до купола ликвации начнется распад однофазного расплава на две несмешивающиеся жидкости. На линии ликвидуса появятся кристаллы α-кристобаллита в равновесии с жидкостью. При 1470 ºС произойдет полиморфное превращение кристобаллита в тридимит. При температуре примерно 1420 ºС жидкая фаза полностью исчезнет с образованием кристаллов α-тридимита и псевдоволластонита α-CaSiO3. При 1125 ºС произойдет переход α-CaSiO3 → β-CaSiO3, а при 870 ºС – переход α-тридимит → α-кварц. Фазовые превращения закончатся при температуре 573 ºС переходом α-кварц → β-кварц.
Полная схема фазовых превращении следующая: расплав → две несмешивающиеся жидкости → α-кристобаллит + Ж → α-тридимит + Ж → α- тридимит + α-CaSiO3 → α-тридимит + β-CaSiO3 → α-кварц + β-CaSiO3 → β-кварц + β-CaSiO3.
Пример 2.2. Опишите процесс кристаллизации расплава состава 70% CaO и 30% SiO2.
Решение . Расположим фигуративную точку заданного состава в области однофазного состояния (точка 2). На кривой ликвидуса при охлаждении такого расплава начнут выделяться кристаллы соединения 3CaO·SiO2 (Ca3SiO5) в присутствии остаточной жидкой фазы. По достижении линии солидуса жидкая фаза исчезнет и в равновесии будут находиться две фазы: α-2CaO·SiO2(Ca2SiO4) и 3CaO·SiO2(Ca3SiO5). При температуре выше 1400 ºС происходит полиморфное превращение α-Ca2SiO4 → α′-Ca2SiO4. При 1250 ºС соединение Ca3SiO5 разлагается с образованием Ca2SiO4 и CaO, поэтому ниже 1250 ºС в равновесии будут фазы α′-Ca2SiO4 и CaO. В процессе дальнейшего охлаждения при температуре примерно 650 ºС α′-Ca2SiO4 переходит в γ-форму.
Полная схема фазовых превращении следующая: расплав → Ca3SiO5 + Ж → Ca3SiO5 + α-Ca2SiO4 → Ca3SiO5 + α′-Ca2SiO4 → α′-Ca2SiO4 + CaO → γ-Ca2SiO4 + CaO.
Пример 2.3. Определите соотношение между фазами (в мас. %), образовавшимися при охлаждении расплава, содержащего 15% CaO и 85% SiO2, до температур 1800 ºС; 1600 ºС и при полной кристаллизации.
Решение . При температуре 1800 ºС (фигуративная точка в) в равновесии две несмешивающиеся жидкости. Проведем через точку в конноду (ас) и опустим перпендикуляры из точек а и с на линию состава. Таким образом узнаем составы обеих жидкостей. Массовое соотношение между равновесными фазами при данной температуре определяется по правилу рычага. Для этого измеряем отрезки ав и вс. Запишем соотношение по правилу рычага:
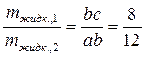 ,
,
где  – масса жидкости состава а;
– масса жидкости состава а;
 – масса жидкости состава с.
– масса жидкости состава с.
Массовая доля жидкости состава а равна = 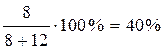 .
.
Массовая доля жидкости состава с равна = 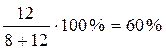 .
.
При температуре 1600 ºС (фигуративная точка g) в равновесии кристобалит и остаточная жидкая фаза, состав которой определяется точкой d. По правилу рычага:
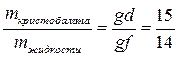 .
.
Массовая доля кристобалита равна =  .
.
Массовая доля жидкости равна = 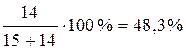 .
.
При полной кристаллизации и завершении всех фазовых превращений (температура примерно 850 ºС) в равновесии две твердые фазы: β-кварц SiO2 и волластонит β-CaSiO3. На линии состава возьмем отрезки от заданноного состава до составов полученных фаз, т.е. SiO2 и CaSiO3 и составим уравнение:
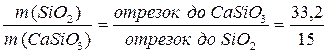 .
.
Массовая доля кристаллов кварца в конечной смеси составит 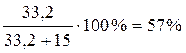 , а кристаллов волластонита – 43%.
, а кристаллов волластонита – 43%.
Дата добавления: 2019-07-15; просмотров: 2243; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
