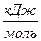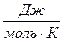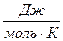Задание 1. Термодинамика реакций в силикатных системах
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное
учреждение высшего образования
«Пермский национальный исследовательский политехнический университет»
Кафедра химии и биотехнологии
Основы физической химии силикатов
Методические указания к лабораторным работам
и индивидуальные задания
Направление: 08.04.01 Строительство
Магистерская программа: Строительные материалы и изделия
Издательство
Пермского национального исследовательского
политехнического университета
2019
Составитель: М.М. Соколова
УДК
Рецензент Пан Л.С.
канд. хим. наук, доц.
(Пермский национальный исследовательский
политехнический университет)
Основы физической химии силикатов. Метод. указания к лаборат. работам и индив. задания / сост. М.М. Соколова – Пермь: Изд-во Перм. нац. исслед. политехн. ун-та, 2019. – 45 с.
Содержит многовариантные индивидуальные задания с примерами, а также указания к выполнению лабораторных работ.
Предназначено для студентов, обучающихся по направлению 08.04.01 Строительство; магистерской программы: Строительные материалы и изделия.
ПНИПУ, 2019
Содержание
| Стр. | |
| Общие методические указания …………………………………………. | 4 |
| Модуль 1. Особенности силикатных материалов и процессов их синтеза ………………………………………………………………… | 5 |
| Задание 1. Термодинамика реакций в силикатных системах | 5 |
| Лабораторная работа №1 …………………………………….. | 9 |
| Лабораторная работа №2 …………………………………….. | 13 |
| Модуль 2. Фазовые равновесия в силикатных системах и диаграммы состояния …………………………………………………… | 17 |
| Задание 2.1 Построение диаграмм состояния двухкомпонентных систем ………………………………….. | 17 |
| Задание 2.2 Диаграммы состояния двухкомпонентных силикатных систем …………………………………………… | 20 |
| Задание 2.3. Диаграммы состояния трехкомпонентных систем ………………………………………………………… | 34 |
| Лабораторная работа №3 ……………………………………... | 37 |
| Список литературы ……………………………………………………… | 43 |
| Приложение ……………………………………………………………… | 45 |
Общие методические указания
|
|
|
Дисциплина «Основы физической химии силикатов»относится к Блоку 1 Дисциплины (модули) и является дисциплиной по выбору при освоении ОПОП по направлению 08.04.01 «Строительство», магистерской программы «Строительные материалы и изделия».
|
|
|
Целью дисциплины является формирование системных знаний в области физической химии силикатов, являющейся теоретической базой процессов производства силикатных строительных материалов и изделий; формирование навыков самостоятельной работы при проведении исследований силикатных систем.
В процессе изучения данной дисциплины студент осваивает следующие компетенции:
– способность демонстрировать знания фундаментальных и прикладных дисциплин программы магистратуры (ОПК-4);
– способность и готовность ориентироваться в постановке задачи, применять знания о современных методах исследования, анализировать, синтезировать и критически резюмировать информацию (ОПК-10);
– способность и готовность проводить научные эксперименты с использованием современного исследовательского оборудования и приборов, оценивать результаты исследований (ОПК-11).
Предметом освоения дисциплины являются следующие объекты:
· силикаты в различных состояниях;
· процессы образования силикатных продуктов;
· фазовые равновесия и диаграммы состояния силикатных систем;
|
|
|
· основные методы физической химии;
· законы термодинамики и кинетики.
В результате изучения дисциплины обучающийся должен демонстрировать следующие результаты:
· знать:
– теории и закономерности процессов, лежащих в основе получения силикатных строительных материалов и изделий;
– законы термодинамики и кинетики; основы учения о фазовых равновесиях.
· уметь:
– анализировать научную и техническую литературу, посвященную теоретическим и экспериментальным исследованиям в области физической химии силикатов;
– проводить теоретические расчеты, анализировать и обобщать результаты физико-химических исследований.
· владеть:
– навыками самостоятельной работы при проведении физико-химических исследований.
Модуль 1. Особенности силикатных материалов
И процессов их синтеза
Силикаты и другие тугоплавкие соединения в кристаллическом состоянии. Химическая связь в силикатах. Структура силикатов. Структура простых и сложных оксидов металлов, боридов, карбидов, нитридов, силицидов. Полиморфизм. Методы изучения структуры силикатов.
Силикаты и другие соединения в стеклообразном состоянии. Особенности стеклообразного состояния и его роль в технологии силикатных материалов. Условия стеклообразования, разновидности стекол. Строение и свойства стекла.
|
|
|
Силикаты в высокодисперсном состоянии. Электрокинетические явления в высокодисперсных силикатных системах. Устойчивость и коагуляция коллоидных силикатных систем. Поверхностно-активные вещества в силикатных системах. Структурно-механические свойства силикатных высокодисперсных систем. Кремнезем в высокодисперсном состоянии. Коллоидные свойства системы глина – вода.
Термодинамика и кинетика процессов в силикатных системах. Процессы синтеза силикатных материалов и их кинетические особенности. Процессы твердофазного взаимодействия. Диффузия в твердых телах. Механизм и последовательность превращений при твердофазном взаимодействии. Кинетика твердофазных реакций. Спекание и рекристаллизация. Кристаллизация расплавов и стекол. Кристаллизация из растворов. Кристаллизация из газовой фазы.
Термодинамика процессов в силикатных системах. Основные понятия термодинамики. Законы термодинамики. Химическое равновесие. Термодинамический метод исследования процессов. Особенности применения методов термодинамики к силикатным системам. Термодинамика твердофазных реакций.
Задание 1. Термодинамика реакций в силикатных системах
Выполните следующие девять заданий для данной реакции (табл. 1) (справочные величины, необходимые для расчетов, возьмите в табл. 2).
1. По значениям стандартных энтальпий образования участвующих в реакции веществ ( 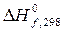 ) вычислите тепловой эффект реакции при стандартных условиях (
) вычислите тепловой эффект реакции при стандартных условиях ( 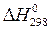 ). Выделяется или поглощается тепло при протекании реакции? Эндо - или экзотермической является данная реакция?
). Выделяется или поглощается тепло при протекании реакции? Эндо - или экзотермической является данная реакция?
2. Выведите функциональную зависимость изменения молярной изобарной теплоемкости для реакции от температуры: DC0p = f(T).
3. Пользуясь законом Кирхгофа и установленной функциональной зависимостью DC0p = f (T) вычислите тепловой эффект реакции при температуре T и стандартном давлении ( 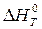 ). Поясните как влияет увеличение температуры на величину теплового эффекта реакции?
). Поясните как влияет увеличение температуры на величину теплового эффекта реакции?
4. Что характеризует энтропия системы? Качественно оцените знак изменения энтропии (DS) при протекании реакции. Объясните полученный результат.
5. По значениям стандартных энтропий участвующих в реакции веществ ( 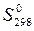 ) вычислите изменение энтропии реакции при стандартных условиях (
) вычислите изменение энтропии реакции при стандартных условиях ( 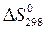 ).
).
6. Используя функциональную зависимость DC0P = f (T) вычислите изменение энтропии реакции при температуре T и стандартном давлении (  ). Как влияет повышение температуры на величину DS0?
). Как влияет повышение температуры на величину DS0?
7. Вычислите изменение энергии Гиббса реакции, протекающей при стандартных условиях ( 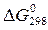 ). Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определите температуру (T0) (если такая имеется), выше которой реакция меняет свое направление.
). Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определите температуру (T0) (если такая имеется), выше которой реакция меняет свое направление.
8. Вычислите изменение энергии Гиббса реакции, протекающей при стандартном давлении и температуре T ( 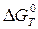 ), считая, что
), считая, что 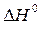 и
и 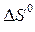 не зависят от температуры (метод Улиха). Постройте график зависимости
не зависят от температуры (метод Улиха). Постройте график зависимости 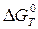 от температуры. Сделайте вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
от температуры. Сделайте вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
9. Вычислите изменение энергии Гиббса реакции (  ) при температуре T и стандартном давлении, учитывая зависимость
) при температуре T и стандартном давлении, учитывая зависимость 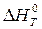 и
и 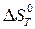 от температуры. Сравните полученные значения
от температуры. Сравните полученные значения 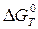 с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оцените их расхождение.
с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оцените их расхождение.
Таблица 1
| Номер варианта | Реакция | Т, К |
| 1 | СаО(т) + SiO2(кварц) = СаО·SiO2(т) | 1000 |
| 2 | 3СаО(т) + 2SiO2(кварц) = 3СаО·2SiO2(т) | 1000 |
| 3 | MgO(т) + Al2O3(корунд) = MgO·Al2O3(т) | 1500 |
| 4 | MgO(т) + SiO2(кварц) = MgO·SiO2(т) | 1000 |
| 5 | 2MgO(т) + SiO2(кварц) = 2MgO·SiO2(т) | 1000 |
| 6 | СаО(т) + Al2O3(корунд) = СаO·Al2O3(т) | 800 |
| 7 | 3СаО(т) + Al2O3(корунд) = 3СаO·Al2O3(т) | 800 |
| 8 | СаО(т) + 2Al2O3(корунд) = СаO·2Al2O3(т) | 800 |
| 9 | FeО(т) + SiO2(кварц) = FeО·SiO2(т) | 1100 |
| 10 | 2FeО(т) + SiO2(кварц) = 2FeО·SiO2(т) | 1100 |
| 11 | 2СаО(т) + SiO2(кварц) = 2СаО·SiO2(т) | 1000 |
| 12 | Na2О(т) + SiO2(кварц) = Na2О·SiO2(т) | 900 |
Таблица 2
|
Вещество |
DН0f,298,
|
S0298,
|
Коэффициенты уравнения С0P = f (T), | ||
| а | b×103 | с1×10–5 | |||
| Al2O3(корунд) | 1670,69 | 50,92 | 114,55 | 12,89 | –34,31 |
| СаО(т) | –635,10 | 38,07 | 49,62 | 4,52 | –6,95 |
| SiO2(кварц) | –910,94 | 41,84 | 46,99 | 34,31 | –11,30 |
| Na2О(т) | –417,98 | 75,06 | 77,11 | 19,33 | –12,59 |
| FeО(т) | –264,85 | 60,75 | 50,80 | 8,61 | –3,31 |
| MgO(т) | –601,49 | 27,07 | 48,98 | 3,14 | –11,44 |
| СаО· SiO2(т) | –1636,52 | 82,04 | 111,51 | 15,07 | –27,29 |
| 2СаО·SiO2(т) | –2309,58 | 127,67 | 151,74 | 36,96 | –30,31 |
| 3СаО· 2SiO2(т) | –3826,17 | 210,97 | 267,90 | 37,88 | –69,49 |
| СаO·Al2O3(т) | –2322,39 | 114,21 | 150,74 | 41,78 | –33,33 |
| 3СаO·Al2O3(т) | –3558,10 | 205,53 | 260,70 | 19,17 | –50,11 |
| СаO·2Al2O3(т) | –3994,70 | 177,91 | 276,66 | 22,94 | –74,51 |
| MgO·SiO2(т) | –1549,87 | 67,81 | 102,77 | 19,84 | –26,08 |
| 2MgO·SiO2(т) | –2178,94 | 95,02 | 140,90 | 27,38 | –35,66 |
| MgO·Al2O3(т) | –2299,30 | 80,70 | 154,19 | 26,81 | 40,98 |
| Na2О·SiO2(т) | –1559,70 | 113,86 | 130,35 | 40,18 | –27,08 |
| FeО·SiO2(т) | –1207,03 | 96,28 | 158,40 | 17,00 | –27,30 |
| 2FeО·SiO2(т) | –1500,05 | 145,25 | 152,83 | 39,18 | –28,04 |
Пример 1.1. Выведите функциональную зависимость изменения молярной изобарной теплоемкости от температуры (DC0p = f(T)) для реакции С(графит) + CO2(г) = 2CO(г). Вычислите тепловой эффект реакции при 500 К, если при стандартных условиях он равен 172,5 кДж.
Решение. Зависимость Cp реагирующих веществ от температуры представлена для неорганических веществ уравнениями вида
Cp = a + bT + c 1 T –2,
поэтому величину DС P рассчитывают по уравнению
DCP = Da + DbT +Dc 1 T –2 .
Выпишем из справочника [9] температурные коэффициенты в уравнениях теплоемкости для веществ, участвующих в реакции.
| Вещество | Коэффициенты уравнения С0P = f (T), | ||
| а | b×103 | с1×10–5 | |
| С(графит) | 16,86 | 4,77 | –8,54 |
| СО(г) | 28,41 | 4,10 | –0,46 |
| СО2(г) | 44,14 | 9,04 | –8,53 |
Вычислим их изменения:
Da = 2. 28,41 – 44,14 – 16,86 = -4,18;
Db = (2. 4,10 – 9,04 – 4,77).10–3 = -5,61.10–3;
Dc 1 = [2. (–0,46) – (-8,53) – (-8,54)] .105 = 16,15.105.
Функциональная зависимость изменения молярной изобарной теплоемкости от температуры для данной реакции имеет вид:
DCP = -4,18 -5,61.10–3T + 16,15.105T –2 .
Для расчета теплового эффекта реакции воспользуемся уравнением Кирхгофа в интегральной форме:
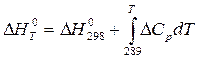 .
.
После подстановки зависимости DCP от T в уравнение Кирхгофа и интегрирования получим:
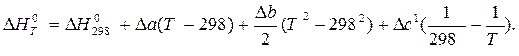
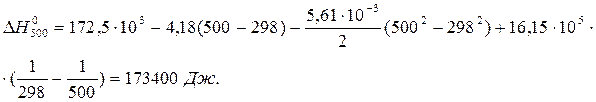
Пример 1.2. Изменение энтропии реакции С(графит) + CO2(г) = 2CO(г) при стандартных условиях ( 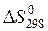 ) равно 175,46
) равно 175,46 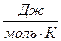 . Используя функциональную зависимость теплоемкостей реагирующих веществ от температуры (см. пример 1), вычислите изменение энтропии при температуре 500 К (
. Используя функциональную зависимость теплоемкостей реагирующих веществ от температуры (см. пример 1), вычислите изменение энтропии при температуре 500 К ( 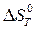 ).
).
Решение. Изменение энтропии реакции при заданной температуре находим по уравнению

После подстановки DCP = Da + DbT +Dc 1 T –2 и интегрирования получим:
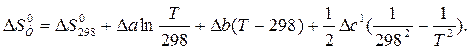
Значения Da, Db и Dc 1 рассчитаны в примере 1. Величина  равна:
равна:
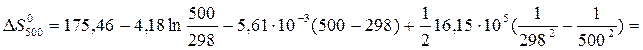 = 178,03
= 178,03 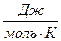 .
.
Пример 1.3. Рассчитать изменение энергии Гиббса реакции при температуре 500 К и стандартном давлении ( 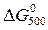 ): а) по уравнению Улиха, считая, что
): а) по уравнению Улиха, считая, что  и
и 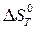 не зависят от температуры; б) учитывая зависимость
не зависят от температуры; б) учитывая зависимость 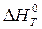 и
и 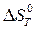 от температуры.
от температуры.
Решение.
а) Рассчитаем изменение энергии Гиббса реакции по уравнению Улиха (приближенный расчет):
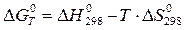 .
.
Значения 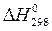 и
и  возьмем в примерах 1 и 2.
возьмем в примерах 1 и 2.
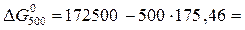 84770 Дж.
84770 Дж.
б) Более точно величину 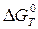 рассчитаем по уравнению:
рассчитаем по уравнению:
 .
.
Значения 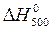 и
и 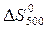 возьмем в примерах 1 и 2.
возьмем в примерах 1 и 2.
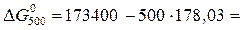 84385 Дж.
84385 Дж.
Лабораторная работа № 1
Дата добавления: 2019-07-15; просмотров: 519; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!