Написать уравнения реакций, используя метод электронного или
протонно-кислородного баланса:
S(т) + NaOH(р) = ? + Na2SO3 + ? (t, ЩМ и ЩЗМ)
S(т)избыток + NaOH(р) = ? + Na2SO3(S) + ? (до 100 оС)
S(т) + H2SO4(к) = SO2↑ + ? (t)
S(т) + HNO3(р) = ? + NO↑ (t)
S(т) + HNO3(к) = H2SO4 + ? + ? (t)
H2S(р) + H2SO4(к) = S↓ + ?↑ + ?
H2S(р) + H2SO4(к) = SO2(г) + ?
H2S (г) + HIO3(р) = S↓ + ?↓ + ?
H2S(г) + HNO2(р) = ?↓ + NO↑ + ?
Na2SO3(р) + КMnO4(р) + H2SO4(р) = ? + ? + ? + H2O
Na2SO3(р)+ Na2Cr2O7(р)+ H2SO4(р) = ? + ? + ? + H2O
МеSO3(т) = МеО + ? (t, Ме = ЩЗМ)
Ме2SO3 = ? + Ме2S (600 оС, Ме = ЩМ)
NaНSO3(т) = ? + SO2 + ? (tt)
SO3(ж) + HCl(г) = SO2 + ? + ? (t)
Zn (Mg) + H2SO4(к) + H2SO4(к) = ? + SO2↑ + ?
Zn (Mg) + H2SO4(к) + H2SO4(к) = ? + S↓ + ?
Zn (Mg) + H2SO4(к) + H2SO4(к) = ? + H2S↑ + ?
С(т) + H2SO4(к) = SO2↑ + ? + ?
HBr(р) + H2SO4(к) = ? + SO2↑ + ?
HI(р) + H2SO4(к) = ? + H2S↑ + ?
Лабораторная работа № 18 [14]
Азот и его соединения, получение и свойства
Получение и свойства азота. 1. Собрать прибор (рис.1). Насыпать в пробирку 1-2 г измельченного нитрита натрия, прилить по каплям 2-3 мл концентрированного раствора хлорида аммония и осторожно нагреть. Собрать выделяющийся газ и проверить, поддерживает ли он горение. Написать уравнение реакций получения азота.
2. В пробирку 1 положить немного хлорной извести, в капельную воронку 2 налить концентрированный раствор аммиака. Приливая к хлорной извести по каплям раствор аммиака, собрать выделяющийся азот в пробирку 3. Написать уравнение реакции. Проверить, поддерживает ли азот горение. Как отличить азот от углекислого газа?
|
|
|
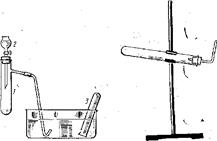
Рис. 1. Приборы для получения азота и аммиака.
Получение и свойства аммиака. 1. Приготовить смесь из 1-2 г
хлорида аммония и 1-2 г гашеной извести. Обнаруживается ли при этом образование аммиака? Перенести смесь в пробирку, закрыть пробкой с изогнутой газоотводной трубкой (рис. 1) и подогреть. Поднести к концу газоотводной трубки лакмусовую бумажку, смоченную водой (что наблюдается?), затем - стеклянную палочку, смоченную концентрированной соляной кислотой (что происходит?). Написать уравнения реакций.
2. Налить в пробирку 2 мл разбавленного раствора аммиака и нагреть. Как сдвигается равновесие в системе аммиак – вода при изменении температуры?
3. Налить в пробирку 2 мл 25%-ного раствора аммиака и бросить в него небольшой кусочек едкого натра. Что происходит? Объяснить наблюдаемое явление на основании закона действующих масс.
Какими способами получают аммиак в промышленности?
Термическая диссоциация солей аммония
Хлорид аммония. Положить в стеклянную трубку длиной 20 см и диаметром 1 см хлорид аммония. Пользуясь двумя стеклянными палочками, спрессовать его посередине трубки слоем в 3 см. На расстоянии 2-3 см от полученной таким образом пробки насыпать еще немного хлорида аммония. Положить синюю и красную лакмусовые бумажки у отверстия трубки.
|
|
|
Закрепить трубку наклонно в лапке штатива и нагреть слой хлорида аммония ниже пробки. Чем объясняется изменение окраски лакмуса? Какому закону подчиняется скорость диффузии газов? Какой из газов, получающихся в результате термической диссоциации хлорида аммония, быстрее диффундирует и во сколько раз? Написать уравнение термической диссоциации хлорида аммония.
Аммонийные соли фосфорной кислоты
Положить на крышку тигля несколько кристаллов одной из аммонийных солей фосфорной кислоты и нагреть. Какое вещество остается на крышке тигля после нагревания? Написать уравнение реакции.
Сульфат аммония. Положить на крышку тигля несколько кристаллов сульфата аммония и прокалить. Написать уравнение реакции термической диссоциации сульфата аммония.
Нитрат аммония. Положить на крышку тигля несколько кристаллов нитрата аммония и осторожно нагреть (под тягой). Написать уравнение реакции.
|
|
|
Чем объясняется различный характер разложения аммонийных солей при нагревании? Какие соли аммония возгоняются? Как доказать экспериментально, что использованные соли являются солями аммония?
Гидразин N 2 H 4 и гидроксиламин N -1 H 2 OH
Свойства гидразина и гидроксиламина. 1. В две пробирки налить по 5 мл воды и внести в них 2-3 капли гидразина или несколько кристаллов сульфата гидразина. В одну пробирку прибавить несколько капель йодной йоды. Что наблюдается? Написать уравнение реакции. В другую пробирку добавить растворы хлорида меди (II) и щелочи. Осторожно нагреть содержимое пробирки. Что происходит? Написать уравнение реакции.
Какими свойствами обладают соединения гидразина?
2. Растворить несколько кристаллов солянокислого гидроксиламина в 4-5 мл воды. Испытать раствор на лакмус. Прилить несколько капель йодной воды. Что происходит? На какие свойства гидроксиламина указывает данная реакция?
Оксиды азота
Оксида азота N 2 O или оксонитрид азота( V ). Поместить в пробирку 1-2 г нитрата аммония и осторожно нагреть. Собрать над водой выделяющийся газ в две баночки. В одну баночку внести ложечку с горящим фосфором, в другую — тлеющую лучинку. Что наблюдается? Написать уравнения реакций.
|
|
|
Оксид азота (+2) NO. 1. Собрать прибор (рис. 1). Положить в пробирку 2-3 г медных стружек и прилить 3-4 мл 33%-ного раствора азотной кислоты. Если реакция будет идти слабо, следует немного подогреть колбу. Чем объяснить появление окраски газов в колбе? Растворяется ли NO в воде и щелочи?
Собрать NO в две небольшие баночки. Испытать, горят ли лучинка и красный фосфор в оксиде. Что происходит при соприкосновении NO с воздухом? Написать уравнения реакций.
2. Пропустить ток NO через слегка подогретый раствор концентрирован-ной азотной кислоты. Что наблюдается? Написать уравнение реакции.
3. Налить в пробирку 3-5 мл свежеприготовленного насыщенного раствора сульфата железа (II). Пропустить через раствор ток NO. Как изменяется окраска раствора? Написать уравнение реакции. Раствор подогреть. Что наблюдается? Как получается NO в промышленности?
Диоксид азота NO2 (оксид азота +4). 1. Положить в колбу Вюрца 1-2 г медных стружек и закрыть ее пробкой, снабженной воронкой с длинной трубкой. Налить 5-10 мл концентрированной азотной кислоты. Какой газ выделяется? Написать уравнение реакции.
Собрать NO2 в две небольшие баночки и испытать, горят ли в ней тлеющая лучинка и зажженный красный фосфор? Написать уравнения реакций.
Кислоты
Получение и свойства азотистой кислоты HNO2. 1. Растворить небольшое количество нитрита калия в 1-2 мл воды, охладить раствор снегом и прибавить к нему 2-3 капли чистой концентрированной серной кислоты. Что наблюдается? Написать уравнения реакций. Чем объясняется различная прочность азотной и азотистой кислот?
2. Налить в пробирку раствор нитрита калия, подкислить его разбавленной серной кислотой и добавить несколько капель перманганата калия. Что происходит? Написать уравнение реакции. Сделать аналогичный опыт с бихроматом. На какие свойства азотистой кислоты указывают эти реакции?
3. К подкисленному раствору йодида калия добавить несколько капель крахмала и раствора нитрита калия. Что наблюдается? Написать уравнение реакции. Проделать аналогичный опыт с бромидом калия, заменив крахмал органическим растворителем. Какую роль играет азотистая кислота в этих реакциях?
Азотная кислота
Свойства азотной кислоты (под тягой!). 1. Налить в фарфоровую чашку 1-2 мл свежеприготовленного концентрированного раствора азотной кислоты. Добавить 1-2 капли концентрированного раствора серной кислоты и осторожно под тягой прибавить к ней при помощи пипетки 2-3 капли чистого скипидара. Что наблюдается?
2. Налить в 5 пробирок по 2 мл концентрированного раствора азотной кислоты.
Первую пробирку закрепить вертикально в лапке штатива и, подогревая кислоту, опустить тлеющую лучинку. Что происходит?
Во вторую, закрепленную в лапке штатива, опустить кусочек серы и подогреть. Когда пробирка охладится, вылить содержимое ее в воду и обнаружить присутствие серной кислоты. Написать уравнения реакций.
Третью пробирку с азотной кислотой нагреть и внести в нее кусочек шерсти. Что наблюдается?
Пропустить ток сероводорода через азотную кислоту, находящуюся в четвертой пробирке. Написать уравнение реакций. В пятую пробирку с азотной кислотой внести небольшое количество сульфида меди. Объяснить растворение его в азотной кислоте. Написать уравнение реакции.
3. Испытать действие концентрированного раствора азотной кислоты на цинк и олово. Реакцию провести в маленьких фарфоровых чашках при слабом нагревании (под тягой!). Написать уравнения происходящих реакций.
Взять две пробирки, в одну из них поместить 2 - 3 кусочка цинка, в другую- такое же количество олова. Прилить в обе пробирки по 5 мл 2%-ного раствора азотной кислоты и оставить до следующего занятия. Как определить, что в данных условиях образовались соли аммония? Написать уравнения реакций. На какие свойства азотной кислоты указывают проведенные опыты?
4. Приготовить 9-12 мл «царской водки». В каких объемных отношениях необходимо смешивать соляную и азотную кислоты для приготовления «царской водки»? Небольшие количества киновари (сульфида ртути) поместить в две фарфоровые чашечки, одну порцию киновари облить свежеприготовленным раствором «царской водки» (осторожно!), другую — концентрированной азотной кислотой. Поставить обе чашки на песчаную баню и нагреть. Что происходит? Удалить нагреванием избыток «царской водки» и азотной кислоты. Написать уравнения реакций.
Почему «царская водка» является более сильным окислителем, чем азотная кислота. Объяснить, пользуясь произведение растворимости, почему сульфид ртути не растворяется в кислоте, но растворяется в «царской водке»?
Соли азотной кислоты. Какие продукты образуются при прокаливании нитратов калия, меди, свинца и серебра? Чем объясняется различный характер их распада?
Контрольные вопросы
Дата добавления: 2019-07-15; просмотров: 332; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
