Растворы. Растворимость солей. Произведение растворимости
Теоретическая часть
Процесс химического растворения твердого вещества в воде (и не только в воде) в случае равновесия в растворе малорастворимого (или практически нерастворимого вещества) можно выразить уравнением.
CaSO4 + (n+m)H2O  [Ca(H2O)n]2+ + [SO4 (H2O)m]2-
[Ca(H2O)n]2+ + [SO4 (H2O)m]2-
Это уравнение в явном виде показывает, что важнейшей причиной растворения является гидратация ионов Ca 2+ и SO42-.
В случае равновесия в растворе малорастворимого (или практически нерастворимого вещества) выражение для константы равновесия в насыщенном растворе можно записать с использованием равновесных концентраций
Kc = [[Ca(H2O)n]2+] [[SO4 (H2O)m]2-] / [[H2O]n+m
Так как равновесная концентрация воды в разбавленном растворе практически постоянна, можно записать
KГ(CaSO4) = Kc .[H2O]n+m =[[Ca(H2O)n]2+] [[SO4 (H2O)m]2-]
То же самое упрощенно
KГ(CaSO4) = [Ca 2+aq][ SO42-aq] или K Г(CaSO4) =[Ca 2+][ SO42-]
Получившаяся величина (KГ) носит название константы гидратации.
В рамках теории электролитической диссоциации равновесие в растворе CaSO4 записывается так:
CaSO4  Ca 2+ + SO42-
Ca 2+ + SO42-
Соответствующая константа называется произведением растворимостии обозначается буквами ПР:
ПР(CaSO4) = [Ca 2+][ SO42-]
Определение растворимости дихромата калия. Приготовить насыщенный при комнатной температуре раствор дихромата калия. Пользуясь таблицей растворимости, рассчитать количество дихромата, требуемое для насыщения 50 мл воды (взять 10% избытка дихромата), перенести в колбу объемом 100 мл и прилить 50 мл воды. Перемешать содержимое колбы 2-3 мин. и измерить температуру раствора. Затем отфильтровать нерастворившуюся соль, собирая фильтрат в сухую колбу.
|
|
|
Взвесить фарфоровую чашку на технохимических весах, от полученного фильтрата отобрать 20 мл раствора и перенести в чашку, взвесить чашку с раствором. Поставить чашку на водяную баню и упарить досуха, затем чашку поместить в сушильный шкаф. После высушивания и охлаждения, взвесить чашку с веществом и определить растворимость. Полученные результаты занести в таблицу:
| Данные опытов | Опыты |
1.Температура насыщения раствора, оС
2. Объем раствора, взятого для выпаривания, мл
3. Масса фарфоровой чашки, г
4. Масса чашки с раствором, г
5. Масса раствора, г
6. Масса чашки с сухой солью, г
7. Масса сухой соли, г
8. Растворимость, г в 100 г воды
Влияние температуры на растворимость солей
1. Алюмокалиевые квасцы ( KAl ( SO 4 )2.12 H 2 O ). В пробирку с 3 мл воды положить около 2 г алюмокалиевых квасцов. Наблюдать, растворяются ли квасцы в этом количестве воды на холоду? Если нет, то нагреть содержимое
пробирки почти до кипения. Что наблюдается? Дать раствору остыть. Что происходит при этом? Как меняется растворимость квасцов с изменением температуры?
|
|
|
2. Хлорид натрия. Растворить при нагревании около 2 г хлорида натрия в 3 мл воды. Слить прозрачный горячий раствор в сухую пробирку. Что наблюдается при охлаждении раствора?
3. Ацетат кальция. В сухую пробирку налить немного насыщенного раствора ацетата кальция и нагреть его, а затем охладить струей воды из водопроводного крана. Что наблюдается?
Используя таблицу растворимости, начертить кривые растворимости квасцов, хлорида натрия и ацетата кальция, отложив по оси абсцисс температуру, а по оси ординат — концентрацию насыщенного раствора.
Приготовление пересыщенных растворов
1. Пентагидрат сульфата меди (С uSO4.5 H2 O). Рассчитать, какое количество кристаллогидрата сульфата меди (медного купороса) надо взять на 10 мл воды, чтобы приготовить раствор, насыщенный при 60°. Полученный при нагревании раствор довести почти до кипения и быстро отфильтровать через складчатый фильтр на воронке для горячего фильтрования (воронка должна быть горячей). Пробирку с фильтратом закрыть кусочком ваты. Если в фильтрате образовались кристаллы, их необходимо перевести в раствор осторожным нагреванием.
|
|
|
Раствор охладить и внести в него маленький кристаллик исходной соли. Что наблюдается? Изменяется ли температура раствора?
Нагреть пробирку с содержимым, чтобы снова получить прозрачный раствор, осторожно охладить его и потереть стеклянной палочкой внутрен-нюю стенку пробирки с раствором. Объяснить выпадение кристаллов.
2. Тиосульфат натрия (Na2SO3S). Положить несколько кристаллов соли в
сухую пробирку и очень медленно нагреть. Что происходит? Закрыв пробирку ватой, дать ей охладиться. Охлажденную до комнатной температуры пробирку резко встряхнуть. Что при этом наблюдается?
Нагреванием пробирки с солью снова получить прозрачный раствор. Охладить и внести маленький кристаллик исходного вещества. Описать наблюдаемое явление.
Тепловые явления при растворении солей
Наблюдать тепловые явления, происходящие при растворении в 50 мл воды 0,1 моля следующих солей: нитрата аммония, безводного сульфата натрия, декагидрата сульфата натрия. Для этого налить в стакан (емкостью 100 мл) 50 мл воды, измерить ее температуру и, всыпав соответствующее количество соли, наблюдать за изменением температуры. Дать объяснение происходящим явлениям.
|
|
|
Начертить кривые растворимости указанных солей (см. таблицу растворимости). Какую зависимость можно отметить между теплотой растворения вещества и изменением его растворимости с температурой?
Произведение растворимости.
Осаждение труднорастворимых солей. Налить в три пробирки по 2-3 мл раствора хлоридов бария, стронция и кальция. В первую пробирку прилить раствор сульфата натрия, во вторую - насыщенный раствор сульфата кальция и в третью - насыщенный раствор сульфата стронция.
Написать уравнения химических реакций в молекулярной и сокращенно-ионной формах. Объяснить образование осадков, пользуясь понятием произведения растворимости. В каких случаях при сливании растворов солей не происходит образования осадка?
Растворение труднорастворимых солей. Получить в пробирках осадки карбоната кальция и оксалата кальция действием соответствующих растворов солей. Декантировать растворы и к влажным осадкам прилить раствор уксусной кислоты. Повторить опыт, заменив уксусную кислоту на соляную. Что при этом происходит?
Написать уравнения химических реакций в молекулярной и ионной формах. Объяснить полученные результаты на основании величин констант диссоциации кислот и произведения растворимости.
Упражнения
1.Зная произведение растворимости, рассчитать концентрацию вещества в насыщенном растворе BaSO4к и Ca(OH)2кр.
1) BaSO4кр  Ba2+ + SO42-
Ba2+ + SO42-
ПР(BaSO4) = [Ba2+][SO42-] = 1,8.10–10 моль2/л2. C(BaSO4) = [Ba2+] = [SO42-] =√ ПР(BaSO4) =√ 1,8.10–10 моль2/л2 = 1,34.10–5 моль/л.
2) Ca(OH)2кр  Ca2+ + 2OH-
Ca2+ + 2OH-
ПР[Ca(OH)2] = [Ca2+][OH-]2 = 6,3.10–6 моль3/л3.
[OH-] = 2[Ca2+]  ПР[Ca(OH)2] = [Ca2+]{2[Ca2+]}2 = 4[Ca2+]3
ПР[Ca(OH)2] = [Ca2+]{2[Ca2+]}2 = 4[Ca2+]3
c[Ca(OH)2] = [Ca2+] =  =
= 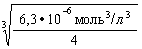 = 1,16.10–2 моль/л.
= 1,16.10–2 моль/л.
2. Выпадет ли осадок гидроксида меди при добавлении 100 мл 0,01 М раствора гидроксида кальция к равному по объему 0,001 М раствору сульфата меди?
Cu2+ + 2OH-  Cu(OH)2
Cu(OH)2 
Осадок гидроксида меди образуется, если произведение концентраций ионов Cu2+ и OH- будет больше произведения растворимости этого малорастворимого гидроксида. После сливания равных по объему растворов общий объем раствора станет в два раза больше, чем объем каждого из исходных растворов, следовательно, концентрация каждого из реагирующих веществ (до начала реакции) уменьшится вдвое. Концентрация в полученном растворе ионов меди составит
c(Cu2+) = (0,001 моль/л) : 2 = 0,0005 моль/л.
Концентрация гидроксид ионов составит
c(OH-) = (2.0,01 моль/л) : 2 = 0,01 моль/л.
Произведение растворимости гидроксида меди составит
ПР[Cu(OH)2] = [Cu2+][OH-]2 = 5,6.10–20 моль3/л3.
Произведение концентраций ионов в растворе составит
c(Cu2+).{ c(OH-)}2 = 0,0005 моль/л.(0,01 моль/л)2 = 5.10–8 моль3/л3.
Произведение концентраций больше произведения растворимости, следовательно, осадок выпадет.
3. Выпадет ли осадок сульфата серебра при сливании равных объемов 0,02 М раствора сульфата натрия и 0,04 М раствора нитрата серебра?
2Ag+ + SO42- ↔ Ag2SO4↓
Концентрация в полученном растворе ионов серебра равна
c(Ag+) = (0,04 моль/л) : 2 = 0,02 моль/л.
Концентрация в полученном растворе сульфат-ионов равна
c(SO42-) = (0,02 моль/л) : 2 = 0,01 моль/л.
Произведение растворимости сульфата серебра равно
ПР(Ag2SO4) = [Ag+]2.[SO42-] = 1,2.10–5 моль3/л3.
Произведение концентраций ионов в растворе равно
{c(Ag+)}2.c(SO42-) = (0,02 моль/л)2.0,01 моль/л = 4.10–6 моль3/л3.
Произведение концентраций меньше произведения растворимости, следовательно, осадок не образуется.
4. Используя значения произведений растворимости, определите концентрацию и массовую долю растворенных веществ в растворе а) хлорида серебра, б) сульфата кальция, в) фосфата алюминия.
5. Определите объем воды, необходимой для растворения при 25 oС сульфата бария массой 1 г.
6. Чему равна масса серебра, находящегося в виде ионов в 1 л насыщенного при 25 oС раствора бромида серебра?
7. В каком объеме насыщенного при 25 oС раствора сульфида серебра содержится 1 мг растворенного вещества?
8. Образуется ли осадок, если к 0,05 М раствору Pb(NO3)2 добавит равный объем 0,4 М раствора KCl?
9. Определите, выпадет ли осадок после сливания 5 мл 0,004 М раствора CdCl2 и 15 мл 0,003 М раствора KOH.
10. Смешали равные объемы 0,02 М раствора СаCl2 и 0,02 М раствора КОН. Будет ли образовываться осадок, если произведение растворимости Са(ОН)2 равно 5,5.10-6. Плотность всех растворов принять равными 1 г/мл.
Лабораторная работа № 8
Приготовление растворов
Теоретическая часть
Количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя, называют концентрацией раствора. Применяют следующие выражения концентрации растворов: массовая доля, мольная доля, моляльная, молярная и нормальная.
Массовую долю выражают числом единиц массы растворенного вещества, содержащихся в 100 единицах массы раствора. Массовую долю выражают в долях единицы или в процентах:
ω = m(x) / m(p) или ω = (m(x) / m(p)) .100%
m(x) – масса растворенного вещества, m(p) - масса раствора.
Приготовление раствора с заданной массовой долей. Сколько граммов глауберовой соли Na2SО4 . 10Н2О и воды потребуется для приготовления 40 г 10%-ного раствора, рассчитанного на безводную соль?
Решение. Находим количество безводной соли, необходимое для приготовления 40 г 10%-ного раствора:
m(Na2SО4 ) = 40 . 0,1 = 4 г
М(Na2SО4) = 142 г/моль и М(Na2SО4 . 10Н2О) = 322 г/моль.
Находим количество Na2SО4 . 10Н2О, содержащее 4 г Na2SО4:
322 г Na2SО4 . 10Н2О = 142 г Na2SО4
х = 4 г, х = 9,07 г
9,07 г Na2SО4 . 10Н2О растворить в воде массой:
m(Н2О) = 40 - 9,07 = 30,93 г = 30,93 мл
Моляльную концентрацию раствора выражают числом молей растворенного вещества, приходящихся на 1000 г растворителя.
Пример. Определить моляльность насыщенного при 25° С раствора хлорида натрия NaCl.
Решение. В таблице находим, что при 25°С в 100 г воды растворяется 36,0 г NaCl. Следовательно, в 1000 г воды растворяется 360 г. Находим число молей NaCl в 1000 г воды: n(NaCl) = 360 / 58,5 = 6,15 моль. Это и есть моляльность раствора (m).
Приготовление раствора моляльной концентрации. Приготовить 300 г 0,2 моляльного раствора медного купороса.
Решение. М(CuSО4 . 5Н2О) = 250г/моль. Находим массу медного купороса на 1000 г воды: m(CuSО4 . 5Н2О) = 250 . 0,2 = 50 г. Находим массу раствора:
m(р) = 1000 + 50 = 1050 г.
Навеску CuSО4 . 5Н2О для приготовления 300 г 0,2 моляльного раствора находим из пропорции:
1050 = 50
300 х , х = 14,286 г
Количество воды, в котором нужно растворить эту навеску, равно
m(Н2О) = 300 - 14,286 = 285,72 г = 285,72 мл.
Молярную концентрацию выражают числом молей растворенного вещества в 1 л раствора. Раствор, в 1 л которого содержится 1 моль растворенного вещества, называют одномолярным или молярным и обозначают 1 М. Если в 1 л раствора содержится 0,1 моль растворенного вещества, то его называют децимолярным и обозначают 0,1 М. Если в 1 л раствора содержится 0,01 моль растворенного вещества, то его называют сантимолярными и обозначают 0,01 М и т. д.:
Сm = n / V (моль/л)
Пример. Определить молярность раствора, в 250 мл которого содержится 2,5 г едкого натра NaOH.
Решение. Число граммов NaOH, содержащегося в 1л раствора, находим из пропорции:
250 = 2,5
1000 х, х = 10 г
М(NaOH) = 40 г/моль. В 1 л данного раствора содержится количества вещества NaOH: n = 10 : 40 = 0,25 моль. Тогда молярная концентрация будет: Сm = 0,25 : 1 = 0,25 моль/л
Отсюда следует, что для определения молярности раствора нужно массу растворенного вещества, содержащееся в 1 л раствора, разделить на молярную массу.
Приготовление молярных растворов. 1. Приготовить 500 мл 0,1 М раствора дихромата калия К2Сг2О7.
Решение. М(К2Сг2О7) = 294 г/моль. Для приготовления 1 л 0,1 М раствора нужно взять 0,1 моль К2Сг2О7 или m(К2Сг2О7) = 294 • 0,1 = 29,4 г. Массу К2Сг2О7, необходимую для приготовления 500 мл раствора, находят из пропорции:
1000 = 29,4 , х = 14,7 г К2Сг2О7
500 х
Навеску 14,7 г К2Сг2О7 поместить в мерную колбу емкостью 500 мл, растворить соль в небольшом количестве воды, затем наполнить колбу водой до метки и хорошо перемешать раствор.
2. Сколько граммов медного купороса CuSО4 . 5Н2О потребуется для приготовления 200 мл 0,5 М раствора?
Решение. М(CuSО4 . 5Н2О) = 250 г/моль. Для приготовления 200 мл 0,5 М раствора потребуется:
1000 = 0,5 , х = 0,1 моль CuSО4
200 х
Следовательно, для приготовления 200 мл 0,5 М раствора потребуется:
0,1 моль CuSО4 • 5Н2О
Находим массу кристаллогидрата:
m(CuSО4 . 5Н2О) = 0.1 . 250 = 25 г
Навеску 25 г CuSО4 . 5Н2О поместить в мерную колбу емкостью 200 мл, растворить соль в небольшом количестве воды, затем наполнить колбу водой до метки и хорошо перемешать раствор.
Применение молярных растворов при проведении химических реакций. При одинаковой концентрации равные объемы растворов содержат одно и то же число молей растворенного вещества. Следовательно, легко рассчитывать, какие объемы растворов необходимо смешать при проведении указанной реакции, чтобы ни одно из веществ не осталось в избытке.
Пример 1. Какой объем 1 М раствора нитрата серебра AgNО3 нужно добавить к 100 мл 1 М раствора хлорида железа (III) FeCl3, чтобы осадить весь хлор в виде хлорида серебра?
Решение. Из уравнения реакции:
FeCl3 + 3AgNО3 = Fe (NО3)3 + 3AgCI
следует, что на один моль FeCl3 требуется три моль AgNО3. Так как исходные растворы равномолярные, то в одинаковых объемах их содержится равное число молей, поэтому к 100 мл раствора FeCl3 нужно добавить 300 мл раствора AgNО3.
Пример. Какой объем 2 М раствора NaOH потребуется для осаждения в виде Сu(ОН)2 меди, находящейся в 20 мл 0,5 М раствора сульфата меди (II) CuSО4?
Решение. Из уравнения реакции:
CuSО4 + 2NaOH = Сu(ОН)2 + Na2SО4
следует, что на один моль CuSО4 требуется два моль NaOH. Значит, на 20 мл 0,5 М раствора CuSО4 нужно взять 40 мл раствора NaOH такой же молярности. Рассчитаем объем 2М раствора NaOH:
V1С1 = V2C2 или 40. 0,5 = 2.V2 , V2 = 10 мл
Нормальную концентрацию выражают числом эквивалентов растворенного вещества в 1 л раствора. Раствор, в 1 л которого содержится один эквивалент растворенного вещества, называют однонормальным или нормальным и обозначают 1 н. Раствор, содержащий в 1 л 0,1 эквивалент, называют децинормальным и обозначают 0,1 н.
Пример 1. Определить нормальность раствора, содержащего в 200 мл 1,96 г серной кислоты.
Решение. Находим массу серной кислоты в 1000 мл раствора:
200 1,96
1000 = х , х = 9,8 г Н2SО4
Находим молярную массу эквивалента Н2SО4:
М(Э(Н2SО4)) = 98:2 = 49 г/моль.
Находим число эквивалентов растворенного вещества в 1 л раствора, т.е.- нормальность раствора:
49 1
9,8 = х , х = 0,2
В одинаковых объемах растворов одной и той же нормальности содержатся эквивалентные количества веществ, которые реагируют между собой без остатка. Поэтому, например, для нейтрализации 50 мл 1 н. раствора любой кислоты нужно затратить 50 мл 1 н. раствора любой щелочи.
Если концентрации не равны, то объемы растворов веществ, вступающих в реакцию, обратно пропорциональны их концентрациям:
V1С1н = V2C2н или V1 : V2 = C2н : С1н ,
где V1 и С1н - объем и нормальность первого раствора, V2 и C2н - объем и нормальность второго раствора.
Пример 2. Какой объем 0,1 н. раствора NaOH потребуется для нейтрализации 20 мл 0,15 н. раствора H2SО4?
Решение. На 20 мл 0,15 н. раствора H2SО4 пошло бы 20 мл раствора NaOH той же нормальности, а объем 0,1 н. раствора NaOH находим из пропорции:
0,1 = 20
0,15 х , х = 30 мл
Или, используя выражение V1 : V2 = C2н : С1н, находим:
20 : х = 0,1: 0,15 , х = 30 мл
Пример 3. Приготовить 250 мл 0,1 н. раствора H2SO4 из раствора кислоты плотностью 1,84 г/мл.
Решение. Зная, что в 1 л раствора должно содержаться 0,1 эквивалент H2SO4 , находим число эквивалентов в 250 мл раствора:
1000 мл 0,1 экв
250 х , х = 0,025 моль
М(Э(H2SO4)) = ½ H2SO4 = 98/2 = 49 г/моль. Следовательно, для приготовления 250 мл 0,1 н. раствора потребуется серная кислота массой
m(H2SO4) = 0,025 . 49 = 1,225 г
Далее по таблице плотностей растворов находим, что в растворе H2SO4, плотностью 1,84 г/мл, содержится 96 % H2SO4. Зная массовую долю H2SO4 в растворе, находим массу раствора H2SO4 из выражения ω = m(x) / m(p):
m(p) = m(x) / ω, mр(H2SO4) = 1,225 : 0,96 = 1,276 г
Затем из выражения для плотности раствора ρ = m(p)/ V(p) находим объем 96 % раствора H2SO4:
Vр(H2SO4) = m(p)/ ρ , Vр(H2SO4) = 1,276 : 1,84 = 0,7 мл
Теперь для приготовления раствора нужно в воду, находящуюся в колбе емкостью 250 мл, влить 0,7 мл 96%-ного раствора H2SO4 и долить воду до метки.
Дата добавления: 2019-07-15; просмотров: 1506; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
