Учебное занятие – экспериментариум по химии
«По стопам великих детективов. Дело о карбоновых кислотах»
Цель: исследовать состав и свойства карбоновых кислот, познакомиться с представителями карбоновых кислот.
Задание 1.
Назвать изученные классы кислородосодержащих органических веществ:__________________________________________________________
примеры_____________________________________________________
функциональная группа____________________________________________________________
Задание 2.
Дать определение кислотам, привести примеры неорганических кислот_______________________________________________________________________________________________________________________________
Задание 3.
Описать физические свойства уксусной кислоты: агрегатное состояние_________________________цвет_____________________________
запах______________, растворимость в воде____________________________
Сравнить электропроводность, действие на индикатор, взаимодействие с химическими реагентами соляной и уксусной кислот
| реагент кислота | Индикатор лакмус | Zn | NaOH | CaCO3 |
| HCl | ||||
| Уксус-ная кислота |
Карбоновые кислоты_______________________________________________
Классификация карбоновых кислот

По характеру радикала: предельные, непредельные, ароматические
По числу атомов углерода: С1 – С9 - __________________С10 и выше___________________
Общая формула предельных одноосновных кислот __________________________________________________________________
|
|
|
Первым членом гомологического ряда одноосновных карбоновых кислот является:(формула)___________(название) _______________________
Вторым членом гомологического одноосновных карбоновых кислот является: (формула) ____________, (название) __________________________
Изомерия углеродного скелета карбоновых кислот.
Формулы изомеров кислот: пентановой кислоты, 2,3-диметилбутановой кислоты
Формулы и названия некоторых предельных одноосновных кислот
| Формула кислоты | Номенклатура IUPAС | Тривиальная номенклатура | Название кислотного остатка |
| HCОOH | метановая | муравьиная | формиат |
| CH3COOH | этановая | уксусная | ацетат |
| C2H5COOH | пропановая | пропионовая | пропионат |
| C3H7COOH | бутановая | масляная | бутират |
| C4H9COOH | пентановая | валериановая | валериат |
| C15H31COOH | гексадекановая | пальмитиновая | пальмитат |
| C17H35COOH | октадекановая | стеариновая | стеарат |
Физические свойства карбоновых кислот обусловлены наличием между их молекулами________________ связей. Благодаря полярной группе_______ низшие карбоновые кислоты в воде _____________________
Задание 4. Вместо пропусков и курсивов напишите формулы, расставьте коэффициенты
|
|
|
Химические свойства карбоновых кислот:
1. Изменяют окраску индикатора вследствие_______________ :
НСООН = НСОО - + .......
2. Взаимодействуют с металлами (до H2):
НСООН + Zn = формиат цинка + Н2↑.
3. Взаимодействуют с оксидами металлов:
…………… + CuO = ацетат меди(II) + Н2О.
4. Взаимодействуют с гидроксидами металлов:
…………….. + Cu(OН)2 = формиат меди(II) + Н2О.
5. Взаимодействуют с солями:
НСООН + Na2CO3 = формиат натрия + Н2О + CO2↑
(!) Муравьиная кислота проявляет особые свойства:
_________________________________________________________
Реакция этерификации
Задание 5 . Составьте уравнение реакции получения эфиров
метилового эфира пропионовой кислоты (метилпропионата)
________________________________________________________
Детективное агентство. Дайте ответ, о какой карбоновой кислоте идет речь, проведите исследование химических свойств этой кислоты.
__________________________________________________________________________________________________________________________________________________________
Познакомьте другие группы с данной информацией. Внесите информацию в таблицу.
Самое интересное о карбоновых кислотах:
| Формула и название кислоты | Информация |
Что мне запомнилось на экспериментариуме?
|
|
|
Приложение 2.
Материалы к занятию
Детективное агентство «Дело о карбоновых кислотах»
Дело №1
Улика №1.
«Formic acid»
Эта кислота - бесцветная жидкость. Растворима в ацетоне, бензоле. Смешивается с водой. При контакте с кожей 100%-ная кислота вызывает сильные химические ожоги. Контакт с концентрированными парами этой кислоты может привести к повреждению глаз и дыхательных путей. В медицине используется эта кислота в качестве средства от варикоза, а также для приготовления раствора «первомур». Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования. Также в медицине используется 1,25% -ный раствор этой кислоты в спирте как раздражающее средство при лечении ревматизма.
В основном, эту кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Она замедляет процессы гниения и распада, поэтому сено и силос, обработанные этой кислотой, дольше сохраняются. Также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях. В пищевой промышленности эта кислота используется как пищевая добавка Е-236 – консервант при консервировании овощей и производстве безалкогольных напитков.
|
|
|
Улика №2
«Двуликая кислота»
Эта кислота и формальдегид образуются в организме при отравлении метиловым спиртом. Данные вещества токсичны и поражают зрительный нерв, что ведет к полной слепоте. Если в организм попал метанол, во избежание образования этой кислоты под влиянием алкогольдегидрогеназы, нужно сразу выпить раствор этилового спирта. Этиловый спирт – своеобразный антидот, препятствующий отравлению этой кислотой.
Так выглядит модель молекулы этой кислоты:
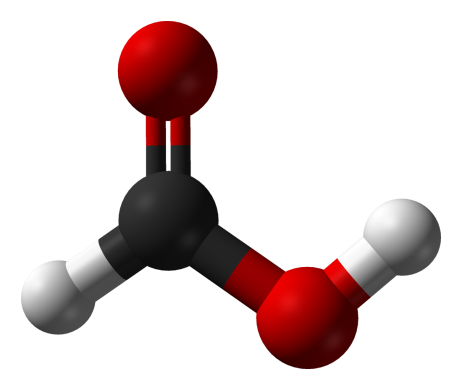 Эта кислота проявляет свойства и карбоновых кислот, и альдегидов. Например, для нее характерна реакция «серебряного зеркала». Эту кислоту можно получить окислением метанола. Соли этой кислоты называют формиаты. Массовая доля углерода в этой кислоте – 26 %, кислорода – 70%, остальное – водород.
Эта кислота проявляет свойства и карбоновых кислот, и альдегидов. Например, для нее характерна реакция «серебряного зеркала». Эту кислоту можно получить окислением метанола. Соли этой кислоты называют формиаты. Массовая доля углерода в этой кислоте – 26 %, кислорода – 70%, остальное – водород.
Улика №3
«Имя ее запомнить легко»
Эта кислота - жалящая жидкость медуз, пчел, крапивы, хвои ели.
 Насекомые рода Formika используют различные кислоты как средство общения друг с другом, точно так же, как многие общественные насекомые. Эта кислота, выделяемая ими в момент опасности, служит сигналом для всех остальных особей этого вида и является средством защиты при нападении хищников. Благодаря этой кислоте такие насекомые имеют не так уж много врагов.
Насекомые рода Formika используют различные кислоты как средство общения друг с другом, точно так же, как многие общественные насекомые. Эта кислота, выделяемая ими в момент опасности, служит сигналом для всех остальных особей этого вида и является средством защиты при нападении хищников. Благодаря этой кислоте такие насекомые имеют не так уж много врагов.
Среди этих насекомых встречаются и камикадзе, они умеют взрывать себя. Для этого они собирают в области брюшка накопления в виде кислоты и потом разрезают или прокалывают это место, после чего происходит небольшой взрыв способный остановить врагов.
Впервые кислоту удалось получить в XVII веке. Тогда Джон Рэй смог выделить её из этих насекомых. Впоследствии это вещество нашли в некоторых разновидностях растений и в продуктах жизнедеятельности пчёл.
Задание для детективов
Задание 1
Составьте уравнения реакции взаимодействия этой кислоты с магнием, гидроксидом калия. Дайте названия полученным соединениям.
Задание 2
Сложные эфиры этой кислоты используются в качестве душистых веществ. Например, этилформиат имеет запах рома. Составьте уравнение реакции получения этого эфира.
Задание 3
Проведите реакцию «серебряного зеркала», подтверждающую наличие альдегидной группы в этой кислоте. Составьте уравнение реакции.
Дело №2
Улика №1.
«Самая древняя…»
В природе эта кислота содержится в выделениях животных. В организме человека в течение суток в процессе обмена веществ ее образуется около 400 г.
Эта кислота – самая древняя из известных человечеству кислот. При нарушении технологии виноделия ее получали как нежелательный продукт и поначалу просто выливали. Скорее всего, этот продукт получился случайно, когда сосуд с вином оставили на жарком солнце.
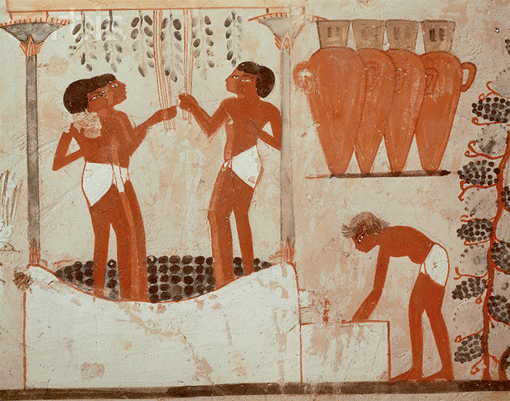
Этот продукт готовили из финикового вина примерно 7 тысяч лет назад в Древнем Египте, Вавилоне и Ассирии, и использовали как антисептик или растворитель при создании медицинских смесей. Кстати, само название "кислота" происходит от латинского слова названия этого вещества - "acetum". В России ее называли «кислотная влажность» или «древесная кислота», так как ее получали при сухой перегонке древесины березы.
Это вещество очень хорошо растворяется в воде, легко воспламеняется и проводит электрический ток. В неразведенном виде эта кислота опасна для жизни, употребление ее в этом виде может привести к летальному исходу. Пары этого вещества могут привести к раздражению слизистых путей, а концентрация выше 30% вызвать ожоги.
Улика №2.
«Любопытные факты»
· Получают ее из растений и плодов, но синтетический способ более дешев и выгоден.
· Однако в США, Франции и Болгарии запрещено производство этого продукта из искусственно синтезированной кислоты. Ограничение прописано законодательно. Обоснование – недостаточные вкусовые качества и отсутствие дополнительных полезных веществ, образующихся при скисании винограда, зерновых, яблок.
· Этот продукт высокого качества приравнивают к вину, точно так же выдерживают и коллекционируют. Во Франции, к примеру, годовое потребление продукта на душу населения приближается к 4-ем литрам. В России же годовая норма на человека – 200 мг.
· Он бывает бальзамический, винный, солодовый …
· В Японии производят пшеничный, ячменный и рисовый…
· В США изготавливают острый … из ореха Пекан.


Улика №3
«Незаменимая в быту»
В хозяйстве эту кислоту используют в качестве пятновыводителя. Особенно хорошо она устраняет следы от фруктов и ягод. Можно протереть раствором кислоты пятна на стеклах и зеркалах, что придаст особый блеск поверхностям. Устранить реагент способен и неприятные запахи, в частности, затхлый, например, в хлебнице. Достаточно протереть стенки хлебницы раствором этой кислоты и запах исчезнет. С помощью этого реагента можно удалить ржавчину с изделия или накипь в чайнике.
Это вещество, разведенный простой и чистой водой, является прекрасной приправой для подготовки маринадов рыбы или мяса. Применяется очень широко в приготовлении домашних консервов из овощей и фруктов. Самая популярная - 9-процентная. 80% - ную называют эссенцией. 100% -ная - ледяная. При низких температурах она преобразуется в массу, напоминающую лед.
Задание для детективов
Задание 1
Составьте уравнения реакции гашения соды этой кислотой, принимая во внимание, что сода – гидрокарбонат натрия. Осуществите эту реакцию.
Какие еще соли можно использовать для получения такого же эффекта? Приведите примеры уравнений реакций.
Задание 2
Составьте уравнения реакции получения метилового эфира этой кислоты.
Задание 3
Соли этой кислоты называют ацетатами. Раствор ацетата свинца (II) с давних времен известен как «шпионские чернила». Надпись, сделанная ими на бумаге, после высыхания не оставляет следа. Но следует только смочить бумагу раствором определенной соли, как надпись проявляется. Что может быть проявителем этих чернил? Составьте уравнение реакции.
Дело № 3
Улика №1.
«Назовите ваше имя, миледи…»
Впервые эта кислота была обнаружена среди продуктов разложения сахара в 1844 г. Йоханом Готлибом. В дальнейшем это вещество различными способами удавалось получить многим ученым, правда они и не догадывались, что синтезировали одно и то же соединение. Но в 1847 году французский химик-органик и по совместительству государственный деятель Жан-Батист Дюма установил, что его коллеги имеют дело с одной и той же кислотой.
Это кислота одноосновная. Цепь ее молекулы открыта. Все это характерно для кислот, содержащихся в маслах, восках, животных жирах. Поэтому они и называются жирными.
У этой кислоты самая маленькая молекулярная масса в группе жирных кислот и равна 74. Получается, что эта кислота «первая среди жирных», так и переводится ее имя с греческого. (Protos на греческом означает «первый», а pion – «жир»). Ее также можно назвать метилуксусной.
Это едкая, бесцветная жидкость с резким запахом, не ядовита, растворима в воде. Запах кислоты ассоциируется с парами потоотделения, и значительно ослабевает, если смешать это соединение с водой.
Улика №2.
«Не хлебом единым…»
Способность этой кислоты предотвращать рост и развитие некоторых бактерий и плесени служит основанием для использования ее в пищевой промышленности. В чистом виде эта кислота применяется только в процессе производства кормов для животных. В продуктах питания, предназначенных для людей, это вещество может быть применено лишь в виде кальциевой или натриевой соли, известных как пищевая добавка – консервант Е280.

Среди продуктов питания, в которых содержится эта кислота, можно назвать хлеб и хлебобулочные изделия. Кроме того, Е280 может использоваться для сохранения молочной сыворотки во время транспортировки.

Бактерии рода Propionibacterium производят эту кислоту, как конечный продукт своего анаэробного метаболизма. Эти бактерии часто встречаются в желудке жвачных животных, и, отчасти, из-за их деятельности швейцарский сыр имеет свой аромат.
Улика №3
«Кто вы, незнакомка?»
Этот реагент убивает некоторые грибки, поэтому, используется для борьбы с ними не только в еде, но и на коже человека. В косметических целях слабые растворы кислоты применяют, так же от угревой сыпи.
Уничтожить с помощью реагента можно не только грибки, но и неприятный запах. Поэтому кислота входит в «букеты» духов, дезодорантов, распылителей для дома. Соединение этой кислоты с метанолом образует метилпропионат – ароматизатор в пищевой промышленности.
Она может входить в состав некоторых лекарственных препаратов анальгетической, противовоспалительной направленности (например, «Ибупрофен).
Это соединение применяется для изготовления гербицидов (средств борьбы с сорняками). Химическая промышленность применяет данное соединение в ходе производства пластмасс и растворителей.
Модель молекулы этой кислоты выглядит так:
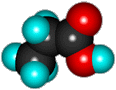
Задание для детективов
Задание 1
Напишите молекулярную и сокращенную структурную формулу этой кислоты. Вычислите массовые доли элементов в этой кислоте.
Задание 2
Составьте уравнения реакции получения этилового эфира этой кислоты.
Задание 3
Исследуйте действие раствора этой кислоты на индикатор, цинк и раствор гидроксида кальция. Составьте уравнения реакций, дайте названия солям.
Дело №4
Улика №1.
«Сахарная, да не сладкая»
Эта кислота впервые была получена во второй половине XVIII столетия и носила название «сахарная», так как была произведена путем соединения азотной кислоты и сахара.
 Это бесцветное кристаллическое вещество характеризуется полным отсутствием запаха. Обладает свойством хорошо растворяться в воде.
Это бесцветное кристаллическое вещество характеризуется полным отсутствием запаха. Обладает свойством хорошо растворяться в воде.
Но её не используют в пищевой отрасли промышленности. Эта кислота сильнее уксусной в 200 раз и может разъедать посуду.
Относительная молекулярная масса кислоты равна 90. В молекуле кислоты не только два атома углерода, но и две карбоксильных группы. Поэтому ее относят к дикарбоновой (двухосновной).
Такой состав кислоты и обуславливает ее силу. Из ряда дикарбоновых вещество это самое активное с химической точки зрения, поскольку карбоксильные группы наиболее близки друг к другу.
Улика №2.
«Управа на ржавчину»
Кислота является составной пиротехнических смесей, пластмасс, чернил, а так же участвует в синтезе красящих смесей. К металлам реагент применяют и как средство от ржавчины. Кислота легко растворяет ее, полируя поверхность металлургических сплавов.
В текстильной промышленности соединение используется при протравливании тканей. Кислота проявляет отбеливающие свойства. Применяется в качестве компонента кремов и лосьонов против пигментных пятен, веснушек.
 Функцию отбеливания кислота выполняет так же в моющих средствах. В домашнем применении важны еще и дезинфицирующие свойства соединения. Некоторые соли этой кислоты, — оксалаты, в частности, оксалат кальция и оксалат магния очень плохо растворимы в воде и оседают в почечных лоханках в виде камней различного размера.
Функцию отбеливания кислота выполняет так же в моющих средствах. В домашнем применении важны еще и дезинфицирующие свойства соединения. Некоторые соли этой кислоты, — оксалаты, в частности, оксалат кальция и оксалат магния очень плохо растворимы в воде и оседают в почечных лоханках в виде камней различного размера.
Улика №3.
«Все дело в названии»
Кислота широко распространена в природе: содержится в смородине, апельсинах, малине. Содержится эта кислота в таких продуктах питания:

«Имя» свое она получила от названия этого растения. Причем, в увядших листьях этого растения ее содержится значительно больше, чем в свежих.

Задание для детективов
Задание 1
Напишите молекулярную, полную и сокращенную структурную формулы этой кислоты. Вычислите массовые доли элементов в этой кислоте.
Задание 2
Составьте уравнения реакции взаимодействия этой кислоты с натрием, гидроксидом калия. Дайте названия полученным соединениям.
Задание 3
Проведите реакцию взаимодействия карбоната натрия с раствором этой кислоты. Что наблюдается? Составьте уравнение реакции.
Дело №5
Улика №1.
«Опасная Е-шка?»
Эта кислота в природе встречается в большом количестве плодов и растений. Пример: ананасы, гранаты, хвоя, а также клюква, рябина или смородина. В древних мифах Геракл брал силы для своих подвигов из плодов деревьев, в которых содержится эта кислота.

Эта кислота - пищевая добавка антиоксидант Е-330, повышает строк хранения маргарина, животных масел и жиров. На полки она магазинов попадает благодаря промышленному производству, а именно – биосинтезу плесневого гриба под названием Aspergillus niger из сахара либо мелассы (сахаристых веществ, патоки).
Интересно, что в 1970-ые ее записали в канцерогены. Вещество попало в «Вильжюифский список», на который ориентировался рынок Европы. Его название образовано от имени института в пригороде Парижа, на исследования ученых которого ссылаются в документе. Опровергнуть данные документа удалось лишь к 1990 –ым. Интересно, что эту кислоту используют как противоядие при отравлении щелочами.
Улика №2.
«И на кухне, и в быту незаменима»
Эту кислоту используют как для приготовления различных блюд (начиная с компотов или соусов и заканчивая кексами), так и для бытовых нужд.
Например, с помощью этого нехитрого средства за пару минут убирают накипь внутри обычных и электрических чайников, а также на нагревательных элементах стиральных машин-автоматов. А еще этот дешевый порошок поможет очистить и обеззаразить любую поверхность, отмыть плиту и устранить ненужные запахи из кастрюль, не хуже чем посудомоечная машина.

В косметологии эту кислоту добавляют в кремы и лосьоны для лица и тела, в эликсиры, и в средства для мытья и фиксации волос. Кроме того, без нее невозможно представить “бомбы” для ванн.
Улика №3
«Citric Acid»
Впервые эта кислота была получена знаменитым шведским химиком-аптекарем Карлом Шееле в 1784 году из лимонного сока. Кстати, больше всего лимонной кислоты содержится в недозрелых лимонах – около 7%.
Уже через 40 лет в Англии наладили первое в мире промышленное производство этой кислоты, причем, в качестве исходного сырья опять использовали сок цитрусовых. Впрочем, такой способ производства был мало выгоден – из тонны лимонов можно было получить всего 25 кг нужного вещества.
Поэтому химики стали искать другие способы его промышленного получения, и на это потребовалось почти 100 лет.
Задание для детективов
Задание 1
Напишите молекулярную, полную и сокращенную структурную формулу этой кислоты, учитывая, что ее модель выглядит следующим образом. Какие и сколько функциональных групп содержит молекула этой кислоты?
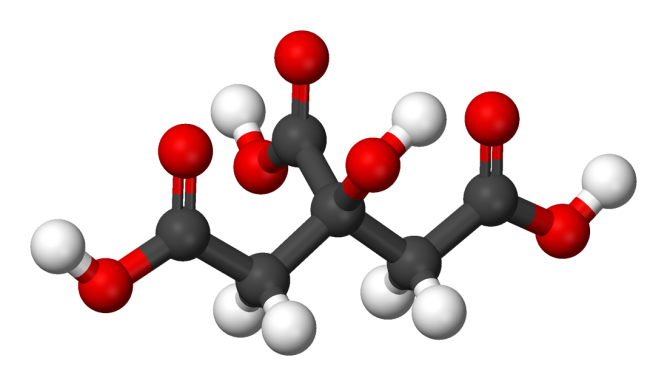
Задание 2
Вычислите массовые доли элементов в этой кислоте.
Задание 3
Проведите реакцию взаимодействия карбоната натрия с раствором этой кислоты. Что наблюдается? Почему для удаления налета в чайнике используют эту кислоту?
Дело №6
Улика №1
«Получена из жиров»
Впервые кислота эта получена в чистом виде и исследована фрацузским химиком-органиком Мишелем Шеврелем в 1811 г. Для ее получения сало или другой продукт, ее содержащий, обрабатываются гидратами щелочных или щелочноземельных металлов, серной кислотой или просто водой при высокой температуре для расщепления глицеридов на глицерин и свободные кислоты.
В соединении с глицерином в виде так называемых глицеридов эта кислота является главной составною частью твердых жиров, таких как сало баранье, бычье и пр., откуда она и получила свое название (στέαρ — сало).
Бараний жир может содержать до 30% этой кислоты. В менее значительном количестве она находится в полужидких жирах: в пальмовом масле, в обыкновенном коровьем масле и пр. В жидких маслах она или совершенно отсутствует, или же находится только в небольшом количестве.
Улика №2
«Мыло душистое»
Эта кислота является одной из наиболее распространенных и важных пищевых жирных кислот. В организме человека она стоит в рейтинге на третьем месте после олеиновой и пальмитиновой жирных кислот: 14% в крови и 4,2% в составе жировых депо.
В пищевой промышленности эту кислоту используют в качестве пищевой добавки – Е-570, наряду с олеиновой, пальмитиновой и другими жирными кислотами, в качестве стабилизатора, пеногасителя, глазирователя.

В косметической промышленности крема с помощью этой кислоты теряют прозрачность, становятся более густыми и плотными. Добавляется эта кислота и в мыло. Именно поэтому, мыло твердое.
В состав хозяйственного мыла входит несколько видов насыщенных и ненасыщенных жирных кислот. Их содержание указано на бруске. Они определяют его оттенок, запах и выраженность моющего действия. Среди насыщенных жирных кислот в мыле встречают пальмитиновую, стеариновую и лауриновую кислоты.
Улика №3
«Свеча горела…»
 Она – одна из наиболее тугоплавких жирных кислот: ее температура плавления составляет 69,60 С. Поэтому свечи делают из этой кислоты.
Она – одна из наиболее тугоплавких жирных кислот: ее температура плавления составляет 69,60 С. Поэтому свечи делают из этой кислоты.
Эта кислота относится к предельным одноосновным кислотам, в молекуле которой 18 атомов углерода
Задание для детективов
Задание 1
Составьте молекулярную формулу этой кислоты, вычислите массовые доли элементов в молекуле кислоты. Опишите физические свойства кислоты, исследуйте растворимость ее в воде.
Задание 2
Составьте реакцию образования соли данной кислоты – стеарата натрия.
Задание 3
Эту кислоту можно получить, действуя на стеарат натрия раствором уксусной кислоты. Составьте уравнение данной реакции.
Приложение 3.
Полезные ссылки
1. Артеменко А.И. Органическая химия и человек. Теорет. основы: Углубл. курс: Учеб. для общеобразоват. учреждений с углубл. изучением предмета. – М.: Просвещение, 2000. – 79 с.: ил.
2. Бердоносова, С.С.Менделеева Е.А. Химия. Современное учебное пособие для школьников и абитуриентов. – М.: ИЛЕКСА, 2013. – 352 с.: ил..
3. Государственная программа Российской Федерации «Развитие образования» на 2013–2020 годы: утв. постановлением Правительства Российской Федерации от 15 апреля 2014 г. № 295.
4. Журин А.А., Заграничная Н.А. Химия: метапредметные результаты обучения. 8-11 классы. - М.: ВАКО, 2014. – 208 с. – (Мастерская учителя химии).
5. Концепция развития международного детского центра «Артек» - «Артек 2.0 Перезагрузка». — Ялта: МДЦ «Артек», 2014. — 30 с. — URL:
[Электронный ресурс] – Режим доступа: http:// static.artek.org/static/file/razvitie_vert.pdf . Дата обращения: 15.04. 2017.
6. Химия в тестах, задачах, упражнениях: учебное пособие к учебнику О.С. Габриеляна / О.С. Габриелян, Т.В. Смирнова, С.А. Сладков. – М: Дрофа, 2015. – 286, с.:ил.
Дата добавления: 2019-02-22; просмотров: 377; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
