Образование галогенангидридов.
При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора (V), а также фосфорилхлоридом POCl3 образуются галогенангидриды, иначе называемые ацилгалогенидами:
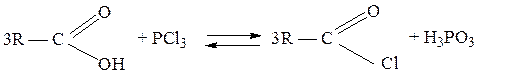
Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOCl2:
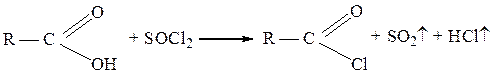
Образование ангидридов.
Под действием такого сильного водоотнимающего средства, как оксид фосфора (V), карбоновые кислоты превращаются в ангидриды:
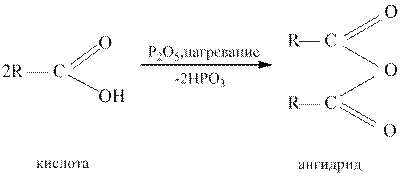
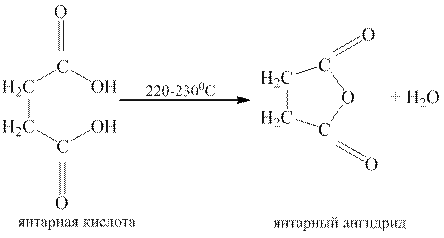
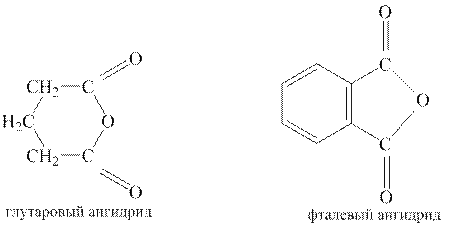
Ангидриды некоторых дикарбоновых кислот образуются при нагревании их и в отсутствие водоотнимающих средств. Важно, чтобы образующийся циклический ангидрид содержал пяти- или шестичленный цикл. Такие ангидриды образуют, например, янтарная, глутаровая и фталевая кислоты.
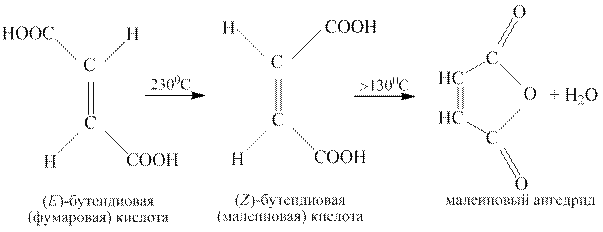
Легко образует ангидрид двухосновная ненасыщенная малеиновая кислота (Z-изомер бутендиовой кислоты), тогда как её Е-изомер – фумаровая кислота – ангидрида вообще не имеет. Тем не менее, при нагревании фумаровая кислота также превращается в ангидрид, но в малеиновый, предварительно изомеризуясь в малеиновую кислоту:
Образование амидов.
При нагревании аммониевых солей карбоновых кислот получаются амиды:
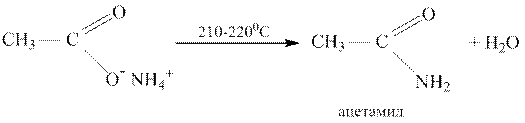
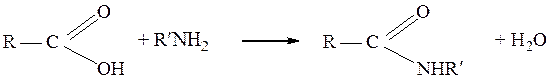
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
|
|
|
Отдельные представители карбоновых кислот.
Муравьиная кислота НСООН – жидкость с резким запахом. Соли и сложные эфиры муравьиной кислоты называются формиатами. Она обладает многими химическими свойствами карбоновых кислот, но ей присущи и некоторые специфические свойства.
Муравьиная кислота, в отличие от других карбоновых кислот, обладает восстановительными свойствами, легко окисляется при действии KMnO4 и Ag2O, при этом образуется оксид углерода (IV) и вода. При нагревании с концентрированной серной кислотой муравьиная кислота дегидратируется с образованием оксида углерода (II):
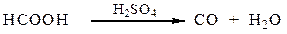
Акриловая кислота CH2 = CHCOOH – простейшая ненасышенная алифатическая карбоновая кислота. Соли и эфиры её называются акрилатами.
Акриловая кислота – типичный представитель α, β-ненасыщенных кислот, связь С = С в молекулах которых находится в сопряжении с карбонильной группой. Вследствие электроноакцепторного действия карбоксильной группы реакции электрофильного присоединения к двойной связи акриловой кислоты протекают против правила Марковникова:
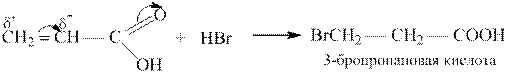
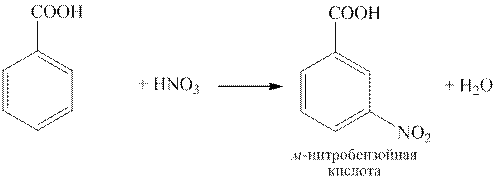
Бензойная кислота C6H5COOH – простейшая ароматическая карбоновая кислота. Соли и эфиры бензойной кислоты называются бензоатами. Как кислота она несколько сильнее уксусной вследствие электроноакцепторного действия фенильного радикала.
|
|
|
Бензойная кислота по химическим свойствам подобна карбоновым кислотам жирного ряда, но также ей присущи реакции электрофильного замещения (SE). Так как карбоксильная группа является ориентантом второго ряда, электрофильное замещение у бензойной кислоты проходит в мета-положение и весьма трудно:
Щавелевая кислота HOOC ─ COOH – простейшая дикарбоновая кислота, широко распространена в растительном мире. В виде солей содержится в листьях щавеля, кислицы, ревеня. Малорастворимая в воде кальциевая соль является составной частью почечных камней. Щавелевая кислота – одна из самых сильных органических кислот, соли и эфиры её называются оксалатами.
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия в оксид углерода (IV). Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. На восстановительных свойствах щавелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
|
|
|

Качественной реакцией для обнаружения щавелевой кислоты и её солей служит образование малорастворимого оксалата кальция.
Бутендиовая кислота HOOCCH = CHCOOH – простейшая ненасышенная дикарбоновая кислота. Существует в виде стероизомеров: цис-изомера (малеиновой кислоты) и транс-изомера (фумаровой кислоты). Эти кислоты отличаются по своим физическим и химическим свойствам.
Малеиновая кислота термодинамически менее устойчива, чем фумаровая. Поэтому при нагревании и под действием радикалобразующих веществ малеиновая кислота превращается в фумаровую.
Малеиновая кислота ядовита и среди природных соединений не найдена. Фумаровая кислота содержится во многих растениях.
Как фумаровая, так и малеиновая кислота при восстановлении дают одну и ту же янтарную кислоту:
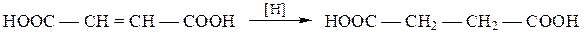 ,
,
и присоединяют воду с образованием яблочной кислоты:
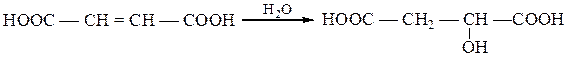
Дата добавления: 2019-02-12; просмотров: 75; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
