ОБРАБОТКА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
Процесс адиабатного расширения С -> D запишем, используя (18), в виде:
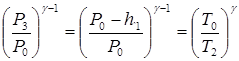
Приведем это уравнение к виду:
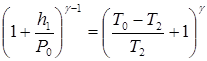
Поскольку h 1 / P 0и ( T 0 – T 2 )/ T 2 малые величины по сравнению с единицей, разложим обе скобки выражения в ряд, ограничившись слагаемыми первого порядка малости ((1 + х) п= 1 + пх):
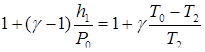
или
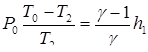 (24)
(24)
Процесс D ® Еосуществлялся при постоянном объеме (изохорный процесс). Поэтому:
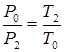
Т.к. Р2 = Р0 + h2 , запишем:
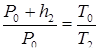
откуда следует, что
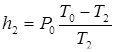 (25)
(25)
В итоге, используя (24), получим:
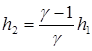 . (26)
. (26)
ВЫПОЛНЕНИЕ РАБОТЫ
1. Закрыть баллон пробкой и накачать баллон так, чтобы разность уровней жидкости в манометре составляла не менее 25 см.
2. Пережать трубку 5 и выждать 1-2 мин, пока газ в баллоне не примет температуру окружающей среды. При этом уровень жидкости в манометре перестанет изменяться. Произвести отсчет давления в баллоне h1 .
3. Вынув пробку, быстро выпустить воздух из баллона. Как только воздух перестанет выходить, тотчас закрыть пробку. От четкости этой операции зависит качество опыта.
4. Выдержать 1-2 мин, пока газ в баллоне не примет температуру окружающей среды. Произвести отсчет показания манометра h2.
5. Занести результаты в таблицу. Опыт повторить 10 раз.
Таблица
| № п/п | h1, см | h2, см | γ |
| 1. | |||
| 2. | |||
| … |
6. Вычислить значения γ по формуле (26). По статистическим формулам найти среднее значение <γ>, доверительную ∆γ и относительную ε погрешности. Результат записать в стандартном виде.
|
|
|
7. Сделайте вывод. Какому числу степеней свободы соответствует полученный результат (см. формулу (22))?
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте определение основным термодинамическим процессам: изотермическому, изобарическому, изохорическому, адиабатическому. Напишите уравнения этих процессов. 2. Нарисуйте диаграммы основных процессов в PV-координатах для различных температур газа.
3. Определите понятие внутренней энергии, работы, теплоты. Сформулируйте первое начало термодинамики.
4. Сформулируйте первое начало термодинамики для различных процессов. Выведите формулы вычисления работы, совершаемой газом в данных процессах.
5. Определите основные особенности адиабатического процесса. Объясните изменение температуры при адиабатическом процессе с позиции первого начала термодинамики.
6. От чего зависит показатель адиабаты? Вычислить теоретическое значение γ для одно-, двух-, и трехатомного газа.
7. Объясните методику эксперимента. Выведите рабочую формулу. Как изменился бы ход опыта при изменении значения γ?
|
|
|
ЛИТЕРАТУРА
[1] §§ 11-15, 22; [5] 4.1-4.10; [6] § 104; [8] стр. 512; [12] стр. 162-166.
ЛАБОРАТОРНАЯ РАБОТА № 2- 10
ИССЛЕДОВАНИЕ ФАЗОВОГО ПЕРЕХОДА I РОДА И ИЗМЕНЕНИЯ ЭНТРОПИИ НА ПРИМЕРЕ КРИСТАЛЛИЗАЦИИ ГИПОСУЛЬФИТА
ЦЕЛЬ. Ознакомиться с теорией фазовых переходов. Исследовать фазовый переход I рода на примере кристаллизации гипосульфита: снять кривую кристаллизации Т=f(t), определить удельную теплоту плавления (кристаллизации), вычислить изменение энтропии в процессе кристаллизации и последующего остывания.
ОБОРУДОВАНИЕ. Штатив, пробирка с исследуемым веществом, термопара в комплекте с мультиметром, стакан из термостойкого стекла с водой, кипятильник, секундомер.
КРАТКАЯ ТЕОРИЯ
1. Фазы вещества. Фазовые переходы.
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Примером двухфазной системы может служить вода и водяной пар над ее поверхностью в закрытом сосуде. Если в воду поместить кусочки льда, то система станет трехфазной, в которой лед представляет собой твердую (кристаллическую) фазу. Однако необходимо помнить, что понятие "фаза" имеет более широкий смысл, чем просто "агрегатное состояние" вещества; в пределах одного агрегатного состояния вещество может находиться в различных фазах, отличающихся по своим свойствам, составу и строению (например, лед встречается в природе в различных модификациях; α-железо и γ-железо, графит и алмаз отличаются структурой кристаллической решетки, что приводит к существенным различиям их макроскопических свойств). Переход вещества из одной фазы в другую называется фазовым переходом, он всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить как изменения агрегатного состояния вещества, так и переходы, связанные с изменением в структуре и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую: графит-алмаз).
|
|
|
Различают фазовые переходы I и II рода. Фазовый переход I рода (например, плавление, кристаллизация, испарение и т.п.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы I рода характеризуются постоянством температуры и скачкообразным изменением внутренней энергии, энтропии, плотности и т.д. Фазовые переходы II рода связаны со скачкообразным изменением производных этих величин (примером может служить переход железа в неферромагнитное состояние при температуре Кюри и т.п.)
|
|
|
Рассмотрим фазовый переход I рода на примере кристаллизации органического вещества - гипосульфита.
Процесс образования твердого тела при охлаждении жидкости называется кристаллизацией. Следует помнить, что в физике под твердым телом понимают именно кристаллическое тело; не все тела, имеющие постоянный объем и форму, являются, строго говоря, кристаллическими.
Установлению идеального порядка в расположении атомов, т.е. образованию твердого тела, препятствует тепловое движение, главной особенностью которого является хаотичность. Поэтому, для того, чтобы вещество могло находиться в твердом состоянии, его температура должна быть достаточно низкой, чтобы энергия теплового движения была меньше, чем потенциальная энергия взаимодействия атомов (молекул). Постоянство температуры в процессе кристаллизации объясняется выделением энергии, компенсирующей отвод тепла от вещества. На молекулярном уровне этот процесс можно описать следующим образом. При плавлении кристаллического вещества теплота, поступающая от нагревателя, идет не на увеличение кинетической энергии молекул (а, следовательно, и температуры вещества), а на разрыв межатомных связей. В обратном переходе (при остывании жидкости) образование кристаллической решетки сопровождается выделением этой энергии, называемой скрытой теплотой фазового перехода, что и обусловливает постоянство температуры в этом процессе.
На рис.1 приведен график зависимости температуры охлаждающейся жидкости от времени.
|
|
Участок 1 дает ход монотонного
понижения температуры жидкости.
Горизонтальный участок 2 соответствует процессу кристаллизации. После окончания кристаллизации температура, теперь уже твердого тела, начинает понижаться (участок 3).
При охлаждении аморфных тел скрытая теплота не выделяется, и график охлаждения представляет собой Рис. 1 монотонную кривую.
Для начала кристаллизации необходимо присутствие центра или центров кристаллизации. Такими центрами могли бы служить случайные скопления частиц жидкости, твердые частицы в виде пылинок. Образование центров кристаллизации в самой жидкости облегчается понижением температуры. Поэтому кристаллизация чистой жидкости, лишенной посторонних примесей, начинается обычно при температуре более низкой, чем истинная температура кристаллизации. Иначе говоря, жидкость может существовать в переохлажденном состоянии. Это состояние неустойчиво, т.к. случайное возникновение центров кристаллизации приведет к быстрой кристаллизации всей жидкости. Кристаллизацию переохлажденной жидкости можно вызвать, бросив в нее кристаллик того же вещества, иногда достаточно просто встряхнуть жидкость. Чем сложнее молекула вещества, тем меньше вероятность случайного центра кристаллизации. Поэтому органические жидкости сравнительно легко переохлаждаются, тогда как переохлаждение одноатомных металлических жидкостей, наблюдается очень редко.
Температура кристаллизации (и равная ей температура плавления) зависит от внешнего давления, обычно растет с ростом давления, за исключением тех немногих веществ (лед, германий, сурьма, висмут), у которых наблюдается аномальная зависимость Ткр от давления: с повышением давления Tкр понижается, а объем при отвердевании не уменьшается, а увеличивается.
2. Энтропия термодинамической системы. Изменение энтропии в фазовых переходах .
Согласно I началу термодинамики количество тепла δQ, сообщенное системе, идет на приращение внутренней энергии dU и на совершение работы δA над внешними телами:
δQ = dU + δA
Первое начало термодинамики определяет энергетический баланс при всяком превращении энергии (механической, электрической и т.п.) в тепловую и обратно. Однако этот закон не отвечает на вопрос: в каком направлении должны протекать процессы? Поэтому необходимо найти критерий направленности.
Как известно, состояние термодинамической системы может быть задано макропараметрами (P,V,T) - это макросостояние.
Каждое макросостояние системы может быть реализовано целой совокупностью микросостояний (когда задаются координаты и скорости всех частиц, составляющих систему).
Количественной характеристикой теплового состояния системы, описывающей стремление переходить в другие состояния, является число микроскопических состояний, которым это макросостояние может быть осуществлено. Это число называют статистическим весом, или термодинамической вероятностью W.
Вероятность того или иного макросостояния пропорциональна его статистическому весу. Равновесным является такое макросостояние системы, которое не имеет тенденции к изменению с течением времени. Поэтому равновесное состояние можно определить как состояние с максимальным статистическим весом. Замкнутая система стремится перейти в состояние с большим статистическим весом. Если она состоит из нескольких частей, ее статистический вес:
 (1)
(1)
где Wi - статистический вес i-й части; знак 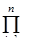 означает произведение n сомножителей.
означает произведение n сомножителей.
Статистический вес трудно рассчитать даже для такой термодинамической системы как идеальный газ, поэтому используют функцию состояния, называемую энтропией S. Согласно формуле, предложенной Больцманом
S = k lnW, (2)
где k - постоянная Больцмана.
Энтропия, как и статистический вес W, является функцией состояния системы, но в отличии от последнего она обладает свойством аддитивности. В самом деле, из (1) и (2) следует:
S = k lnW = S1 + S2 +...+ Sn. (3)
То есть, энтропия сложной системы равна сумме энтропий отдельных ее частей. Если состояние системы упорядоченно, то оно осуществляется единственным способом и его термодинамическая вероятность Wуп = 1, энтропия Sуп = 0. Любое другое состояние является беспорядочным, или случайным. Чем больше степень беспорядка, тем больше энтропия. Таким образом, энтропия является количественной мерой степени молекулярного беспорядка в системе.
Энтропия изолированной системы постоянна, если в системе протекают только обратимые процессы (т.к. W - const). В реальной изолированной системе процессы необратимы и энтропия возрастает. Поэтому для изолированной системы справедливо неравенство:
D S 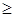 0. (4)
0. (4)
Знак равенства соответствует обратимым процессам, знак неравенства необратимым.
Это утверждение является более точной количественной формулировкой II начала термодинамики: энтропия изолированной системы не убывает.
Реальные процессы, таким образом, протекают в определенном направлении. Более глубокий теоретический анализ позволяет установить соотношение, которое связывает изменение dS энтропии тела при бесконечно малом обратимом изменении его состояния с количеством получаемой им в этом процессе теплоты d Q:
dS = d Q/T (5)
где Т - температура тела.
Изменение энтропии системы при обратимом конечном переходе из состояния 1 в состояние 2 может быть вычислено:
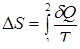 (6)
(6)
Изменение энтропии в процессе кристаллизации. В процессе кристаллизации теплота отводится от тела ( d Q < 0), поэтому изменение энтропии отрицательно (Δ S< 0). Следовательно, энтропия жидкости больше, чем твердого тела. Это объясняется тем, что система переходит из состояния с большим числом степеней свободы в состояние с меньшим их числом (система в этом случае не теплоизолирована). В кристаллической решетке ионы могут совершать только колебательное движение, другими словами, имеют лишь колебательные степени свободы, тогда как частицы жидкости приобретают возможность двигаться поступательно, что и соответствует увеличению степеней свободы. Очевидно, что процесс плавления будет происходить аналогично, но d Q> 0, и следовательно, энтропия будет возрастать ( d S>0), т.к. фазовый переход происходит изотермически при Тпл = Ткр, то
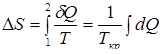 (7)
(7)
Причем количество поглощенной (отведенной) теплоты во всем процессе может быть выражено через удельную теплоту плавления (кристаллизации) λ:
Q =  dQ = λm,
dQ = λm,
изменение энтропии
D S = l m / T кр (8)
Изменение энтропии при остывании твердого тела:
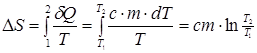 (9)
(9)
где Т1, Т2 - температура начального и конечного состояния, с - удельная теплоемкость твердого тела, m - масса вещества.
В настоящей работе необходимо, используя формулы (8), (9), вычислить изменение энтропии в процессе кристаллизации и остывании твердого тела.
МЕТОДИКА ЭКСПЕРИМЕНТА
1. Снятие кривой охлаждения гипосульфита.
Одним из возможных способов исследования фазовых превращений является построение диаграммы плавления-кристаллизации, которая представляет собой зависимость температуры вещества от времени Т=f(t) (см. рис 1). Для ее получения сосуд с исследуемым веществом помещают в печь (для легкоплавких веществ можно использовать горячую воду) и, нагревая его, измеряют через определенные промежутки времени (или непрерывно с помощью самописца) температуру вещества в сосуде.
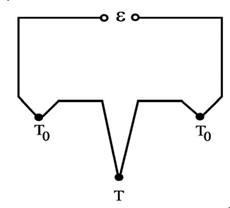
В качестве термометра, находящегося в непосредственном контакте с исследуемым веществом, используют термопару. Действие термопары основано на том, что в спае двух разнородных проводников возникает контактная термоэлектродвижущая сила (ТЭДС), примерно пропорциональная температуре спая. Чаще всего приходится использовать не менее трех материалов: два - для электродов термопары и один - для обмотки измерительного прибора, что дает несколько спаев. Обычно используют схему, показанную на рис.2.
|
|
Так называемый "горячий" спай Т приводят в контакт с испытуемым телом.
Оба холодных спая То должны находиться при одинаковой и известной температуре. ТЭДС в первом приближении пропорциональна разности температур:
ε ~ kT(T - To)
Рис. 2
Коэффициент k Т определяют путем градуировки термопары. В данной работе роль холодных сплавов выполняют контакты с клеммами измерительного прибора (мультиметра), которые имеют комнатную температуру. В электронной схеме мультиметра предусмотрена поправка на комнатную температуру, что позволяет давать на индикаторе температуру нагреваемого тела в градусах Цельсия.
2. Определение удельной теплоты кристаллизации (плавления).
При достаточно медленном нагревании можно считать, что температуры образца и пробирки одинаковы во всех точках. Если тепловая мощность, подводимая к образцу, может считаться постоянной, то ось времени на диаграмме N = f(t) является одновременно и осью теплоты, поглощенной веществом и пробиркой. Тепловая мощность N, конечно, не равна мощности нагревателя из-за рассеяния тепла в окружающую среду.
Левая и правая убывающие части кривой на рис.1 изображают охлаждение расплава и пробирки и охлаждение твердого вещества и пробирки. Тепловая мощность на любом из этих участков равна изменению внутренней энергии системы за 1 с.
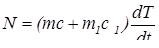 (10)
(10)
Массы исследуемого вещества m и пробирки m1, а также их удельные теплоемкости вблизи температуры кристаллизации считаем известными.
Горизонтальный участок на рис. 1 изображает процесс кристаллизации. Ордината его - температура кристаллизации (плавления), а приращение абсциссы - время фазового перехода t фп. Здесь выполняется равенство
N· t фп = λm (11)
где l- удельная теплота кристаллизации.
Исключив N из формул (10) и (11) находим:
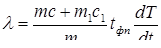 (12)
(12)
гдескорость остывания системы "вещество-пробирка" на участке 3.
Построив диаграмму кристаллизации, определяют из нее t фп и dT / dt
Подставляя в формулу (12) эти данные, вычисляют удельную теплоту кристаллизации λ.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1. Поместите пробирку с исследуемым веществом в химический стакан с водой.
2. Термопару опустите в пробирку, обеспечив надежный контакт с веществом, подключите ее к мультиметру.
3. Опустите в стакан кипятильник так, чтобы спираль до метки была погружена в воду. Включите кипятильник в сеть ~ 220 В.
4. Произведите нагрев вещества до температуры, на 10-20о превышающей температуру плавления.
5. Выключите кипятильник, выньте пробирку с исследуемым веществом из воды.
6. Снимите кривую охлаждения. Для этого через каждые 20 с. производите измерения температуры охлаждающегося вещества.
7. Постройте график зависимости температуры от времени Т=f(t) Выделите на графике участок Tкр = const и определите графически время кристаллизации t фп . На участке диаграммы, соответствующей остыванию твердого вещества, определите скорость остывания dT/ dt
Принять теплоемкости стекла и кристаллического гипосульфита равными, соответственно:
С 1 = 0,213 кал/г· K.
С = 0,377 кал/г ·K
Используя эти данные, по формуле (12) вычислите удельную теплоту кристаллизации l.
8. Вычислите изменение энтропии при кристаллизации и охлаждении гипосульфита до комнатной температуры (t ком = 25оС).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте определение фазы и фазового перехода.
2. Перечислите основные свойства фазовых переходов I и II рода.
3. Дайте определение функции состояния и приведите примеры.
4. Сформулируйте второе начало термодинамики. Объясните его, основываясь на молекулярно-кинетической теории строения вещества.
5. Каким образом можно рассчитать изменение энтропии при плавлении и кристаллизации твердых тел?
6. Каков характер температурной кривой при плавлении и отвердевании для кристаллических и аморфных тел?
7. Объясните принцип работы термопары.
ЛИТЕРАТУРА
[1] §§ 40-42, 111-113, 116, 120;
[2] § 131;
[3] §§ 117, 121-122;
[6] §§ 107, 120, 125;
[13] стр. 128-131.
ЛАБОРАТОРНАЯ РАБОТА № 2-11
Дата добавления: 2019-02-12; просмотров: 252; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!