Основные термодинамические процессы.
Состояние термодинамической системы называется равновесным, если параметры Р, V , Т, а также число частиц N в системе с течением времени не меняются.
Всякое изменение термодинамических параметров системы называется термодинамическим процессом. Простейшие процессы (изотермический, изобарный, изохорный) протекают при постоянстве одного из термодинамических параметров.
Изохорный процесс, протекающий при постоянном объеме, для идеального газа описывается уравнением:
Р/Т= const. (5)
Это равенство справедливо для любых точек, лежащих на одной изохоре. Величина константы определяется количеством вещества и объемом газа. Как следует из уравнения состояния,
 (6)
(6)
В данном процессе AV = 0 и работа не совершается, следовательно, I начало термодинамики для него может быть записано:
Q = D U , (7)
т.е. все сообщенное газу тепло идет на увеличение его внутренней энергии.
Изобарный процесс (Р= const) для идеального газа описывается уравнением:
V/T = const, (8)
что справедливо для любых состояний газа при неизменном давлении Р и постоянной массе. Величину константы найдем аналогично формуле (6):
 (9)
(9)
Первое начало термодинамики для данного процесса выглядит
|
|
|
следующим образом:
Q = D U + A, (10)
где 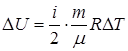 (11)
(11)
A = P ∆V . (12)
Изотермический процесс для идеального газа описывается уравнением:
РV = const. (13)
Этот процесс протекает при T = const. Если масса системы остается неизменной, то для двух состояний можно записать:
P1V1 = P2V2 . (14)
Первое начало термодинамики для данного процесса имеет вид:
Q = A , (15)
так как ∆U = 0. Следовательно, все сообщенное газу тепло превращается в работу.
Процесс, происходящий без теплообмена с окружающей средой, называется адиабатическим. При адиабатном процессе параметры газа изменяются таким образом, что
PV g = const . (16)
Это уравнение называется уравнением Пуассона. Величина g называется адиабатической постоянной, или показателем адиабаты.
Поскольку PV = RT для одного моля газа, уравнение адиабаты можно
записать еще в двух видах:
|
|
|
TV g -1 = const , (17)
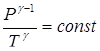 (18)
(18)
Так как g > 1, то из (17, 18) следует, что при адиабатическом сжатии газ нагревается, а при адиабатическом расширении - охлаждается.
Показатель адиабаты g равен отношению теплоемкостей при постоянном объеме СV и постоянном давлении СP :
g = C p / Cv . (19)
Для идеального газа, молекула которого имеет i степеней свободы, молярная теплоемкость СV при постоянном объеме определяется выражением:
 (20)
(20)
а молярная изобарная теплоемкость Ср выражением:
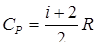 (21)
(21)
Из равенств (20) и (21) выразим g :
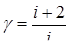 ------- (22)
------- (22)
Полагая в уравнении (4) Q = 0, первое начало термодинамики для данного процесса будет выглядеть следующим образом:
А = - D U. (23)
Из этого выражения следует, что при положительной работе газа (расширение) температура системы будет уменьшаться, т.к. А=СV (Т1 - Т2). При совершении работы А ¢над газом (сжатие) температура системы увеличится, потому что А¢= - А = СV (Т2 - Тj).
|
|
|
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе используется метод Клемана - Дезорма. Установка состоит из стеклянного сосуда 1, соединенного с водяным манометром 2 и насосом 3. Баллон закрыт пробкой 4, зажим на трубке 5 отсекает баллон от насоса.
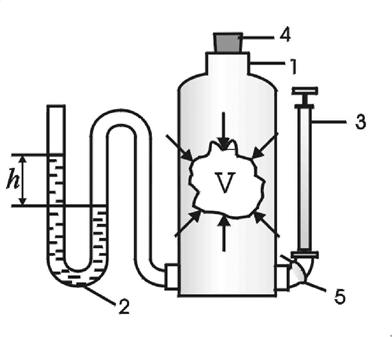
Рис. 1. Схема установки
Выделим в баллоне некоторую постоянную массу газа. В начальном состоянии газ находится при атмосферном давлении р0, имеет температуру окружающей среды Т0 и занимает объем V0 (состояние «А» - рис.2).
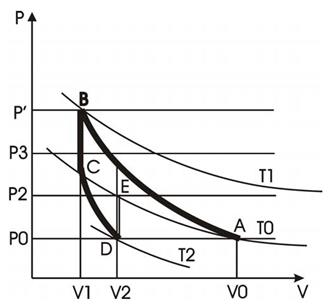
Рис.2. Диаграмма рабочего цикла.
1. Быстро накачайте воздух в баллон. Теплообменом через стенки сосуда с окружающей средой можно пренебречь, поэтому процесс А-В можно считать адиабатическим. В конце процесса параметры газа будут p’, V1 и T1. Давление газа будет выше атмосферного, а температура - выше комнатной.
2. Если прекратить накачивать воздух и перекрыть трубку 5, то вследствие теплообмена через стенки сосуда будет происходить изохорное охлаждение газа В-С. Процесс закончится, когда температура газа сравняется с температурой окружающей среды.
Процессы А-В и В-С является подготовительными. Их цель-создать состояние газа с комнатной температурой Т 0 и повышенным давлением р3.
|
|
|
3. Вынув пробку 4, быстро выпустите воздух из баллона. Так как процесс протекает быстро, теплообмен с окружающей средой будет мал. Поэтому процесс С-D можно считать адиабатическим. Давление упадет до атмосферного р0, температура понизится до Т2. Процесс описывается уравнением Пуассона.
4. Сразу после окончания расширения газа сосуд следует закрыть пробкой. После этого за счет теплообмена будет происходить изохорное нагревание газа D-E до комнатной температуры Т0. Давление газа повысится до значения р2.
Идея метода основана на том, что снижение температуры газа при адиабатическом расширении C-D и последующее повышение давления D-E определяются значением показателя адиабаты.
Манометр 2 измеряет разность давлений
D p = p - p o = h,
где h - разность уровней жидкости в манометре (давление в см. вод. ст.)
Дата добавления: 2019-02-12; просмотров: 156; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
