Варианты заданий самостоятельной работы
| № ва-ри-ан-та | Номера задач | № ва-ри-ан-та | Номера задач | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 1 | 1 | 9а | 11 | 90 | 50 | 67 | 113 | 22а | 14 | 5к | 9о | 20е | 40б | 63 | 80 | 100 | 24в |
| 2 | 2 | 9б | 12 | 81 | 51 | 68 | 112 | 22б | 15 | 6а | 10а | 20ж | 41 | 64 | 81 | 99 | 28 |
| 3 | 3 | 9в | 13 | 82 | 52 | 69 | 111 | 22в | 16 | 6б | 10б | 21а | 42 | 65 | 82 | 98 | 29 |
| 4 | 4а | 9г | 14 | 83 | 53 | 70 | 110 | 22г | 17 | 7а | 10в | 21б | 43 | 66 | 83 | 97 | 30 |
| 5 | 5а | 9д | 15 | 84 | 54 | 71 | 109 | 22д | 18 | 7б | 10г | 21в | 44 | 50 | 84 | 96 | 31 |
| 6 | 5б | 9е | 16 | 34 | 55 | 72 | 108 | 22е | 19 | 7в | 10д | 21г | 45 | 51 | 85 | 95 | 32 |
| 7 | 5в | 9ж | 17 | 35 | 56 | 73 | 107 | 22ж | 20 | 7г | 10е | 21д | 46 | 52 | 86 | 94 | 33 |
| 8 | 5г | 9з | 18 | 36 | 57 | 74 | 106 | 22л | 21 | 8 | 19а | 21е | 47 | 53 | 87 | 93 | 23а |
| 9 | 5д | 9и | 20а | 37 | 58 | 75 | 105 | 22и | 22 | 4б | 19б | 21ж | 48 | 54 | 88 | 92 | 23б |
| 10 | 5е | 9к | 20б | 38а | 59 | 76 | 104 | 22к | 23 | 4в | 19в | 21з | 49 | 55 | 89 | 91 | 23в |
| 11 | 5ж | 9л | 20в | 38б | 60 | 77 | 103 | 25 | 24 | 9п | 19г | 21и | 36б | 56 | 90 | 113 | 24а |
| 12 | 5з | 9м | 20г | 39 | 61 | 78 | 102 | 26 | 25 | 9с | 19д | 21к | 36в | 57 | 91 | 112 | 125 |
| 13 | 5и | 9н | 20д | 40а | 62 | 79 | 101 | 27 | |||||||||
Примеры решения задач
Пример1. В образцах природной воды содержатся соли:
1)Ca(HCO3)2; 2) MgSO4; 3) KCl; 4) KHCO3; 5) Na2SO4.
Укажите номер образца воды с постоянной жесткостью.
Решение:Известно, что жесткость воды обусловлена присутствием в ней растворимых солей кальция и магния. В зависимости от природы анионов жесткость подразделяют на карбонатную (или временную) и некарбонатную (постоянную). Исходя из указанного образец воды с постоянной жесткостью будет под номером 2) MgSO 4 .
|
|
|
Ответ: 2) MgSO 4 .
Пример 2 Вычислите общую жесткость воды , если в 2 л её находится по
800 мг ионов Mg 2+ и Ca 2+;
Решение:Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле

где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
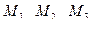 – эквивалентные массы ионов металлов (или их солей), мг/экв;
– эквивалентные массы ионов металлов (или их солей), мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу
 33,33 + 20 = 53,33 мэкв/л
33,33 + 20 = 53,33 мэкв/л
Ответ: общая жесткость равна 53,33 мэкв/л
Пример 3 Рассчитайте общую жесткость воды, в 1 л которой содержится 360 мг гидрокарбоната магния и 24 мг гидрокарбоната кальция.
Решение: Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле

где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
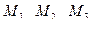 – эквивалентные массы ионов металлов (или их солей), мг/экв;
– эквивалентные массы ионов металлов (или их солей), мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу
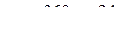 4,93 + 0,3 = 5,23 мэкв/л
4,93 + 0,3 = 5,23 мэкв/л
Ответ: общая жесткость равна 5,23 мэкв/л.
Пример 4 Чему равна жесткость воды, если на титрование 100 мл образца её израсходовано: б) 12 мл 0,04 н раствора HCl?
|
|
|
Решение:Временная жесткость воды определяется по объёму кислоты, пошедшей на её титрование:
НСО3- + НС1 = Н2О + СО2↑ + С1-
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
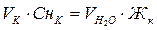 ,
,
где  – объём кислоты, пошедшей на титрование, мл;
– объём кислоты, пошедшей на титрование, мл;
 – объём пробы воды, взятой для титрования, мл;
– объём пробы воды, взятой для титрования, мл;
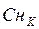 – нормальная концентрация кислоты, экв./л;
– нормальная концентрация кислоты, экв./л;
Отсюда:
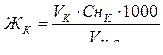 =
= 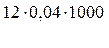 = 4,8мэкв/л.
= 4,8мэкв/л.
Ответ: жесткость равна 4,8мэкв/л.
Пример 5 Постоянную жесткость воды устраняют:
1) кипячением; 2) действием соляной кислоты; 3) действием щелочи;
4) действием соды; 5) действием азотной кислоты.
Решение:Правильный ответ укажем 4) действием соды, реакция
СаSO4 + Na2CO3 = CaCO3↓ + Na2SO4.
Ответ: 4) действием соды.
Пример 6 Какую массу (г) соды Na 2 CO 3 надо прибавить к 30 л воды, чтобы устранить общую жесткость воды, равную 4,64 мэкв/л?
Решение:Для расчетов используется следующая формула:
 ; 4,64=
; 4,64= 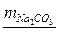 ; отсюда
; отсюда
m(Na2CO3) = 7377,6 мг = 7,4 г
Ответ: m(Na2CO3) = 7,4 г
|
|
|
Пример 7 Для умягчения 200 л воды потребовалось 15,9 г Na 2 CO 3. Чему равна жесткость воды (в мэкв/л)?
Решение:используется следующая формула:
 ; Ж=
; Ж= 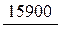 = 1,5 мэкв/л.
= 1,5 мэкв/л.
Ответ: Ж = 1,5 мэкв/л.
Дата добавления: 2018-11-24; просмотров: 320; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
