Список рекомендуемой литературы
1. Карапетьянц М.Х., Дракин С.И.. Общая и неорганическая химия.- М.: Химия, 2001.- 632 с.
2. Зайцев О.С. Задачи и вопросы по химии.- М.: Химия, 1985.- 301 с.
3. Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия, 2004.- 270 с.
4. Гольбрайх З.Е. Сборник задач и упражнений по химии.- М.: Высшая школа, 2004.- 224 с.
Задание № 7
По теме: «Окислительно–осстановительные реакции. Электрохимия»
Задания
1. Подберите коэффициенты в следующих реакциях ионно-электронным методом. Укажите окислитель и восстановитель, определите направление протекания реакции и вычислите э.д.с.
2. Вычислите э.д.с. гальванического элемента, составленного из стандартных электродов. Определите направление тока во внешней цепи указанного гальванического элемента Me|Me+n||Me+n|Me
Нa каком электроде будет идти растворение металла?
3. Какой металл будет подвергаться коррозии, если заданная пара металлов, находящихся в контакте, попадет в кислую среду? Составьте схему образующегося при этом гальванического элемента.
4. Какой металл является анодным (катодным) по отношению к покрываемому металлу? Составьте уравнения реакций, протекающих при атмосферной коррозии (во влажном воздухе).
5. Определите электродный потенциал электрода, в котором металлическая пластинка погружена в раствор собственной соли с заданной концентрацией катионов.
6. Составьте схемы электролиза водного раствора заданного вещества
|
|
|
а) с инертным анодом.
б) с использованием активного анода
Задания с первого по шестой «б» выполняются на основании таблицы
| № вари-антов | Номера заданий | |||||||
| 1 реак-ции | 2 | 3 | 4 | 5 | 6а | 6б | Приме-ча-ние | |
| 1 | 1, 4, 89 | Cu|Cu+2||Fe+2|Fe | Na/Ba | Fe покрыт Ni Fe покрыт Mn | Pb|Pb+2 0,0012 н | NaOH | Zn | |
| 2 | 2, 6, 87 | Fe|Fe+2||Zn+2|Zn | Ca/Ni | Zn покрыт AI Zn покрыт Cd | Zn|Zn+2 2 М | BaCI2 | Ag | |
| 3 | 3, 8, 88 | Mg|Mg+2||Fe+2|Fe | Sr/Ca | Mg покрыт Ca Mg покрыт Zn | Ni|Ni+2 2 М | HNO3 | AI | |
| 4 | 5, 12,34 | Mg|Mg+2||Zn+2|Zn | Cu/Fe | Mn покрыт Mg Mn покрыт Fe | Zn|Zn+2 2 н | KNO3 | Ni | |
| 5 | 7, 16,79 | Zn|Zn+2||Sn+2|Sn | Zn/Sn | Pb покрыт Cu Pb покрыт Cо | Zn|Zn+2 0,001 М | NaBr | Fe | |
| 6 | 9, 19,37 | Zn|Zn+2||AI+3|AI | Fe/Ag | AI покрыт Sr AI покрыт Cu | Cd|Cd+2 0,1 М | Ba(NO3)2 | Cu | |
| 7 | 10, 21,44 | Ag|Ag+||Mg+2|Mg | Na/Ag | Cr покрыт Mn Cr покрыт Sn | Ag|Ag+ 1 н | Zn(NO3)2 | Co | |
| 8 | 11, 32,50 | AI| AI+3||Mg+2|Mg | AI/Ag | Cd покрыт Mg Cd покрыт Pb | Fe|Fe+2 0,002 н | AICI3 | Pb | |
| 9 | 13, 36,42 | Pb|Pb+2||Ni+2|Ni | Ni/Pb | Ni покрыт Zn Ni покрыт Cu | Cu|Cu+2 0.1 н | Cu(NO3)2 | Mn | |
| 10 | 14, 28,56 | Mn|Mn+2||Ni+2|Ni | Na/Zn | Fe покрыт Zn Fe покрыт Cu | Ag|Ag+ 2 н | Pb(NO3)2 | Mg | |
| 11 | 15, 39,43 | Pb|Pb+2||Ag+|Ag | Mn/Ni | Zn покрыт Ag Zn покрыт Mg | Cd|Cd+2 0,01 М | AI(NO3)3 | Sn | |
| 12 | 17, 48,51 | AI| AI+3||Sn+2|Sn | Pb/Fe | Pb покрыт Bi Pb покрыт Ni | Cu|Cu+2 0,2 М | AgNO3 | AI | |
| 13 | 18, 53,60 | Sn|Sn+2||Cu+2|Cu | Ca/AI | AI покрыт Mg AI покрыт Pb | Ag|Ag+ 0,02 М | MnCI | Zn | |
| 14 | 20, 64,63 | Zn|Zn+2||Ni+2|Ni | Mn/Sn | Ni покрыт Cr Ni покрыт Ag | Cu|Cu+2 2 М | Sn(NO3)2 | Ag | |
| 15 | 22, 67,70 | Cu|Cu+2||AI+3|AI | Zn/Ni | Mg покрыт Ca Mg покрыт Cu | Sn|Sn+2 0,0045 М | Ni(SO4)2 | Fe | |
| 16 | 23, 68,78 | Zn|Zn+2||Pb+2|Pb | AI/Cu | Sb покрыт Cr Sb покрыт Ag | Zn|Zn+2 0,01 М | H2SO4 | Pb | |
| 17 | 30, 65,66 | Zn|Zn+2||Ag+|Ag | Na/Zn | AI покрыт Ca AI покрыт Zn | Sn|Sn+2 2 М | Na2SO4 | Mg | |
| 18 | 31, 73,62 | Ag|Ag+||Sn+2|Sn | Zn/Ag | Fe покрыт Ni Feпокрыт Mn | Ni|Ni+2 0,014 н | ZnSO4 | Mn | |
| 19 | 35, 61,72 | Mn|Mn+2||Pb+2|Pb | Na/Fe | Zn покрыт Cd Zn покрыт AI | Ag|Ag+ 2 М | KOH | Fe | |
| 20 | 38, 80,69 | Ni|Ni+2||AI+3|AI | Mn/Ni | Mg покрыт Ca Mg покрыт Zn | Cu|Cu+2 0,05 М | CuCI2 | Cu | |
| 21 | 40, 82,71 | Ni|Ni+2||Ag+|Ag | Zn/Pb | Mn покрыт Fe Mn покрыт Mg | Cd|Cd+2 3 М | HCI | Ni | |
| 22 | 45, 81,41 | Ni|Ni+2||Cu+2|Cu | Mn/Pb | Pb покрыт Cr Pb покрыт Cu | Fe|Fe+2 0,15 М | Na2CO3 | Co | |
| 23 | 46, 84,77 | AI|AI+3||Fe+2|Fe | Ag/K | AI покрыт Cu AI покрыт Ca | Ni|Ni+2 0,002 н | NiCI2 | Pb | |
| 24 | 47, 83,58 | Pb|Pb+2||Cu+2|Cu | Ni/K | Cr покрыт Sn Cr покрыт Mn | Zn|Zn+2 0,21 М | Ca(NO3)2 | Ag | |
| 25 | 24,49,74 | Zn|Zn+2||Pb+2|Pb | Fe/Mg | Cd покрыт Cd Cd покрыт Mg | Pb|Pb+2 0,1 н | MgBr2 | Zn | |
| 26 | 52, 25,85 | Mn|Mn+2||Fe+2|Fe | Zn/Pb | Ni покрыт Cu Ni покрыт Zn | Mn|Mn+2 0,005 М | AgNO3 | AI | |
| 27 | 54,29,86 | Mg|Mg+2||Pb+2|Pb | Sn/Mn | Fe покрыт Ag Fe покрыт Zn | Mg|Mg+2 2 М | NiBr2 | Ni | |
| 28 | 26,33,75 | Pb|Pb+2||Cu+2|Cu | Pb/Na | Zn покрыт Cu Zn покрыт Mg | AI|AI+3 0.003 н | FeCI2 | Co | |
| 29 | 55, 59,76 | Cr|Cr+3||Cu+2|Cu | Ag/Cu | Fe покрыт Ni Fe покрыт Mn | Pb|Pb+2 0,012 н | PbCI2 | Ag | |
| 30 | 57, 27,90 | Cr|Cr+3||Mg+2|Mg | Mg/Cu | Zn покрыт AI Zn покрыт Cd | Zn|Zn+2 0,4 М | MgI2 | AI | |
|
|
|
|
|
|
Примеры ОВР для самостоятельного решения
1. FeS + HNO3  Fe(NO3)3 + NO + H2SO4+ H2O
Fe(NO3)3 + NO + H2SO4+ H2O
2. KJ + (NH4)2Cr2O7 + H2SO4  J2 + Cr2(SO4)3 + (NH4)2SO4 + K2SO4 + H2O
J2 + Cr2(SO4)3 + (NH4)2SO4 + K2SO4 + H2O
3. PH3 + KMnO4 + H2SO4  H3PO4 + MnSO4 + K2SO4 + H2O
H3PO4 + MnSO4 + K2SO4 + H2O
4. MnO2 + KC1O3 + KOH  K2MnO4 + KC1 + H2O
K2MnO4 + KC1 + H2O
5. C3H5(OH)3 + K2Cr2O7 + H2SO4  CO2 + Cr2(SO4)3 + K2SO4 + H2O
CO2 + Cr2(SO4)3 + K2SO4 + H2O
6. CoCl2 + K2S2O8 + KOH  Co2O3 + K2SO4 + KC1 + H2O
Co2O3 + K2SO4 + KC1 + H2O
7. C2H2 + KMnO, + H2SO4  CO2 + K2SO4 + MnSO4 + H2O
CO2 + K2SO4 + MnSO4 + H2O
8. K2MnO4 + Na2SO3 + H2O  MnO2 + Na2SO4 + KOH
MnO2 + Na2SO4 + KOH
9. NO3 + Р + H2O  H3PO4 +NO
H3PO4 +NO
10. BaFeO4 + KJ + HC1  FeCl2 + BaCl2 + J2 + KC1 + H2O
FeCl2 + BaCl2 + J2 + KC1 + H2O
11. CrO3 + H2O2 + H2SO4  Cr2(SO4)3 + H2O + O2
Cr2(SO4)3 + H2O + O2
12. FeCl3 + H2O2 + KOH  K2FeO4 + KC1 + H2O
K2FeO4 + KC1 + H2O
13. KOH + Cl2  KC1 + KC1O3 + H2O
KC1 + KC1O3 + H2O
14. Na2WO4 + FeSO4 + H2SO4  WO2 + Fe2(SO4)3 + Na2SO4 + H2O
WO2 + Fe2(SO4)3 + Na2SO4 + H2O
15. HJO3+HJ  J2+H2O
J2+H2O
16. КВrO + MnCl2 + KOH  KBr + MnO2 + KC1 + H2O
KBr + MnO2 + KC1 + H2O
17. NaNO2 + NaJ + H2SO4  NO + J2 + Na2SO4 + H2O
NO + J2 + Na2SO4 + H2O
18. J2 + Cl2 + H2O  HJO3 + HC1
HJO3 + HC1
19. N2H4 + AgNO3 + KOH  N2 + Ag + KNO3 + H2O
N2 + Ag + KNO3 + H2O
20. HNO2 + KMnO4 + H2SO4  HNO3 + MnSO4 + K2SO4 + H2O
HNO3 + MnSO4 + K2SO4 + H2O
21. KNO3 + Al + KOH + H2O  NH3 + KAIO2
NH3 + KAIO2
22. Au + HNO3 + HC1  AuCl3 + NO +H2O
AuCl3 + NO +H2O
23. Pt + HNO3 + HC1  PtCL2, + NO + H2O
PtCL2, + NO + H2O
24. As2O3 + Zn + H2SO4  AsH3 + ZnSO4 + H2O
AsH3 + ZnSO4 + H2O
25. K3AsO4 + KJ + H2SO4  K3 AsO3 + J2 + K2SO4 + H2O
K3 AsO3 + J2 + K2SO4 + H2O
26. KJ + H2O + O3  J2+ KOH + O2
J2+ KOH + O2
27. Br2+ C12+ H2O  HBrO3 + HC1
HBrO3 + HC1
28. C1O2+ KOH  KC1O3 + KC1O2+ H2O
KC1O3 + KC1O2+ H2O
29. KMnO4 + H2O2 + H2SO4  MnSO4 + O2 + K2SO4 + H2O
MnSO4 + O2 + K2SO4 + H2O
30. SO2 + Br2 + H2O  HBr + H2SO4
HBr + H2SO4
31. J2 + KOH  KJO3 + KJ + H2O
KJO3 + KJ + H2O
32. KMnO4 + KOH  K2MnO4 + O2 + H2O
K2MnO4 + O2 + H2O
33. Bi2S3 + HNO3  Bi(NO3)3 + NO + S + H2O
Bi(NO3)3 + NO + S + H2O
|
|
|
34. NiS + H2O2 + H2SO4  S + NiSO4 + H2O
S + NiSO4 + H2O
35. Cr2(SO4)3 + K2S2O8+ H2O  K2Cr2O7 + K2SO4 + H2SO4
K2Cr2O7 + K2SO4 + H2SO4
36. AgNO3 + AsH3 + H2O  Ag + H3 AsO4 + HNO3
Ag + H3 AsO4 + HNO3
37. K2Cr2O7 + HCl 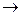 CrCl3 + Cl2 + KCl + H2O
CrCl3 + Cl2 + KCl + H2O
38. KJO3 + Cl2 + KOH  K3JO6 + H2O + KC1
K3JO6 + H2O + KC1
39. Na2SeO3 + Cl2 + NaOH  Na2SeO4 + NaCl + H2O
Na2SeO4 + NaCl + H2O
40. AsH3 + KMnO4 + H2SO4  H3AsO4 + MnSO4 + K2SO4 + H2O
H3AsO4 + MnSO4 + K2SO4 + H2O
41. Hg + NaNO3 + H2SO4  Na2SO4 + Hg2SO4 + NO + H2O
Na2SO4 + Hg2SO4 + NO + H2O
42. H2C2O4 + KC1O3  K2CO3 + CO2 + C1O2 + H2O
K2CO3 + CO2 + C1O2 + H2O
43. Mn(NO3)2 + PbO2 + HNO3  HMnO4 + Pb(NO3)2 + H2O
HMnO4 + Pb(NO3)2 + H2O
44. КClO3 + FeCl2 + HC1  KC1 + FeCl3 + H2O
KC1 + FeCl3 + H2O
45. K2Cr2O7 + NaNO2 + H2SO4 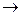 Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
Cr2(SO4)3 + NaNO3 + K2SO4 + H2O
46. KJ + Na2O2 + H2O  J2 + KOH + NaOH
J2 + KOH + NaOH
47. Na2O2 + KMnO4 + H2SO4  O2 + H2O + Na2SO4 + K2SO4 + MnSO4
O2 + H2O + Na2SO4 + K2SO4 + MnSO4
48. SnCl2 + NaOH + Bi(NO3)3 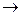 Na2SnO3 + Bi + NaCl + NaNO3 + H2O
Na2SnO3 + Bi + NaCl + NaNO3 + H2O
49. K2MnO4 + H2O  KMnO4 + MnO2 + KOH
KMnO4 + MnO2 + KOH
50. H2S + HNO3  H2SO4 + NO + H2O
H2SO4 + NO + H2O
51. P + KJO3 + KOH  K3PO4 + KJ + H2O
K3PO4 + KJ + H2O
52. N2H4+ J2 + KOH  N2+ KJ + H2O
N2+ KJ + H2O
53. H2O2 + AgNO3 + NH4OH  O2 + Ag + NH4NO3 + H2O
O2 + Ag + NH4NO3 + H2O
54. AsH3 + AuCl3 + KOH  K3AsO3 + Au + H2O
K3AsO3 + Au + H2O
55. NaJ + MnO2 + H2SO4  J2 + MnSO4 + Na2SO4 + H2O
J2 + MnSO4 + Na2SO4 + H2O
56. Br2+ NaOH  H2O + NaBr + NaBrO3
H2O + NaBr + NaBrO3
57. SbCl3 + Hg2Cl2 + NaOH  NaSbO3 + NaCl + Hg + H2O
NaSbO3 + NaCl + Hg + H2O
58. CoBr2 + O2 + KOH + H2O  Co(OH)3 + KBr
Co(OH)3 + KBr
59. Co(NO3)2 + AgNO3 + NaOH  Co(OH)3 + Ag + NaNO3
Co(OH)3 + Ag + NaNO3
60. Co + HNO3 + H2SO4  CoSO4 + N2 + H2O
CoSO4 + N2 + H2O
61. KMnO4 + NaNO2 + Ba(OH)2  BaMnO4 + NaNO3 + KOH + H2O
BaMnO4 + NaNO3 + KOH + H2O
62. KMnO4 + HNO2 + H2SO4  HNO3 + K2SO4 + MnSO4 + H2O
HNO3 + K2SO4 + MnSO4 + H2O
63. Bi(NO3)3 + SnCl2+ NaOH  Bi + Na2SnO3 + NaNO3 + NaCl + H2O
Bi + Na2SnO3 + NaNO3 + NaCl + H2O
64. P + КОН + H2O  PH3 + КН2РО4
PH3 + КН2РО4
65. AgNO3 + КОН + Н2О2  Ag + KNO3 + О2
Ag + KNO3 + О2
66. K2SO3 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Н2О
K2SO4 + MnSO4 + Н2О
67. K2SO3 + KMnO4 + Н2О  K2SO4 + MnO2 + КОН
K2SO4 + MnO2 + КОН
68. K2SO3 + KMnO4 + KOH  K2SO4 + K2MnO4 + H2O
K2SO4 + K2MnO4 + H2O
69. Zn + H2SO4  ZnSO4 + H2S + H2O
ZnSO4 + H2S + H2O
70. Cu + HNO3  Cu(NO3)2 + NO + H2O
Cu(NO3)2 + NO + H2O
71. Zn + HNO3  Zn(NO3)2 + N2O + H2O
Zn(NO3)2 + N2O + H2O
72. Zn + HNO3  Zn(NO3)2 + N2 + H2O
Zn(NO3)2 + N2 + H2O
73. Mg + HNO3  Mg(NO3)2 + NH4NO3 + H2O
Mg(NO3)2 + NH4NO3 + H2O
74. КClO3 + FeSO4 + H2SO4  KC1 + Fe2(SO4)3 + H2O
KC1 + Fe2(SO4)3 + H2O
75. KMnO4 + KCrO2 + H2O  K2CrO4 + MnO(OH)2
K2CrO4 + MnO(OH)2
76. KMnO4 + H2SO4 + H2S  K2SO4 + MnSO4 + S + H2O
K2SO4 + MnSO4 + S + H2O
77. CuS + HNO3  Cu(NO3)2 + NO + H2O + S
Cu(NO3)2 + NO + H2O + S
78. Na2SO3 + Na2Cr2O7 + H2SO4  Na2SO4+ Cr2(SO4)3 + H2O
Na2SO4+ Cr2(SO4)3 + H2O
79. KCIO3 + FeCl2 + HCI  KC1 + FeCl3 + H2O
KC1 + FeCl3 + H2O
80. KMnO4 + HNO2 + H2SO4  HNO3 + K2SO4 + MnSO4 + H2O
HNO3 + K2SO4 + MnSO4 + H2O
81. H2O2 + AgNO3 + NH4OH  O2 + Ag + NH4NO3 + H2O
O2 + Ag + NH4NO3 + H2O
82. KJ + O3 + H2O  J2 + O2 + KOH
J2 + O2 + KOH
83. Na2SO3 + HNO3  Na2SO4 + NO + H2O
Na2SO4 + NO + H2O
84. As2O3 + HOC1 + H2O  H3AsO4 + HCI
H3AsO4 + HCI
85. MnSO4 + Ca(OCl)2 + NaOH  MnO2 + CaCl2 + Na2SO4 + H2O
MnO2 + CaCl2 + Na2SO4 + H2O
86. MnCl2 + KOC1 + KOH  MnO2 + KC1 + H2O
MnO2 + KC1 + H2O
87. MnSO4+ H2O2+ KOH  MnO2+ K2SO4+ H2O
MnO2+ K2SO4+ H2O
88. KJ + CeO2 + HCI  J2 + CeCl3 + KC1 + H2O
J2 + CeCl3 + KC1 + H2O
89. Al + KNO3 + KOH  K3AlO3 + NH3 + H2O
K3AlO3 + NH3 + H2O
90. PbO2 + MnSO4 + HNO3 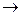 HMnO4 + PbSO4 + Pb(NO3)2 + H2O
HMnO4 + PbSO4 + Pb(NO3)2 + H2O
Пример решения задания 1
Подберите коэффициенты в следующих реакциях ионно-электронным методом. Укажите окислитель и восстановитель, определите направление реакции и вычислите э.д.с.
Решение:
Для подбора коэффициентов к уравнениям ОВР этим методомрекомендуется следующая последовательность действий.
1). Представим схему реакции в ионно-молекулярном виде, записывая в виде ионов только сильные и хорошо растворимые электролиты.
КМnО4 +Н2С2О4 +H2SO4 → МnSО4+ СО2 + K2SO4 +Н2О
K++ МnО4-+H2C2O4 +2H++SO42-→Мn2++ SO42-+СО2 +2K++SO42- + H2O
2). В ионно-молекулярном уравнении ОВР, выделим молекулы и ионы, в которых происходит изменение степеней окисления элементов:


3). Составим материальный баланс для всех элементов в схемах превращений.
Реакция идет в водном растворе в кислой среде, поэтому атомы кислорода и водорода уравниваются молекулами воды (где имеется недоствток атомов кислорода) и ионами водорода противоположным стороне реакции.
В схеме (а) сначала уравниваются атомы углерода 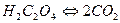 , а затем атома водорода
, а затем атома водорода 
В схеме (б) в левой части имеется 4 атома кислорода, а в левой их нет. Поэтому, в правую часть схемы добавляем 4 молекулы воды, а в левую 8 ионов водорода МпО 4- +8 H + → Мп2+ +4Н2О.
4). Составим баланс по зарядам. В схеме (а) подсчитаем суммарные заряды частиц в левой и правой частях схемы и уравняем их путем вычитания определённого числа электронов. В схеме (а) суммарный заряд частиц в левой частиравен нулю, в правой - плюс двум. Равенство зарядов будет наблюдаться в том случае, еслииз левой части схемы убрать два электрона:
Н2С2О4 –2 e - →2 СО2 +2Н+ (процесс окисления).
восстановитель
В схеме (б) МпО 4 - +8 H + → Мп2+ +4Н2О подсчитываем суммарные зарядычастиц в левой и правой частях схемы.
Суммарный заряд частиц в левой части равен (+7), а в правой (+2). Равенство зарядов будет соблюдаться в том случае, еслик левой части уравнения прибавить пять электронов:
МпО4- +8 H + +5ē → M п2+ +4 H 2 O (процесс восстановления).
окислитель
5). Уравняем число отданных ипринятых электронов, найдя наименьшее общее кратное соответствующихчисел имножители к ним. В рассматриваемом примере наименьшее общее кратное для чисел 2 и 5 равно 10. Поэтому для процесса окисления дополнительным множителем будет 5, а для процесса восстановления - дополнительный множитель 2.
6). С учётомэтих множителей произведём суммирование левых и правых частей полученныхуравнений:
5 | Н2С2О4-2 ē →2 CO 2 + 2Н+
2 | МпО4- + 8 H + + 5 ē →Мп2+ +4 H 2 O

5Н2С2О4 + 2 МпО4- + 16 H + →10 C О2 + 10Н+ +2М n 2+ +8 H 2 O
После приведения подобных членов получим сокращённое ионно-молекулярное уравнение рассматриваемой реакции.
5Н2С2О4 +2 МпО4- +6Н+ →10 C О2 +2Мп 2+ +8 H 2 O
Коэффициенты этого уравнения соответствуют коэффициентам молекулярного уравнения:
5 Н2С2О4 +2 K МпО4 +3 H 2 SO 4 =10СО2 + 2Мп S О4 + K 2 SO 4 +8 H 2 O
Проверка правильности подобранных коэффициентов производится по равенству числа атомов всех элементов в обеих частях уравнения.
э.д.с. = ∆φ = φокс – φвосс = 1,51-(-0,49) = 2 В; ∆φ > 0, следовательно реакция идёт в прямом направлении.
Если реакция протекает в щелочной среде, то для составления материального баланса используются частицы ОН- и Н2О.
В ту часть схемы, в которой не хватает атомов кислорода, добавляют удвоенное число ОН- - групп. В противоположную часть схемы записывают молекулы воды, число которых равно половине количества ОН - - ионов.
Например 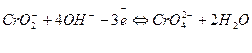 (процесс окисления)
(процесс окисления)
Пример решения задания 2
Вычислите э.д.с. гальванического элемента, составленного из стандартных цинкового и оловянного электродов. Определите направление тока во внешней цепи указанного гальванического элемента. На каком электроде будет идти растворение металла?
Решение:
Табличное значение стандартного электродного потенциала цинка -0,76 В, а олова -0,13 В.
Электродвижующая сила (э.д.с) равна разности двух электродных потенциалов. э.д.с. = ∆φ = φкатода – φанода
э.д.с. = ∆φ = φокислитель – φвосстановитель
Т.к. φокислитель > φвосстановитель, то вычитаем из большей алгебраической величины меньшую:
-0,13 - (-0,76) = 0,63 В.
Э.д.с. цинково-оловянного гальванического элемента равна 0,63 В.
ē



Zn|Zn +2||Sn +2|Sn
-0,76B -0,13B
Цинковая пластина заряжена более отрицательно, чем оловянная. Между ними возникает разность потенциалов. При замыкании системы в цепь электроны с цинковой пластины за счёт разности потенциалов переходят на оловянную. Растворение металла будет наблюдаться на цинковом электроде
Zn - 2ē → Zn 2+ (окисление восстановителя);
на оловянном электроде
Sn 2+ +2ē → Sn 0 (восстановление окислителя)
Пример решения задания 3
Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в кислую среду (Н CI )? Дайте схему образующегося при этом гальванического элемента.
Решение:
Исходя из положения металлов в ряду напряжений, определяем, что хром является более активным металлом (φCr+3/Cr=-0,74 В) и в образующейся гальванической паре будет анодом. Медь является катодом (  ). Хромовый анод растворяется, а на медном катоде выделяется водород.
). Хромовый анод растворяется, а на медном катоде выделяется водород.


 e–
e–
Cr/Cu, H+;
-0,74 В < 0,34 В
на аноде Cr – 3 e → С r 3+ (p-p) процесс окисления
на катоде 2 H + + 2 e → H 2 /Сu процесс восстановления
суммарное ионное уравнение электрохимической коррозии
2 Cr / Cu + 6Н+ → 2С r г3+ + 3Н2/ Cu
молекулярное уравнение электрохимической коррозии
2 Cr / Cu + 6Н CI → 2С rCI 3 + 3Н2/ Cu
Схема работающего гальванического элемента
e –
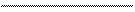
(-) 2Сг/2Сг3+ | НС1 | (Сu) ЗН2/6Н+ (+)
-0,74 В < 0,34 В
Следовательно, коррозии подвергается хром.
Пример решения задания 4
Какой металл является анодным (катодным) по отношению к покрываемому металлу? Составьте уравнения реакций, протекающих при атмосферной коррозии (во влажном воздухе).
а) Fe покрыт Zn
б) Fe покрыт Cu
Решение:
а) Исходя из положения металлов в ряду напряжений, определяем, что цинк является более активным металлом (  ) и в образующейся гальванической паре будет анодом. Железо является катодом (
) и в образующейся гальванической паре будет анодом. Железо является катодом (  ). Цинк растворяется, а на железе восстанавливается молекулярный кислород.
). Цинк растворяется, а на железе восстанавливается молекулярный кислород.


 e –
e –
Fe | H 2 O , O 2 | Zn
–0,44 B > –0,76 B

на аноде 2 Zn – 2ē → Zn 2+ ( p - p ) окисление
на катоде 1 О2 + 2Н2О + 4ē → 4ОН– восстановление идет на железе
Итоговое уравнение реакции будет иметь вид
2Zn/Fe + O2 +2H2O → 2Zn(OH)2↓ 
Цинк является анодным покрытием
б) Исходя из положения металлов в ряду напряжений, определяем, что железо является более активным металлом (  ) и в образующейся гальванической паре будет анодом. Медь является катодом (
) и в образующейся гальванической паре будет анодом. Медь является катодом (  ). Железо растворяется, а на меде восстанавливается молекулярный кислород.
). Железо растворяется, а на меде восстанавливается молекулярный кислород.


 ē
ē
Fe | H 2 O , O 2 | Cu
-0,44 B < +0,34 B

на аноде 2 Fe – 2 e – → Fe 2+ ( p - p ) окисление
на катоде 1 О2 + 2Н2О + 4е– → 4ОН– восстановление идет на меди
Итоговое уравнение реакции будет иметь вид
2Fe/ С u + O2 + 2H2O → 2Fe(OH)2↓.
Затем идет реакция окисления гидроксида железа (II) в гидроксид железа (III) кислородом воздуха
4Fe(OH)2+ O2 + 2H2O → 4Fe(OH)3↓
Медь является катодным покрытием.
Пример решения задания 5
Вычислите электродный потенциал цинка в растворе ZnCl2, в котором концентрация ионов Zn2+ составляет 7 ∙ 10-2 М.
Решение:
По уравнению Нернста

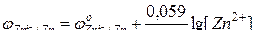
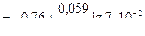 = —0,79 В
= —0,79 В
 Ответ: -0,79В
Ответ: -0,79В
Пример решения задания 6
Составьте схемы электролиза водного раствора CuSO4
а) с инертным анодом.
б) с использованием анода из меди.
Решение:
а) Электролиз водного раствора сульфата меди (II) с инертным анодом;
в растворе происходит диссоциация соли:
CuSO 4  Cu 2+ + SO 4 2-
Cu 2+ + SO 4 2-
Возможные окислители Cu 2+ и H 2 О
Так как 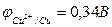 >
> 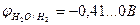 , более сильным окислителем является ион Cu2+, и на катоде происходит восстановление металлической меди.
, более сильным окислителем является ион Cu2+, и на катоде происходит восстановление металлической меди.
| катодная | Cu 2+ + 2 ē → Cuo | 2 |
| реакция |
Возможные восстановители SO 4 2- и H 2 O .
Так как  <
< 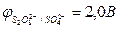 , более сильным восстановителем является вода, и на аноде происходит выделение кислорода из воды
, более сильным восстановителем является вода, и на аноде происходит выделение кислорода из воды
| анодная | 2Н2О – 4 ē → О2 + 4Н+ | 1 |
| реакция |
Составим суммарное уравнение реакции, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса.
краткое ионное уравнение
2Cu2+ + 2H2O  2Cuo(кат.) + O2(ан.) + 4Н+(ан.)
2Cuo(кат.) + O2(ан.) + 4Н+(ан.)
молекулярное уравнение
2CuSO4 + 2H2O  2Cu(кат.) + O2(ан.) + 2H2SO4(ан.)
2Cu(кат.) + O2(ан.) + 2H2SO4(ан.)
б) При электролизе водного раствора сульфата меди (II) с медным анодом в качестве восстановителей будем рассматривать SO 4 2- , H 2 O и сам анод Cu . Анион SO42- разряжаться не будет, а при сравнении,  >
> 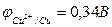 видно, что более сильным восстановителем является медь Cu. На электродах идут следующие процессы:
видно, что более сильным восстановителем является медь Cu. На электродах идут следующие процессы:
на катоде: Cu2+ + 2ē → Cu0
на аноде: Cuo – 2 ē → Cu2+
краткое ионное уравнение
Cu2+ + Cu0  Cu0 + Cu2+
Cu0 + Cu2+
молекулярное уравнение
CuSO4 + H2O +Cu0  Cu0(кат.) + H2O + CuSO4 (анод)
Cu0(кат.) + H2O + CuSO4 (анод)
Рекомендуемая литература
1. Глинка Н.Л., Ермаков А.И. Общая химия: Учебное пособие ждя вузов / Под ред. А.И. Ермакова–29 изд., испр.–М.: Интеграл–Пресс.–2001.–728 с.
2. Глинка Н.И., Рабинович В.А., Рубина Х.М. Задачи и упражнения по общей химии. Учебное пособие для студентов нехим. спец. вузов/Под ред. В.А. Рабиновича, Х.М. Рубиной.–изд. стереотип.–М.: Интеграл–Пресс, 2004.–240 с.
3. Молявко М.А., Шевляков Ф.Б. Окислительно-восстановительные реакции Учебное пособие Уфа, УГНТУ, 2008 г.
ЗАДАНИЕ № 8
Дата добавления: 2018-11-24; просмотров: 513; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
