Химические свойства моносахаридов.
Глава 16 Аминокислоты и сахара.
В предыдущей главе мы уже столкнулись с органическими молекулами несущими несколько функций. Аминокислоты и сахара также являются полифункциональными соединениями. Первые одновременно несут функцию карбоновой кислоты и основания (аминогруппа), а вторые – функцию альдегида (кетона) и многоатомного спирта.
Аминокислоты и их полимеры – пептиды (белки) в большей степени лежат в основе строения представителей царства животных, а углеводы, их производные – это в основном прерогатива царства растений.
Номенклатура аминокислот.
Аминокислоты подразделяют по положению аминогруппы в цепи относительно карбоксила. Это удобно, так как химические свойства аминокислот зависят от взаимного расположения этих функциональных групп. Принято указывать положения аминогруппы буквой греческого алфавита. Соседнее положение (2-е положение) называют α-положение, через один (3-е положение) – β-положение, и т.д. Последнее положение в углеродной цепи, вне зависимости от ее длины (но не менее 6-и атомов углерода) называют ω-положение. Многие как природные, так и синтетические α-аминокислоты носят тривиальные названия. Некоторые из тривиальных названий α-аминокислот и принятые латинские сокращения приведены в приложении 1.
Химические свойства аминокислот.
Исходя из наличия соответствующих функциональных групп, аминокислоты способны вступать в реакции свойственные как карбоновым кислотам, так и аминам. В данной главе рассматриваются только свойства, обусловленные наличием обоих функциональных групп в молекуле их реакции и взаимное влияние.
|
|
|
Кислотно-основные свойства аминокислот.
Кислотные и основные свойства аминокислот, зависят от расположения аминогруппы относительно карбоксильной. В случае удаленного расположения, кислотные и основные свойства близки к соответствующим величинам для алифатических карбоновых кислот и аминов. Особое место занимают α-аминокислоты, где совместное влияние карбоксильной и аминогруппы взаимно ослабляют как основные так и кислотные свойства.
В связи с тем, что в молекулах любых аминокислот присутствует и кислотная (карбоксил), и основная (амин) функция, в растворе они могут присутствовать в трех разных формах. В кислой среде, где диссоциация слабой карбоновой кислоты подавлена, карбоксильная группа находится в свободном состоянии, а аминогруппа находится в виде соли аммония. В щелочной среде наоборот, карбоксилат-анион в молекуле соседствует со свободной аминогруппой, слабые основные свойства которой подавлены. Для каждой аминокислоты существует еще одно состояние – «внутренней соли», когда в целом нейтральная молекула аминокислоты за счет диссоциации содержит и карбоксилат-анион и катион аммония. Такое состояние реализуется при строго определенном значении pH раствора. Это значение называется «изоэлектрическая точка».
|
|
|

Для каждой аминокислоты значение изоэлектрической точки является одной из важнейших физико-химических констант. При приближении к этой точке, как правило, резко падает растворимость аминокислот в воде, так как в отличие от сильнокислой или щелочной среды, где молекула аминокислоты ионизирована, «внутренняя соль» практически нейтральна и склонна к ассоциации с образованием межмолекулярных водородных связей. Различие в значениях изоэлектрических точек для разных аминокислот позволяет разделять и анализировать их с помощью электрофореза и ионообменной хроматографии.
Образование циклических амидов и элиминирование.
α-Аминокислоты при нагревании или в присутствии дегидратирующих средств легко образуют межмолекулярные циклические амиды – дикетопипиразины.

В отличие от них, γ- и δ-аминокислоты в аналогичных условиях образуют внутримолекулярные циклические амиды – лактамы.
|
|
|

β-Аминокислоты при нагревании легко элиминируют аммиак с образованием α,β-ненасыщенных карбоновых кислот.
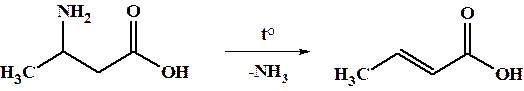
α-Аминокислоты, за счет сближенного расположения активных групп легко образуют хеллатные комплексы с ионами некоторых переходных металлов. Это свойство часто используют для модификации других групп в молекуле аминокислоты (например ω-аминогруппы в лизине), не затрагивая α-аминогруппы.

Номенклатура сахаров.
В систематической номенклатуре для обозначения принадлежности молекулы к классу сахаров используют окончание -оза. Однако, сами названия в основном тривиальные. Сахара (углеводы) подразделяются по количеству атомов углерода в цепи (треозы, тетрозы, пентозы, гексозы и т.д.), по наличию альдегидной или кетонной функции (альдозы и кетозы), по размеру цикла в циклических формах (фуранозы – пятичленный цикл и пиранозы – шестичленный цикл), а также по количеству сахарных остатков в молекуле (моносахариды, олигосахариды и полисахариды). См. приложения 2-4.
D / L номенклатура
Для описания строения некоторых природных хиральных молекул (особенно аминокислот и сахаров) была введена т.н. относительная конфигурация (D / L номенклатура). В сахарах, с учетом наличия нескольких оптических центров для упрощения изображения пространственных изомеров на плоскости применяют проекции Фишера. За основу D / L номенклатуры был взят глицериновый альдегид (точнее его проекция Фишера).
|
|
|
За редким исключением в природных объектах присутствуют D-сахара и их производные и L-аминокислоты в свободном виде и в составе белковых молекул во всем их разнообразии. Следует отметить, что в сахарах имеющих в подавляющем большинстве случаев несколько хиральных центров, принадлежности к D- или L-ряду определяют по конфигурации самого дальнего от карбонильной группы центра.
На схеме представлен переход от клиновидной проекции D-глицеринового альдегида – (R) конфигурация к проекции Фишера. (Напомним, что в клиновидной проекции связи расположенные в плоскости чертежа изображают тонкими линиями, связи направленные в сторону наблюдателя жирными линиями или закрашенным клином к заместителю, а связи направленные от наблюдателя пунктирными линиями или пунктирным клином). В проекции Фишера для D-глицеринового альдегида (R-конфигурация) гидроксильная группа располагается справа.

Для L-глицеринового альдегида в проекции Фишера гидроксильная группа будет располагаться слева.

Таким образом, если при написании проекции Фишера для некоторого хирального соединения, конфигурация его оптического центра будет аналогичной L-глицериновому альдегиду, то это соединение относят к L-ряду и наоборот. Поэтому, D / L номенклатура называется относительной – рассматривается «отношение» проекции исследуемого хирального центра к проекции соответствующего глицеринового альдегида.
При построении проекции Фишера для сахаров, содержащих два или более хиральных центров, основную углеродную цепь располагают вертикально, так чтобы более окисленный атом углерода (карбонильный) находился вверху, а сама цепь была свернута в часть кольца концами от наблюдателя. Проекции Фишера основных D-моносахаридов приведены в приложении 2. Проекции соответствующих L-сахаров можно получить, зеркально отразив проекцию D-сахара относительно вертикальной плоскости. Следует особо отметить, что D- и L-сахара отличаются как полные зеркальные отражения молекулы, а не только конфигурацией последнего хирального центра.

Рамкой выделена часть проекции, по которой определяют принадлежность сахарида к D- или L-ряду.
Химические свойства моносахаридов.
Свойства сахаров обусловлены спиртовыми и карбонильной функциональными группами. Большинство химических реакций связано с модификацией этих групп или нуклеофильным замещением гидроксилов. Однако не следует рассматривать эти группы в отдельности, ибо их взаимное влияние сильно меняет химические свойства сахаров по сравнению с монофункциональными соединениями.
Поскольку в молекулах большинства сахаров присутствует карбонильная группа, являющаяся хорошим субстратом для нуклеофильной атаки, и гидроксильные группы, проявляющие нуклеофильные свойства, сахара склонны к внутримолекулярным взаимодействиям по типу образования полуацеталей. С позиции термодинамики образования циклических структур известно, что наиболее выгодными являются 5-и и 6-и членные карбо- и гетероциклы. Эта закономерность реализуется и в образовании циклических полуацеталей сахаров. Для пространственного представления этих структур часто используют проекции Хеуорса, в которых цикл представляется плоским, а заместители направлены вертикально вверх или вниз. Проекция Хеуорса, по сути, является проекцией Фишера свернутой в кольцо.

На схеме представлены проекции Хеуорса возможных циклических полуацеталей на примере D-глюкозы. Относительную конфигурацию образующегося из карбонильной группы нового хирального центра обозначают греческими буквами α и β. Принято, что если в проекции Хеуорса полуацетальный гидроксил (он еще называется гликозидный) направлен вверх – это β-изомер, а если вниз – это α-изомер. Как уже было сказано выше, в зависимости от размера образующегося цикла образуется либо фураноза (пятичленный цикл), либо пираноза (шестичленный цикл). При кристаллизации из воды D-глюкоза образует кристаллы, содержащие исключительно α-D-глюкопиранозу, а при кристаллизации из пиридина только β-D-глюкопиранозу. В водном растворе постепенно (в течение 24 часов) устанавливается равновесие между α- и β-формами в соотношении приблизительно 36:64. За кинетикой этого процесса легко следить по изменению угла вращения плоско-поляризованного света при прохождении его через раствор исследуемого сахара во времени. Сам процесс перехода между α- и β-формами через открыто-цепную форму и установление равновесия в растворах сахаров называется мутаротация. Открыто-цепная и фуранозные формы D-глюкозы в водном растворе присутствуют в следовых количествах.
D-фруктоза – самый распространенный представитель кетоз, в кристаллическом виде известна только в форме β-фруктопиранозы, в водном растворе содержит до 15% фуранозной формы, а в производных по гликозидному гидроксилу присутствует только в виде пятичленного цикла.
Рибоза – самая известная пентоза в водном растворе присутствует в виде всех четырех таутамерных форм. Аналогично фруктозе в кристаллическом виде рибоза присутствует в форме β-рибопиранозы, а в производных по гликозидному гидроксилу и в полисахаридах – в форме β-рибофуранозы.
В слабощелочной среде моносахариды претерпевают перегруппировки через общую енольную форму. В качестве примера приведена взаимная перегруппировка D-глюкозы, D-маннозы и D-фруктозы.

Показано, что в слабощелочном растворе D-глюкозы устанавливается равновесие, где основным продуктом является D-глюкоза – 69%, 29% D-фруктозы и 3% D-маннозы. В кислой среде моносахариды достаточно стабильны, но при нагревании способны отщеплять воду (дегидратироваться) с образованием производных фурана. Аналогичные процессы, правда, с низкими выходами протекают при термолизе сахаров. Альдопентозы при нагревании или обработке кислотами отщепляют три молекулы воды с образованием фурфурола, а альдогексозы – 5-замещенного фурфурола.
Гидроксильные группы сахаров легко подвергаются ацилированию под действием ангидридов или хлорангидридов карбоновых кислот, а также легко образуют простые эфиры с метилиодидом в щелочной среде.

Реакции карбонильной группы моносахаридов реализуются в растворах, за счет наличия, пусть и в незначительной степени, открыто-цепной формы. Сразу следует обратить внимание, что сахара модифицированные по гликозидному гидроксилу не вступают в реакции свойственные карбонильной группе по причине отсутствия равновесной открытой структуры.

Дата добавления: 2018-10-27; просмотров: 294; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
