Первичная, вторичная и третичная структуры РНК. Функции РНК.
Живые организмы. Основные функции живых организмов и основные свойства живого.
В целом понятию живой организм можно дать следующее определение ЖИВОЙ ОРГАНИЗМ – это живое тело, обладающее совокупностью свойств (признаков), которые отличают его от неживой материи:
· Высокая сложность химической структуры и микроскопической организации
· Система получения преобразования и использования энергии окружающей среды
· Способность к точному самовоспроизведению
· Механизмы восприятия изменений в окружающей среде
· Специфические функции всех компонентов живого организма и регуляция их взаимоотношений
· Способность изменяться со временем путем последовательной эволюции.
Приведенная выше информация взята из учебника Ленинджера.
Выше был дан ответ относительно свойств (признаков) живого, теперь надо перейти к функциям живого. Функции живого:
· Энергетическая – аккумулирование энергии и перераспределение ее по пищевым цепям.
· Окислительно-восстановительная – окисление вещества в процессе жизнедеятельности и восстановление в процессе разложения при дефиците кислорода
· Газовая – способность изменять и поддерживать определенный газовый состав среды обитания и атмосферы в целом.
· Деструктивная – разрушение погибшей биоорганики и костных веществ.
· Рассеивающая – рассеяние живого вещества на больших пространствах.
· Концентрационная – способность организмов концентрировать в своем теле рассеянные элементы окружающей среды.
|
|
|
· Транспортная – перенос и перераспределение вещества и энергии.
· Средообразующая – преобразование физико-химических параметров окружающей среды.
· Информационная – накопление информации и закрепление ее в наследственных структурах.
Наверное, с этим всем на экзамен будет достаточно.
2. Клетка. Схема клеточной эволюции. Уровни структурной организации молекул внутри клетки.
В Ленинджере можно найти следующее определение клетки:
Живые клетки – это открытые системы, которые обмениваются с окружающей средой веществом и энергией и используют энергию для поддержания внутри себя динамического стационарного состояния, далекого от равновесия с окружающей средой. Клетки добывают энергию из солнечного света или топливных молекул и превращают ее из потока электронов (энергия ОВР реакций) в химические связи в молекуле АТР.
Приведенное выше определение несколько «физично», поэтому ниже приведено определение из лекции
:
Клетка – это ограниченная активной мембраной, упорядоченная, структурированная система биополимеров (белков, нуклеиновых кислот и др.) и их молекулярных комплексов, участвующих в единой совокупности метаболических и энергетических процессов, осуществляющих поддержание и воспроизведение всей системы в целом.
|
|
|
Перейдем к рассмотрению строения клетки. Существует огромное множество различных клеток, каждая из которых имеет свои особенности, поэтому здесь представлено краткое строение животной клетки на примере клеток печени – гепацитов (из учебника «Наглядная Биохимия» cтр198):

Эукариотическая клетка организованна системой мембран. Снаружи она ограниченна плазматической мембраной (см.дальше). Внутренности клетки заполнены цитоплазмой – водная среда с множеством частиц с различными функциями.Цитоплазма разделена на хорошо различимые органеллы, которые отделены от цитоплазмы внутриклеточными мембранами.
Проанализируем подробнее состав клетки и рассмотрим наиболее интересные функции органелл:
Ядро – самая крупная органелла, которую даже можно видеть в световой микроскоп. Функции:
· хранение наследственной информации и передача ее дочерним клеткам в процессе деления
· регуляция жизнедеятельности клетки путем регуляции синтеза различных белков
· место образования субъединиц рибосом. (Белковая субъединица в структурной биологии — полипептид, который вместе с другими компонентами собирается в мультимерный или олигомерный белковый комплекс.)
|
|
|
Эндоплазматический ритикулум – бывает шероховатый и гладкий. Шероховатый ЭПР -участок синтеза большинства белков, гладкий ЭПР место синтеза липиодв.
Комплекс(аппарат) Гольджи –осуществляет процессинг, упаковку и доставку белков к другим органеллам или выводит их из клетки.
Экзосомы и эндосомы – пузыреобразные органелла(везикулы), участвующие в процессе обмена веществ между клеткой ее окружением.
Митохондрии –место окисления топливных молекулс образованием ATP.
Рибосомы – аппарат синтеза белка.
Лизосомы – уничтожат внутриклеточные остатки.
Периксисомы – разлагают пероксиды
Цитоскелет – поддерживает структуру клетки. Способствует передвижению органелл.
В клетках растений помимо этих органелл могут иметься:
Хлоропласты -места фотосинтеза
Вакуоли – выполняющие структурные функции и являющиеся хранилищами. Прочная клеточная стенка из целлюлозы, других полисахаридов.(не путать с плазматической мембраной)
|
|
|
 Выше была рассмотрена клетка, относящаяся только к одну из трех доменов (или классов, или царств) живых организмов. Справа на схеме показано эволюционное древо или филогения - историческое развитие организмов:
Выше была рассмотрена клетка, относящаяся только к одну из трех доменов (или классов, или царств) живых организмов. Справа на схеме показано эволюционное древо или филогения - историческое развитие организмов:
Интересно, что археи и эукариоты являются более близкими родственникам чем бактерии и археи. Одной из классификаций живых организмов является деление их на эукариоты (животные, растения, грибы) и прокариоты (бактерии + археи). В таблице ниже приведена сравнительная характеристики эукариот и прокариот:

Важно рассмотреть вопрос касательно «химии клетки» , а именно уровней организации молекул в клетке. В учебнике Ленинджера и в лекциях выделяют 4 уровня структурной иеархии:

Мономерные звенья (уровень 1) связываются ковалентными связями в макромолекулы (уровень 2). Макромолекулы посредством нековалентных взаимодействий – водородных связей, ионных, гидрофобных, ван-дер-ваальсовых - способны образовывать надомолекулярные комплексы (уровень 3).
Примечания*
Дадим небольшой комментарий к картинке выше. На картинке не приведены липиды т.к они из мономеров сразу образуют структуру третьего уровня.
Хроматин (греч. χρώματα — цвета, краски) — это вещество хромосом, представляющее собой комплекс ДНК, РНК и белков. Хроматин находится внутри ядра клеток эукариот и входит в состав нуклеоида у прокариот. Именно в составе хроматина происходит реализация генетической информации, а также репликация и репарация ДНК (см. дальше).
3. Структура и функции биологических мембран.
Введение.
Наиболее важными мембранами в животных клетках являются:
· плазматическая мембрана
· внутренняя и внешняя ядерные мембраны,
· мембраны эндоплазматического ретикулума и аппарата Гольджи
· внутренние и внешниемитохондриальные мембраны.
Все мембраны полярны, т.е. существует различие в составах внутреннего и внешнего по отношению к цитоплазме слоев.
Структура биологических мембран.
Структура биологических мембран будет рассмотренана примере плазматической мембраны. Все биомембраны построены одинаково; они состоят из двух слоевлипидных молекул, в которые встроены белки,углеводы: 
Компоненты мембран удерживаются нековалентными связями, вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя.
Текучестьмембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру.
В то время как «дрейф» в плоскости мембраны происходит достаточно легко, переход белков с внешней стороны мембраны на внутреннюю («флип-флоп») невозможен, а переход липидов происходит крайне редко. Для «перескока» липидов необходимы специальные белки транслокаторы (см.далее). Исключение составляет холестерин, который может легко переходить с одной стороны мембраны на другую.
Cостав мембран
Мембранные липиды.
Липиды мембран представляют собой амфифильные молекулыс полярной гидрофильной головкой (голубого цвета) и неполярным липофильным хвостом (желтого цвета). В водной среде они агрегируют за счет гидрофобных взаимодействий и вандерваальсовых сил.

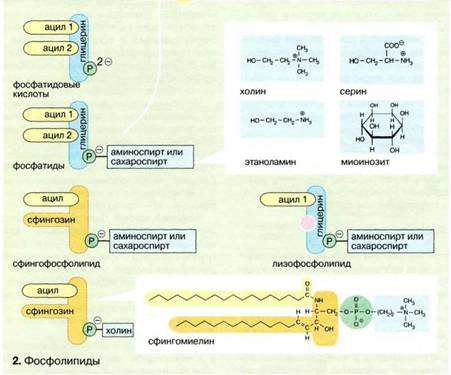 В мембранахв основном содержатся липиды трех классов:
В мембранахв основном содержатся липиды трех классов:
Фосфолипиды - наиболее важная группа.

Холестерин - присутствует во внутриклеточных мембранах животных клеток (за исключением внутренней мембраны митохондрий).
 Гликолипиды - входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы, которые ориентируются в водную фазу.
Гликолипиды - входят в состав многих мембран (например, во внешний слой плазматических мембран). В состав гликолипидов входят углеводные функциональные группы, которые ориентируются в водную фазу.
Мембранные белки
Протеины могут связываться с мембраной различным путем.
Интегральные мембранные белкиимеют трансмембранные спирализованные участки (домены), которые однократно или многократно пересекают липидный бислой. Такие белки прочно связаны с липидным окружением.
Периферические мембранные белкиудерживаются на мембране с помощью липидного «якоря» и связаны с другими компонентами мембраны; например, они часто бывают ассоциированы с интегральными мембранными белками.

У интегральных мембранных белков фрагмент пептидной цепи, пересекающий липидный бислой, обычно состоит из 21-25 преимущественно гидрофобных аминокислот, которые образуют правую α-спираль с 6 или 7 витками (трансмембранная спираль).
 Белки, синтезируемые в ШЭР и несущие «стоп-транспорт-сигнал» остаются в мембране ШЭР и закрепляются там за счет гидрофобных взаимодействий в качестве интегральных мембранных белков.
Белки, синтезируемые в ШЭР и несущие «стоп-транспорт-сигнал» остаются в мембране ШЭР и закрепляются там за счет гидрофобных взаимодействий в качестве интегральных мембранных белков.
Фиксация белка в мембране может быть также осуществлена путем присоединения липофильного якоря. Такие периферические мембранные белки присоединяют липиды во время или сразу после трансляции. Соответствующий сигнал обычно содержится в белке в форме специфической пептидной последовательности.
Функции мембран:
1. Ограничение и обособление клеток и органелл. Обособление клеток от межклеточной среды обеспечивается плазматической мембраной, защищающей клетки от механического и химического воздействий. Плазматическая мембрана обеспечивает также сохранение разности концентраций метаболитов и неорганических ионов между внутриклеточной и внешней средой.
2. Контролируемый транспорт метаболитов и ионов определяет внутреннюю среду, что существенно для гомеостаза, т.е. поддержания постоянной концентрации метаболитов и неорганических ионов, и других физиологических параметров. Регулируемый и избирательный транспорт метаболитов и неорганических ионов через поры и посредством переносчиков становится возможным благодаря обособлению клеток и органелл с помощью мембранных систем.
3. Восприятие внеклеточных сигналов и их передача внутрь клетки, а также инициация сигналов.
4. Ферментативный катализ. В мембранах на границе между липидной и водной фазами локализованы ферменты. Именно здесь происходят реакции с неполярными субстратами. Примерами служат биосинтез липидов и метаболизм неполярных ксенобиотиков. В мембранах локализованы наиболее важные реакции энергетического обмена, такие, как окислительное фосфорилирование (дыхательная цепь)и фотосинтез.
5. Контактное взаимодействие с межклеточным матриксом и взаимодействие с другими клетками при слиянии клеток и образовании тканей.
6. Заякоривание цитоскелета, обеспечивающее поддержание формы клеток и органелл и клеточной подвижности.

* Под клеточной рецепцией понимают процесс восприятия и преобразования химического сигнала в сложную последовательность внутриклеточных химических процессов. Клеточная рецепция обеспечивает возможность обмена информации между клетками, который осуществляется при помощи биологически активных веществ (гормонов, медиаторов)
6. АТР как универсальный реакционный модуль. Примеры реакций, в которых участвует АТР. Термодинамика биохимических реакций.
Прежде всего надо кратко рассмотреть основные законы биоэнергетики.
Живая клетка избегает прямого использования энергии внешних ресурсов для совершения полезной работы. Она сначала превращает их в одну из трех конвертируемых форм энергии (“энергетических валют”), а именно: в АТФ, или, которые затем расходуются для осуществления различных энергоемких процессов.
Любая живая клетка всегда располагает как минимум двумя “энергетическими валютами”: водорастворимой (АТФ) и связанной мембраной(∆µNa+ либо∆µH+)
“Энергетические валюты” клетки могут превращаться одна в другую. Поэтому получения хотя бы одной из них за счет внешних ресурсов достаточно для поддержания жизнедеятельности.
Термодинмика биохимических процессов.
Практически все биохимические процессы протекают при постоянном давлении, равном атмосферному, и при постоянном объеме системы. Для проведения расчетов в таких условиях удобно воспользоваться специальной величиной – энтальпией. Изменение энтальпии в ходе реакции, обозначаемое ΔH, равно теплоте, поглощенной системой (на самом деле, ΔH = ΔU + P × ΔV, где P – давление, V – объем, U – внутренняя энергия системы; но, когда объем системы не меняется, наше утверждение справедливо). Для экзотермических процессов, в ходе которых выделяется тепло, ΔH< 0, тогда как для эндотермических ΔH > 0. Возможность или невозможность самопроизвольного протекания реакции при постоянных температуре и давлении однозначно определяется изменением свободной энергии Гиббса: ΔG = ΔH – TΔS Здесь ΔG – изменение свободной энергии Гиббса в ходе процесса, ΔH – изменение энтальпии, T – абсолютная температура, ΔS – изменение энтропии.
В энергообеспечении живых организмов важнейшую роль играет реакция гидролиза АТФ:
АТФ4- + Н2О = АДФ2- + НРО42-.
ΔG этой реакции при 1 М концентрации всех ее участников (ΔG°) и температуре 25 °С составляет (–34,5) кДж/моль. При этом изменение энтальпии в ходе реакции в этих условиях (ΔH°) составит (–19,7) кДж/моль, а изменение энтропии (ΔS°) равно 49,7 кДж/моль·град. Таким образом, в этой реакции и тепловой эффект, и увеличение беспорядка.
Для того чтобы запустить эндергонический процесс, необходимо воспользоваться принципом энергетического сопряжения. Процесс возможен при условии, если ΔРЭФФ = ΔP1 + ΔP2— величина отрицательная. Благодаря энергетическому сопряжению возможно взаимопревращение одних форм работы и энергии в другие. Например, в батарейке карманного фонарика экзергоническая химическая реакция генерирует электрическое поле, которое используется для эндергонического процесса получения световой энергии. В мышцах химическая Энергия трансформируется в механическую работу и тепловую энергию.
АТФ
Нуклеотидный кофермент аденозинтрифосфат [АТФ (АТР)] является наиболее важной формой сохранения химической энергии в клетках. Расщепление АТФ — высоко экзоэргическая реакция. Химическая энергия гидролиза АТФ может использоваться для сопряжения с эндоэргическими процессами, такими, как биосинтез, движение и транспорт. Другие нуклеозидтрифосфатные коферменты (ГТФ, ЦТФ и УТФ), химически похожие на АТФ, выполняют в метаболических процессах иные функции.
Структура АТФ
 В АТФ цепочка из трех фосфатных остатков связана с 5'-OH-группой аденозина. Фосфатные группы обозначаются как α, β и γ. Рибоза связана с α-фосфатом фосфоэфирной связью. Три фосфатных остатка соединены между собой менее устойчивыми фосфоангидридными связями.
В АТФ цепочка из трех фосфатных остатков связана с 5'-OH-группой аденозина. Фосфатные группы обозначаются как α, β и γ. Рибоза связана с α-фосфатом фосфоэфирной связью. Три фосфатных остатка соединены между собой менее устойчивыми фосфоангидридными связями.
При физиологических значениях рН АТФ несет четыре отрицательных заряда. Собственно, действующим коферментом является комплекс АТФ с ионом Mg2+, координационно связанным с α- и β-фосфатом (Mg2+ ּ АТФ4-, на рисунке не показан). Для простоты чаще всего говорят только об АТФ.
Изменение свободной энергии ΔGo' гидролиза фосфоангидридных связей в АТФ при рН 7 в стандартных условиях составляет от -30 до -35 кДж/моль. Независимо от того, какая из ангидридных связей АТФ при этом расщепляется, величина ΔGo' остается практически постоянной.
В клетке действительное изменение свободной энергии при гидролизе АТФ ΔG' еще гораздо выше, так как концентрации АТФ, АДФ и неорганического фосфата (Рi) существенно более низки, чем в стандартных условиях, а АТФ присутствует в избытке по сравнению с АДФ. На величину ΔG' влияют также величина рН и концентрация ионов Mg2+. Предположительно в физиологических условиях энергия гидролиза АТФ до АДФ и неорганического фосфата равна примерно -50 кДж/моль.
Помимо энергетической, АТФ выполняет в организме ещё ряд других не менее важных функций:
· Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
· Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность. 15
· АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
· Также известна роль АТФ в качестве медиатора в синапсах
Биосинтез АТФ.
В организме АТФ синтезируется путём фосфорилирования АДФ:
АДФ + H3PO4 + энергия → АТФ + H2O.
Фосфорилирование АДФ возможно тремя способами:
· субстратное фосфорилирование
· окислительное фосфорилирование,
· фотофосфорилирование в процессе фотосинтеза у растений.
В первых двух способах используется энергия окисляющихся веществ. Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АТФ не требует участия мембранных ферментов, оно происходит в цитоплазме в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
Наиболее эффективным способом синтеза АТФ является окислительное фосфорилирование. Решающую роль в синтезе АТФ играет H+-зависимая АТФ-синтаза.
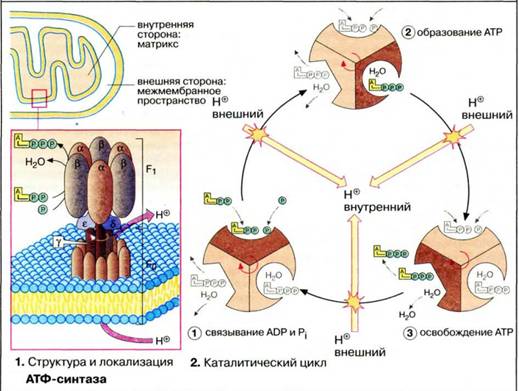 АТР-синтетаза - фермент, обеспечивающий синтез АТР из ADP и фосфатного остатка. АТР встроена в мембрану так называемой γ-субъединицей, на конце которой чередуясь располагаются α- и β-субъединицы. Эта система имеет три активных центра, один из которых свободен, другой занимают ADP и фосфатный остаток, третий - АТР. Система постоянно вращается вокруг γ-субъединицы, в результате чего образуется АТР. Энергия, необходимая для этого процесса, поставляется бактериородопсином, обеспечивающим градиент концентрации протонов по обе стороны мембраны
АТР-синтетаза - фермент, обеспечивающий синтез АТР из ADP и фосфатного остатка. АТР встроена в мембрану так называемой γ-субъединицей, на конце которой чередуясь располагаются α- и β-субъединицы. Эта система имеет три активных центра, один из которых свободен, другой занимают ADP и фосфатный остаток, третий - АТР. Система постоянно вращается вокруг γ-субъединицы, в результате чего образуется АТР. Энергия, необходимая для этого процесса, поставляется бактериородопсином, обеспечивающим градиент концентрации протонов по обе стороны мембраны
** Каталитический цикл подразделяется на три фазы, каждая из которых проходит поочередно в трех активных ц8ентрах. Вначале идет связывание АДФ (ADP) и Ρi, затем образуется фосфоангидридная связь и, наконец, освобождается конечный продукт реакции. При каждом переносе протона через белковый канал F0 в матрикс все три активных центра катализируют очередную стадию реакции. Предполагается, что энергия протонного транспорта прежде всего расходуется на поворот γ-субъединицы, в результате которого циклически изменяются конформации α- и β-субъединиц.Синтез осуществляется в митохондриях.
Второй способ основан на переносе фосфатных остатков на АДФ через метаболит с высоким потенциалом переноса фосфатных групп.
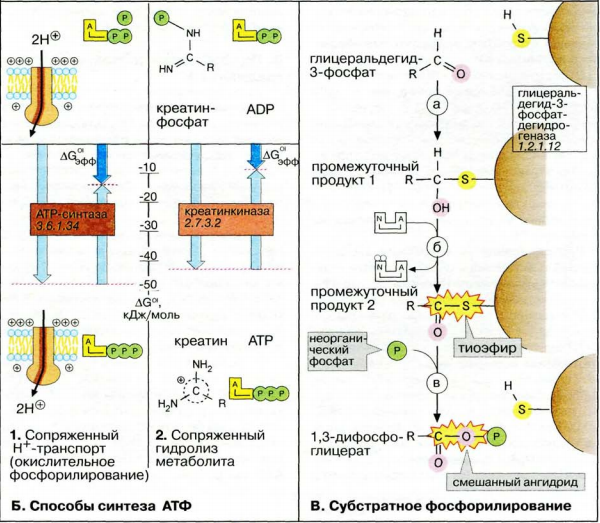 Этот способ связан с передачей макроэргического фосфата или энергии макроэргической связи какого-либо вещества (субстрата) на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ
Этот способ связан с передачей макроэргического фосфата или энергии макроэргической связи какого-либо вещества (субстрата) на АДФ. К таким веществам относятся метаболиты гликолиза (1,3-дифосфоглицериновая кислота, фосфоенолпируват), цикла трикарбоновых кислот (сукцинил-SКоА) и креатинфосфат. Энергия гидролиза их макроэргической связи выше, чем в АТФ, и роль указанных веществ сводится к использованию этой энергии для фосфорилирования молекулы АДФ до АТФ
Реакции в которых участвует АТФ.
7. Типы транспорта молекул через биологические мембраны. Примеры.
В связи с тем, что клетки как элементарные биологические системы являются открытыми системами, для обеспечения обмена веществ и энергии, поддержания гомеостаза, роста, раздражимости и других процессов требуется перенос веществ через мембрану — мембранный транспорт. В настоящее время транспорт веществ через мембрану клетки делят на транспорт малых частиц и везикулярный транспорт. В свою очередь транспорт малых частиц подразделяется на активный и пассивный.
Проницаемость мембраны.
 Низкомолекулярные нейтральные вещества, такие, каквода, аммиак, глицерин и мочевина, свободно диффундируют через биомембраны. Однако сувеличением размера молекулытеряют способность проникать через биомембраны.
Низкомолекулярные нейтральные вещества, такие, каквода, аммиак, глицерин и мочевина, свободно диффундируют через биомембраны. Однако сувеличением размера молекулытеряют способность проникать через биомембраны.
К примеру, биомембраны непроницаемы для глюкозы и других сахаров. Проницаемость биомембран зависит также от полярности веществ. Неполярные вещества, такие, как бензол, диэтиловый эфир и многие наркотики, способны легко проходить через биомембраны в результате диффузии. Напротив, для гидрофильных, особенно заряженных молекул, биомембраны непроницаемы. Перенос таких веществ осуществляется специализированными транспортными белками.
Простейшей формой транспорта через биомембраны является свободная диффузия (облегченная диффузия).

Она часто облегчается определенными мембранными белками, которые можно разделить на две группы:
1. Канальные белки образуют в биомембранах заполненные водой поры, проницаемые для определенных ионов. Например, имеются специфические ионные каналы для ионов Na+, К+, Са2+ и Cl-.
2. В отличие от ионных каналов транспортные белки избирательно связывают молекулы субстрата и за счет конформационных изменений переносят их через мембрану. В этом отношении транспортные белки (белки-переносчики) похожи на ферменты. Единственное различие состоит в том, что они «катализируют» направленный транспорт, а не ферментативную реакцию. Они проявляют специфичность - иногда групповую - к субстратам, подлежащим переносу.
 Свободная диффузия и транспортные процессы, обеспечиваемые ионными каналами и переносчиками, осуществляются по градиенту концентрации или градиенту электрическою заряда (называемым вместе электрохимическим градиентом). Такие механизмы транспорта классифицируются как «пассивный транспорт». Например, по такому механизму в клетки поступает глюкоза из крови, где ее концентрация гораздо выше
Свободная диффузия и транспортные процессы, обеспечиваемые ионными каналами и переносчиками, осуществляются по градиенту концентрации или градиенту электрическою заряда (называемым вместе электрохимическим градиентом). Такие механизмы транспорта классифицируются как «пассивный транспорт». Например, по такому механизму в клетки поступает глюкоза из крови, где ее концентрация гораздо выше
В противоположность этому механизму активный транспорт идет против градиента концентрации или заряда, поэтому активный транспорт требует притока дополнительной энергии, которая обычно обеспечивается в основном за счет гидролиза АТФ. Активный перенос может сочетаться с другим, спонтанно идущим транспортным процессом (так называемый вторичный активный транспорт).
С помощью транспортных систем осуществляется регуляция объема клеток, величины рН и ионного составацитоплазмы. Благодаря транспортным системам клетки накапливают метаболиты, важные для обеспечения энергетического цикла и метаболических процессов, а также выводят в окружающую среду токсические вещества. Транспортные системы обеспечивают поддержание ионных градиентов, существенно важных для окислительного фосфорилирования и стимуляции мышечных и нервных клеток

**Транспортные процессы: Активный транспорт может идти по механизму унипорта (облегченной диффузии), согласно которому только одно вещество переносится через биомембрану в одном направлении с помощью канальных или транспортных белков (например, транспорт глюкозы в клетках печени). Активный транспорт может протекать по механизму сопряженного переноса (симпорт, сопряженный транспорт), когда два вещества переносятся одновременно в одном направлении как. например, транспорт аминокислот или глюкозы вместе с ионами натрия в кишечных эпителиальных клетках, либо в противоположном направлении (антипорт, обменная диффузия), как, например, обмен ионов НСО3- на Cl- в мембране эритроцитов.
Некоторые транспортные белки.
Na+/K+-АТФ-аза.
АТФ-азные системы, транспортирующие ионы К+ и Na+ относятся к группе транспортных белков. Они осуществляют АТФ-зависимый активный транспорт через мембраны против концентрационного градиента. Имеется множество различных АТФ-аз, способных транспортировать различные вещества от неорганических катионов (ионные насосы) до пептидов (пептидные насосы) и неполярных соединений (например, переносчики лекарственных веществ или белки, обеспечивающие множественную лекарственную устойчивость). Во всех клетках имеются ионные насосы (ионтранспортирующие АТФ-азы), осуществляющие постоянный перенос таких катионов, как Н+ и Na+, K+ и Са2+, что существенно важно для поддержания электрохимического градиента.

 На схеме показана Na+/K+-обменивающая АТФ-аза, которая найдена в плазматической мембране практически всех животных клеток. Это мембранный гликопротеин, состоящий из четырех субъединиц (α2β2). Цитоплазматическая область фермента участвует в реакционном цикле фосфорилирования/дефосфорилирования, принимая попеременно два конформационных состояния, ответственных за транспорт ионов. При расходовании одной молекулы АТР из клетки «выкачивается» три иона Na+ в обмен на поступающие два иона К+. Благодаря непрерывному функционированию этого «насоса» обеспечивается поддержание неравновесного распределения ионов Na+ и К+ между цитоплазмой клетки и окружающей средой, характерное для животных клеток.
На схеме показана Na+/K+-обменивающая АТФ-аза, которая найдена в плазматической мембране практически всех животных клеток. Это мембранный гликопротеин, состоящий из четырех субъединиц (α2β2). Цитоплазматическая область фермента участвует в реакционном цикле фосфорилирования/дефосфорилирования, принимая попеременно два конформационных состояния, ответственных за транспорт ионов. При расходовании одной молекулы АТР из клетки «выкачивается» три иона Na+ в обмен на поступающие два иона К+. Благодаря непрерывному функционированию этого «насоса» обеспечивается поддержание неравновесного распределения ионов Na+ и К+ между цитоплазмой клетки и окружающей средой, характерное для животных клеток.
Переносчик глюкозы.
Переносчики глюкозы представляют собой семейство структурно близких мембранных белков с различными функциями. ГЛУТ-1 и ГЛУТ-3 имеют высокое сродство к глюкозе. Они обнаружены почти во всех клетках, где обеспечивают постоянное поступление глюкозы. ГЛУТ-2 найден в клетках печени и поджелудочной железы. Этот переносчик обладает гораздо меньшим сродством к глюкозе и связывание глюкозы ГЛУТ-2 пропорционально концентрации глюкозы в крови. ГЛУТ-4 найден в плазматической мембране мышечных и жировых клеток. Гормон инсулин вызывает увеличение количества молекул ГЛУТ-4 на поверхности клетки и таким образом стимулирует поступление глюкозы в эти ткани. ГЛУТ-5 синтезируется клетками кишечного эпителия. Этот переносчик обеспечивает симпорт – сопряженный перенос глюкозы с ионами Na+.

Молекула глюкозы транспортируется совместно с Na+через апикальную плазматическую мембрану в эпителиальную клетку. Она движется через клетку к базальной поверхности, где переходит в кровь с помощью ГЛУТ2- пассивного переносчика глюкозы.
Na+/K+-АТФаза продолжает выкачивать Na+, который обеспечивает поглощение глюкозы. Na+-глюкозные симпортеры в апикальной плазматической мембране захватывают глюкозу из кишечника с помощью процесса, приводимого в действие «нисходящим потоком» Na+по градиенту.
8. Первичная и вторичная структуры ДНК. Суперспирализация. Функции ДНК.
 И ДНК и РНК содержат два главных пуриновых основания: аденин и гуанин и два главных пиримидиновых основания цитозин и тимин, РНК – урацил.
И ДНК и РНК содержат два главных пуриновых основания: аденин и гуанин и два главных пиримидиновых основания цитозин и тимин, РНК – урацил.
 Соединения азотистых оснований с рибозой или 2-дезоксирибозой носят название нуклеозиды. Так,аденин и рибоза образуют нуклеозид аденозин (сокращенно А). Соответствующие производные других азотистых оснований носят названия гуанозин(G),уридин(U),тимидин(T), ицитидин(С).
Соединения азотистых оснований с рибозой или 2-дезоксирибозой носят название нуклеозиды. Так,аденин и рибоза образуют нуклеозид аденозин (сокращенно А). Соответствующие производные других азотистых оснований носят названия гуанозин(G),уридин(U),тимидин(T), ицитидин(С).
Если углеводный остаток представлен 2-дезоксирибозой образуется дезоксинуклеозид, например, 2'-дезоксиаденозин (dA). В клетке 5'-ОН-группа углеводного остатка нуклеозида этерефицирована фосфорной кислотой. Соответствующее производное 2'-дезокситимидина (dT), звено ДНК, называется 2'-дезокситимидин-5'-монофосфат (dTMP).
Если 5'-фосфатный остаток соединяется с другими нуклеозидфосфатными остатками. получаются нуклеозидди- и нуклеозидтрифосфаты, например, АДФ и АТФ – важнейшие коферменты энергообмена. Все нуклеозидфосфаты объединяют под общим названием нуклеотиды.
**В нуклеозидах и нуклеотидах пентоза находится в фуранозной форме. Углеводный остаток и азотистоеоснование связаны N-гликозидной связью между С-1' углеводного звена и N-9 пуринового или соответственно N-1 пиримидинового цикла. Гликозидная связь находится в β-конфигурации.

Если фосфатная группа одного нуклеотида взаимодействует с З'-ОН-группой другого нукпеотида, образуется динуклеотид с фосфодиэфирной связью. Такой динуклеотид несет на 5'-конце свободную фосфатную группу, а на 3'-конце свободную ОН-группу. Поэтому можно за счет образования еще одной фосфодиэфирной связи присоединить новый мононуклеотид. Таким путем образуются олигонуклеотиды и, наконец, полинуклеотиды.
Полинуклеотиды, составленные из рибонуклеотидных звеньев, называются рибонуклеиновыми кислотами (РНК), из дезоксирибонуклеотидных мономеров - дезоксирибонуклеиновыми кислотами (ДНК). При обозначении полинуклеотидов указывают сокращенные названия нуклеозидных звеньев в направлении 5'→3', т.е. слева направо. Иногда в название включают фосфатную группу ("p"). Так, например, фрагмент РНК, приведенный на схеме выше, можно записать ...pUpG... или сокращенно ...UG...
Таким образом, первичная структура ДНК - последовательность нуклеотидов, которые, в свою очередь, сформированы одним остатком фосфорной кислоты, 2'-дезоксирибозой и одним из четырёх азотных гетероциклических оснований. Фосфатные группы присоединены к 3' и 5'-атомам углерода дезоксирибозы, азотные основания - к 1'-атому.
Вторичная струкутра ДНК.
Спаривание оснований в ДНК
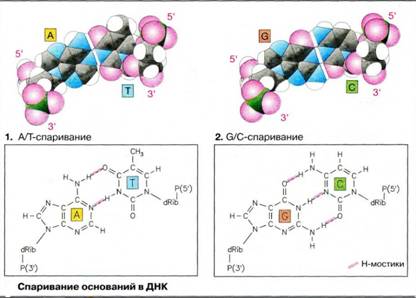 Каждое основание одной цепи связано с комплементарным ему основаниемдругой цепи водородными мостиками. При этом аденин комплементарен тимину, гуанин — цитозину. Таким образом, каждая пара состоит из одного пуринового и одного пиримидинового основания.
Каждое основание одной цепи связано с комплементарным ему основаниемдругой цепи водородными мостиками. При этом аденин комплементарен тимину, гуанин — цитозину. Таким образом, каждая пара состоит из одного пуринового и одного пиримидинового основания.
Комплементарность А и T, соответственно G и С, становится понятной, если рассмотреть возможные водородные мостики между основаниями. В качестве доноров выступают аминогруппы(аденина, цитозина, гуанина) и NН-группы гетероциклов (тимина и гуанина). Возможными акцепторами являются карбонильные группы (тимина, цитозина, гуанина) и атомы азота гетероциклов. Пара A-T может образовывать два, а пара G-C даже три линейных и поэтому особенно устойчивых мостика. Урацил, содержащийся в РНК вместо тимина, ведет себя при спаривании основании подобно тимину.
Спаривание оснований,охватывает в молекуле ДНК миллионы звеньев. Конечно, это возможно только в том случае, если полярность обеих цепей различна, т.е. обе цепи имеют противоположные направления. Кроме того, обе цепи должны быть закручены в виде двойной спирали. Из-за стерических ограничений, вызванных 2'-ОН-группой остатка рибозы, РНК не мoгyт образовывать структур, подобных двойной спирали. Поэтому РНК имеют менее регулярную структуру по сравнению с ДНК.
 Основания (указаны в виде полос) расположены внутри двойной спирали. Следовательно, эта область ДНК неполярна.
Основания (указаны в виде полос) расположены внутри двойной спирали. Следовательно, эта область ДНК неполярна.
Напротив, внешняя сторона молекулы полярна и заряжена отрицательно за счет углеводных остатков и фосфатных групп остова. Цепи ДНК на протяжении всего тяжа образуют два желоба, которые носят названия «малая бороздка» и «большая бороздка».
Так как обе цепи связаны только нековалентными взаимодействиями, двойная спираль при нагревании или инкубации в щелочном растворе легко распадается на отдельные цепи (денатурирует). При медленном охлаждении ранее неупорядоченные отдельные цепи благодаря спариванию оснований вновь образуют двойную спираль (молекула ренатурирует).
В функциональном отношении две цепи ДНКне эквивалентны. Кодирующей цепью (матричной, смысловой) является та из них, которая считывается в процессе транскрипции. Именно эта цепь служит матрицей для PHK. Некодирующая цепь (антисмысловая) по последовательности подобна РНК (при условии замены T на U). Общепринято давать структуру гена в виде последовательности некодирующей цепи ДНК в направлении 5'→3'. Если прочитать кодоны в этом направлении, то с помощью генетического кода можно воспроизвести аминокислотную последовательность белка в принятом порядке, от N- к С-концу.
Таким образом, вторичная структура ДНК представляет собой две цепочки, сворачивающиеся в двойную спираль за счёт образования водородных связей между комплементарными парами азотных оснований (А-Т, C-G, правило Чартгаффа). Все пары азотных оснований лежат в параллельных плоскостях, поскольку для такой конфигурации возможны особые стэкинг-взаимодействия (частный случай гидрофобных) между плоскими циклами, за счёт которых соседние пары сближаются на расстояния до 3 А, обеспечивая плотную укладку; внутри двойной спирали воды нет. Цепи ориентированы антипараллельно, то есть «напротив» 5'-конца одной цепи находится 3'-конец другой. При нагревании вязкость ДНК понижается - происходит денатурация, распад вторичной структуры; при охлаждении происходит ренатурация повторное образование двойной спирали.
**Ароматическое взаимодействие (или π-π взаимодействие) — это нековалентное взаимодействие между органическими соединениями, содержащими ароматические компоненты. π-π взаимодействия вызываются межмолекулярным перекрыванием p-орбиталей в π-сопряженных системах, так что они становятся сильнее, поскольку число π-электронов возрастает.
В ДНК и РНК параллельный стэкинг имеет место между соседними парами нуклеотидов и повышает стабильность молекулярной структуры. Азотистые основания нуклеотидов имеют пуриновые или пиримидиновые группы в своем составе, состоящие, в свою очередь, из ароматических колец. В молекуле ДНК ароматические кольца расположены примерно перпендикулярно оси спирали, поэтому их поверхности расположены параллельно, что способствует перекрыванию p-орбиталей этих оснований.
Теперь можно выписатьутверждения, характеризующие струкутру ДНК:
1. Изогеометрические комплементарные пары – регулярность структуры двойной спирали
2. Стекинг - взаимодействия - «стопка домино»
3. Анти-параллельность двух цепей
4. Денатурация («расплетание») двойной спирали Ренатурация («образование») двойной спирали.
Под «топологически замкнутыми» или кольцевой понимают молекулы, свободное вращение концов которых затруднено т.е. кольцевые молекулы ДНК либо линейные молекулы, концы которых зафиксированы белковыми структурами. Образующаяся в результате сверхспирализации ДНК иногда называется суперскрученной.
Кольцевую ДНК, совершенно лишенную суперспиральных витков, называют релаксированной. Для того чтобы превратить релаксированную ДНК в суперспирализованную, необходимо затратить определенную энергию. Например, энергия, затрачиваемая на образование 15 суперспиральных витков в одной молекуле ДНК вируса SV-40 (ее контурная длина 1,7 мкм), составляет около 100 ккал/моль. Энергия напряжения суперспирализованной ДНК (энергия суперспирализации) примерно пропорциональна квадрату числа суперспиральных витков.
Суперспирализация выполняет две биологические функции. Во-первых, суперспирализованная ДНК имеет более компактную форму, чем релаксиро-ванная ДНК такой же длины. Суперспирализация может играть определенную роль в упаковке ДНК. Во-вторых, суперспирализация может влиять на степень расплетания двойной спирали и, следовательно, на ее взаимодействия с другими молекулами.
Если взяться за концы верёвки и начать скручивать их в разные стороны, она становится короче и на верёвке образуются «супервитки». Так же может быть суперскручена и ДНК. В обычном состоянии цепочка ДНК делает один оборот на каждые 10,4 основания, но в суперскрученном состоянии спираль может быть свёрнута туже или расплетена. Выделяют два типа суперскручивания: положительное — в направлении нормальных витков, при котором основания расположены ближе друг к другу; и отрицательное — в противоположном направлении. В природе молекулы ДНК обычно находятся в отрицательном суперскручивании, которое вносится ферментами — топоизомеразами. Эти ферменты удаляют дополнительное скручивание, возникающее в ДНК в результате транскрипции и репликации.
**Сверхспирализация важна во множестве биологических процессов, таких как, например, компактизация ДНК. Определённые ферменты, в частности топоизомеразы, обладают способностью изменять топологию ДНК, например, для репликации ДНК или транскрипции.
Функции ДНК:
ДНК является носителем генетической информации, записанной в виде последовательности нуклеотидов с помощью генетического кода. С молекулами ДНК связаны два основополагающих свойства живых организмов — наследственность и изменчивость. В ходе процесса, называемого репликацией ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении, отсюда следует, что образовавшиеся клетки оказываются генетически идентичны исходной.
Генетическая информация реализуется при экспрессии генов в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК).
Последовательность нуклеотидов «кодирует» информацию о различных типах РНК: информационных, или матричных (мРНК), рибосомальных (рРНК) и транспортных (тРНК). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции. Роль их в биосинтезе белков (процессе трансляции) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке, рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых — сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков — в активный центр рибосомы, «ползущей» по иРНК.
Первичная, вторичная и третичная структуры РНК. Функции РНК.
Рибонуклеиновые кислоты представляют собой полимеры из нуклеозидфосфатных звеньев, соединенных фосфодиэфирной связью. В качестве азотистых основанийвРНК присутствуют урацил, цитозин, аденини тимин. В РНК можнотакже встретить множество необычных и модифицированных азотистых оснований.
РНК принимают участие во всех стадиях процесса генной экспрессии и биосинтеза белка. Свойства наиболее важных видов РНК приведены в таблице. Кроме того, здесь схематически показаны вторичные структуры молекул РНК.

В отличие от ДНК, РНК не образуют двойных спиралей, но содержат короткие участки со спаренными основаниями. Это приводит к образованию субструктур, которые при двумерном изображении напоминают «шпильки» и петли, образующие фигуру типа «кленового листа». В таких структурах двухцепочечные участки соединены петлями. Множество фрагментов, в которых чередуются структуры типа шпилька—петля, содержится в высокомолекулярных РНК. Кроме того, эти фрагменты образуют трехмерные структуры; следовательно, РНК подобно белкам имеют четвертичную структуру. До настоящего времени установлена четвертичная структура небольших PHK, прежде всего тРНК (tRNA).
PHK клетки существенно различаются по размерам, строению и продолжительности существования. Преобладающую часть представляют рибосомные РНК (рРНК), которые в различных формах составляют структурный и функциональные части рибосом. Рибосомные РНК синтезируются в ядре в процессе транскрипции на ДНК.
Матричная РНК (мРНК)переносит генетическую информацию из клеточного ядра в цитоплазму. Ее транскрипты также сильно модифицируются в ядре. Так как мРНК считывается на рибосоме кодон за кодоном она не должна складываться в стабильную третичную структуру. Спариванию оснований препятствуют белки, ассоциированные с мРНК. Из-за различного объема информации, которую могут нести мРНК, РНК этого типа сильно варьируют по размерам. Для мРНК характерно короткое время жизни, так как они быстро распадаются после трансляции. В сплайсинге(сращивать или склеивать концы чего-либо, см. далее) предшественников мРНК принимают участие малые ядерные РНК (мяРНК). Они ассоциированы c рядом белков, образуя «сплайсомы».
Отдельно следует поговорить о транспортной РНК.
 Транспортные РНК (тРНК) участвуют в процессе трансляции в качестве промежуточного связующего звена между нуклеиновыми кислотами и белками. Это небольшие молекулы РНК из 70-90 нуклеотидов, которые с помощью своих антикодонов "узнают" за счет спаривания оснований определенные кодоны на мРНК. На 3'-конце (ССА-3') они несут ту аминокислоту, которая согласно генетическому коду соответствует очередному кодону мРНК.
Транспортные РНК (тРНК) участвуют в процессе трансляции в качестве промежуточного связующего звена между нуклеиновыми кислотами и белками. Это небольшие молекулы РНК из 70-90 нуклеотидов, которые с помощью своих антикодонов "узнают" за счет спаривания оснований определенные кодоны на мРНК. На 3'-конце (ССА-3') они несут ту аминокислоту, которая согласно генетическому коду соответствует очередному кодону мРНК.
Последовательность основанийи третичная структура фенилаланинспецифичной тРНК (tRNAPhe) из дрожжей являются типичными для всех тРНК. В молекуле этой тРНК содержится довольно много минорных и модифицированных оснований.
**Антикодо́н — триплет (тринуклеотид), участок в транспортной рибонуклеиновой кислоте (тРНК), который спаривается с кодоном матричной РНК (мРНК) и обеспечивает включение соответствующего аминокислотного остатка в белок в процессе трансляции.
**Описание последнего рисунка частично опущено.
Резюме
Структура РНК
Молекулы РНК в отличие от ДНК построены из одной полинуклеотидной цепи. Первчиная структура РНК анологична первичной структуре ДНК за исключением того, что в вместо дезоксирибонуклеиновой кислоты в РНК присутствует рибонуклеиновая кислота.
Вторичная структура РНК зависит от её функций: для м-РНК это α-спираль, аналогичная а-спиралям белков и удерживаемая за счёт стэкинг-взаимодействий между основаниями. Вторичная структура т-РНК «клеверный лист», три «шпильки» и стебли комплиментарных оснований; одна из «шпилек» обязательно содержит антикодон, а стебель без «шпильки» - конец, способный удерживать аминокислоту. Р-РНК образуют сложные структуры.
Третичная структура РНК - образование сверхспиралей м-РНК и т-РНК; механизм образования таких сверхспиралей схож с механизмом образования сверхспиралей ДНК.
Функции РНК :
1. Передача генетической информации.
2. Синтез полипептидных цепей белка. 3
3. Каталитическая (рибозимы ферменты, являющиеся комплексами РНК и белка; РНК также может катализировать сама себя, выступая в роли РНК-зависимой РНК- полимеразы).
Репликация ДНК.
Реплика́ция— процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой.
Репликация проходит в три этапа:
1. инициация репликации
2. элонгация
3. терминация репликации.
Регуляция репликации осуществляется в основном на этапе инициации. Репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации.Таких сайтов может быть как всего один, так и много. С понятием сайта инициации репликации тесно связано понятие репликон. Репликон — это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Геномы бактерий, как правило, представляют собой один репликон, это значит, что репликация всего генома является следствием всего одного акта инициации репликации. Геномы эукариот (а также их отдельные хромосомы) состоят из большого числа самостоятельных репликонов, это значительно сокращает суммарное время репликации отдельной хромосомы.
Репликация начинается в сайте инициации репликации с расплетания двойной спирали ДНК, при этом формируется репликационная вилка — место непосредственной репликации ДНК. В каждом сайте может формироваться одна или две репликационные вилки в зависимости от того, является ли репликация одно- или двунаправленной. Более распространена двунаправленная репликация. В репликационной вилке ДНК копирует крупный белковый комплекс (реплисома), ключевым ферментом которого является ДНК-полимераза. Репликационная вилка движется со скоростью порядка 100 000 пар нуклеотидов в минуту у прокариот и 500-5000-у эукариот.
Ниже схематично рассмотрен процесс репликации.
Дата добавления: 2018-06-01; просмотров: 4852; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
