Реакции обмена, протекающие в растворах, идут до конца только в том случае, если образуется осадок, газ или вода.
Степень окисления. Окислительно-восстановительные реакции.
Степень окисления– это условный заряд, который приобрел бы атом в молекуле, если бы все электронные пары его химических связей сместились в сторону более электроотрицательных атомов.
1. Степень окисления атомов в простых веществах равна нулю: 0 0 0
H2, Cl2, Na .
2. В сложных веществах О-2 (за исключением фторида кислорода О+2F-12 и пероксидов, например Н+12О-12)
3. В сложных веществах Н+1(за исключением гидридов, например Na+1H-1)
4. Во всех соединениях с другими элементами F-1
5. СО металлов всегда положительна, максимальное значение СО металлов главных подгрупп обычно совпадает с номером группы, в которой расположен металл.
Алгебраическая сумма степеней окисления всех атомов в соединении всегда равна нулю, а в сложном ионе – заряду иона:
+1 -2
H2SO4
(+1)·2 + (+6)·1 + (–2)·4 = 0
В реакциях ионного обмена составные части веществ переходили в состав других веществ без изменений, степени окисления элементов и заряды ионов не менялись:
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO3 + HCl = AgCl + HNO3
Однако существует огромное множество реакций, в ходе которых меняются степени окисления элементов.
|
|
|
Например: 0 0 +2 -2
Fe + S = FeS
Степень окисления Fe изменялась с 0 до +2, значит, атом железа отдал 2 электрона; атом S принял 2 электрона, поэтому его степень окисления изменилась с 0 до -2.
Химические реакции, в результате которых происходит изменение степеней атомов химических элементов или ионов, образующих реагирующие вещества, называютокислительно-восстановительными реакциями.
Элемент, отдающий электроны, называется восстановителем, а принимающий электроны - окислителем.
Процесс отдачи электронов называется окислением, а принятия - восстановлением.
В процессе окисления степень окисления повышается, в процессе восстановления - понижается.
Эти процессы неразрывно связаны между собой, число принятых окислителем электронов должно быть равно числу отданных восстановителем электронов. На этом основании составляется электронный баланс и расставляются коэффициенты.
Чтобы составить схему о-в процесса, необходимо:
1. Определить степень окисления элементов.
0 0 +3 -2
|
|
|
Al + S = Al2S3
2. Определить элементы, изменившие степень окисления.
0 0 +3 -2
Al + S = Al2S3
3. Составить схему: определить элемент, теряющий, и элемент, принимающий электроны.
окисление
Al0 - 3ē → Al+3
восстановление
S0 + 2ē → S-2
4. Составить электронный баланс (число отданных электронов всегда должно равняться числу электронов, принятых).
Наименьшее общее кратное равно 6.
Коэффициент для алюминия - 2, для серы - 3.
окисление
восстановитель Al0 - 3ē → Al+3 2
восстановленеие
окислитель S0 + 2ē → S-2 3
5. Расставить коэффициенты в уравнении по электронному балансу, определить окислитель и восстановитель.
2Al + 3S = Al2S3
Алканы, общая формула. Общие признаки алканов. Изомерия. Химические свойства алканов на примере метана.
Углеводороды - органические соединения, молекулы которых состоят из углерода и водорода.
К насыщенным (предельным) углеводородам принадлежат алканы. Алканы - углеводороды, в молекулах которых атомы связаны одинарными связями.
|
|
|
СnH2n+2 Общая формула алканов.
Признаки алканов:
1) Тетраэдрическое строение
2) Валентный угол 109⁰ 28'
3) sp3 -гибридизация
4) λ связи С-Н = 0,154 нм.
Изомерия.
Изомерия алканов обусловлена разветвленностью углеродного скелета.
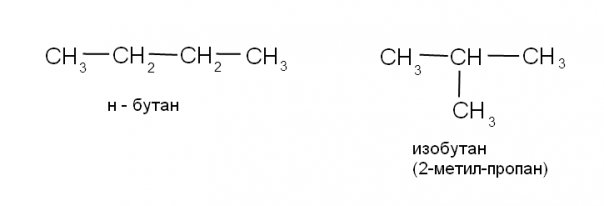
Химические свойства
Для алканов характерныреакции замещенияатомов водорода на другие атомы или группы атомов.
Реакция галогенирования.


Реакция горения.
СН4 + 2О2 → СО2 + 2Н2О + 880 кДж. При горении углеводородов всегда образуются СО2 и Н2О.
Дата добавления: 2018-06-01; просмотров: 841; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
