Получение карбонильных соединений
Nbsp; Карбонильные соединения. Часть 1 Карбонильные соединения - вещества, в состав которых входит карбонильная (оксо-) группа C=O. · Эти вещества разделяют на два класса: альдегиды и кетоны. · В молекулах альдегидов карбонильная группа связана хотя бы с одним атомом водорода. · В кетонах карбонильная группа связана с двумя углеводородными заместителями. Предельные карбонильные соединения имеют общую формулу: CnH2nO Простейший альдегид – формальдегид, муравьиный альдегид или метаналь: Простейший кетон – ацетон, диметилкетон или пропанон:
Номенклатура
Существует несколько способов называть карбонильные соединения.
1. Названия альдегидов и кетонов строятся путем прибавления суффикса «-аль» или «-он» к названию соответствующего алкана и – при необходимости – указания атома углерода, при котором находится карбонильная группа. Нумерацию углеводородной цепи ведут с того конца, к которому ближе карбонильная группа. Например:
2. Кетоны часто называют путем перечисления заместителей, связанных с карбонильной группой и прибавлением слова «кетон». Например:
3. Многие альдегиды и кетоны имеют тривиальные названия:
| HCOH | Муравьиный альдегид, формальдегид |
| CH3CHO | Уксусный альдегид, ацетальдегид |
| CH3CH2CHO | Пропионовый альдегид |
| CH3CH2CH2CHO | Масляный альдегид |
| CH3CH2CH2CH2CHO | Валериановый альдегид |
| CH2=CHCHO | Акриловый альдегид, акролеин |
| CH3C(O)CH3 | Ацетон |
| CH3C(O)C6H5 | Ацетофенон |
| C6H5C(O)C6H5 | Бензофенон |
|
|
|
Изомерия
· У предельных альдегидов может быть только структурная изомерия углеродного скелета;
· У предельных кетонов может быть структурная изомерия углеродного скелета и изомерия положения карбонильной (кетонной) группы;
· Межклассовая изомерия:
а) альдегиды изомерны кетонам;
б) карбонильным соединения изомерны: непредельные спирты (алкенолы) и циклические спирты (циклоалканолы).
Физические свойства
· По сравнению со спиртами альдегиды имеют более низкие температуры плавления и кипения из-за отсутствия водородных связей.
· Формальдегид при комнатной температуре газ, а ацетальдегид — легколетучая жидкость.
· Низшие альдегиды обладают резким, неприятным запахом, хорошо растворимы в воде. 40%-й водный раствор формальдегида (формалин) часто используют для хранения биологических препаратов.
· Некоторые высшие альдегиды обладают приятным запахом:
а) нонаналь содержится в розовом и лимонном масле;
б) бензальдегид – аромат миндальных орехов;
в) ванилин – аромат ванили:
|
|
|
· Простейший представитель кетонов — ацетон — это подвижная бесцветная жидкость с неприятным сладковатым запахом, неограниченно смешиваемая с водой. Однако некоторые низшие кетоны пахнут довольно приятно. В эфирном масле малины содержится 4-(n-гидроксифенил)-бутанон-2 (фрамбинон, кетон малины), обладающий ароматом и вкусом ягод малины:
Получение карбонильных соединений
1. Гидратация алкинов (присоединение воды, реакция Кучерова).
Присоединение воды к алкинам (реакция Кучерова) происходит в присутствии разбавленной серной кислоты и солей ртути(II). При этом образуется неустойчивый енол, который изомеризуется в карбонильное соединение (альдегид – в случае ацетилена, кетон – в случае всех остальных алкинов).
Присоединение воды идет по правилу Марковникова, поэтому ТОЛЬКО ацетилен дает альдегид (кислород на крайнем атоме углерода), все остальные алкины дают кетоны (кислород НЕ на крайнем атоме углерода). Пример:
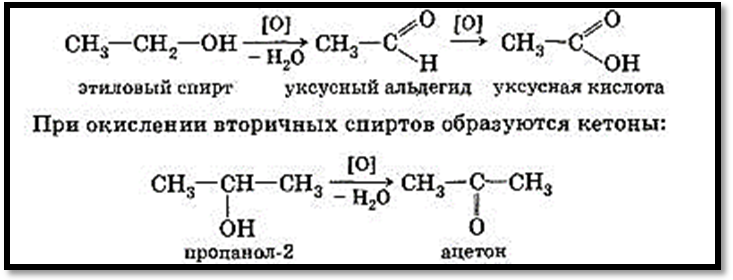
2. Мягкое окисление спиртов. Проводят двумя способами:

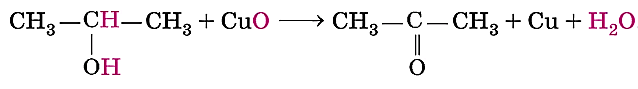
Оксид меди (II) при нагревании окисляет первичные спирты в альдегиды, а вторичные спирты в кетоны.
Аналогичная реакция протекает при пропускании паров спирта через раскаленную медную трубку:
|
|
|

3. Жесткое окисление спиртов. Проводят добавляя к спирту KMnO4 или K2Cr2O7 в присутствии серной кислоты.
При этом первичные спирты окисляются сначала в альдегиды, которые превращаются в кислоты (выделить альдегид очень сложно, т.к. он сам очень легко окисляется, поэтому всегда пишем кислоту!). Метанол окисляется в CO2.
Вторичные спирты окисляются в кетоны.
Третичные спирты не окисляются без разрыва С-С связей. В жестких условиях их тоже можно разорвать, но это не стандартная реакция.

4. Щелочной гидролиз дигалогеналканов, у которых оба атома галогена располагаются на одном атоме углерода.
На первой стадии образуется диол с двумя гидрокси-группами на одном атоме углерода. Такие молекулы неустойчивы. И далее происходит отщепление воды с перестройкой электронной плотности, в результате чего образуется карбонильное соединение.
Суммарно:
Пример с образованием кетона:
5. Дегидрирование спиртов (газовая фаза над Cu, Ag, Cr, Ni, ZnO и т.п.).
6. Кумольный способ. Окисление кумола (изопропилбензола) кислородом воздуха с образованием фенола и ацетона.
|
|
|
7. Формальдегид получают окислением метанола кислородом:

Реакция происходит на раскалённой серебряной сетке, через которую проходят пары метанола, смешанные с воздухом. Реакция настолько экзотермична, что выделяющейся в ходе её теплоты достаточно для того, чтобы поддерживать сетку в раскалённом состоянии.
8. Промышленное получение уксусного альдегида (Вакер-процесс):
окисление этилена кислородом воздуха в присутствии катализаторов на основе хлоридов палладия и меди (одновременно, а не или-или)
9. Ацетон получают разложением кальциевой или бариевой соли уксусной кислоты — продукта сухой перегонки древесины. Сейчас этот метод иногда используют в лабораториях для получения других кетонов.
В свернутом виде:

Дата добавления: 2018-06-01; просмотров: 1389; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
