МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
На правах рукописи
ПОТАПОВА
МАРИЯ ВАЛЕРЬЕВНА
АНАЛИЗ СТРУКТУРЫ И ЭКСПРЕССИИ РАЙОНА ЛОКАЛИЗАЦИИ ГЕНА flamenco У Drosophila melanogaster
03.02.07 – генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2010
Работа выполненана кафедре генетики биологического факультета МГУ имени М. В. Ломоносова
Научный руководитель: доктор биологических наук, профессор
КИМ Александр Иннокентьевич
Официальные оппоненты: доктор биологических наук, профессор
КУЗИН Борис Александрович
доктор биологических наук
КАЛМЫКОВА Алла Ивановна
Ведущая организация:Институт молекулярной биологии им. В. А.Энгельгардта РАН.
Защита диссертации состоится « » 2010 г. часов на заседании диссертационного совета Д 002.238.01 в Учреждении Российской академии наук Институте биологии развития им. Н. К. Кольцова РАН по адресу:
119334, Москва, ул. Вавилова, д. 26.
Сайт: http://idbras.comcor.ru/; e-mail: idbras@bk.ru.
С диссертацией и авторефератом можно ознакомиться в библиотеке и на сайте Учреждения Российской академии наук Института биологии развития им. Н. К. Кольцова РАН.
Автореферат разослан «___»______________2010 года.
Ученый секретарь диссертационного совета,
кандидат биологических наук Абрамова Елена Борисовна
ele0806@yandex.ru
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
|
|
|
Актуальность проблемы
Drosophia melanogaster – излюбленный модельный объект для исследования структурной и функциональной организации эукариотического генома, и, в том числе, его мобильного компонента. В последние годы особое внимание уделяется изучению мобильного генетического элемента (МГЭ) gypsy (МДГ4). Элемент gypsy относится к ретротранспозонам, перемещающимся с помощью РНК-интермедиата, и имеет три открытые рамки считывания (ОРС), гомологичные ОРС ретровирусов позвоночных. Наличие функциональной третьей ОРС, кодирующей белок оболочки вирусных частиц, способности к инфицированию клеток in vivo и горизонтальному переносу позволило отнести gypsy к настоящим ретровирусам беспозвоночных (Kim et al., 1994), а D. melanogaster использовать в качестве модели для их исследования. Актуальность изучения ретровирусов дрозофилы, и, следовательно, ретротранспозонов обусловлена тем, что к классу ретровирусов относится и вирус иммунодефицита человека. Его структура принципиально не отличается от структуры ретровирусов насекомых. Не исключено, что схожи и механизмы передачи, контроля развития инфекции и защиты организма от нее.
Спонтанные транспозиции МГЭ чрезвычайно редки, но в некоторых случаях перемещения происходят с повышенной частотой, что может стать причиной генных мутаций и приводить к хромосомным перестройкам. Особенно опасна активность МГЭ в клетках полового пути, поскольку вызываемые ими мутации будут аккумулироваться в следующих поколениях (Brennecke et al., 2007). Для изучения транспозиции МГЭ у D. melanogaster была получена нестабильная мутаторная линия (mutator strain – МS), которая ведет свое происхождение от стабильной лабораторной линии (stable strain - SS) и характеризуется увеличенной до 10-3-10-4 частотой спонтанного мутирования и активной транспозицией gypsy при неизменной локализации других элементов (Ким и др., 1989). Поскольку в норме частота транспозиции снижена, следовательно, у D. melanogaster существует ген (гены), который участвует в контроле транспозиции gypsy. Таким геном оказался недавно обнаруженный ген flamenco (Prud’homme et al., 1995), который пока клонировать не удалось. С помощью молекулярной конструкции на основе Р-элемента и гена yellow (Р[yellow])был получен инсерционный мутант D. melanogaster с фенотипом flamenco (Robert et al., 2001), который характеризуется повышенной частотой транспозиции МГЭ. В области инсерции, локализованной в районе 20А3-А5 Х-хромосомы, находится кластер из 8 ОРС, которые транскрибируются в одном направлении. На расстоянии 1,5 т.п.н. от инсерции расположен ген DIP1, за ним следуют две ОРС (CG32500 и CG32819), последовательно повторенных три раза, а завершает кластер ОРС CG14476. Любая из этих 8 ОРС могла бы претендовать на роль гена flamenco.
|
|
|
|
|
|
С другой стороны от точки инсерции находится область размером около 200 т.п.н., богатая дефектными копиями МГЭ, преимущественно транскрибируемых в одном направлении. Известно, что в контроле транспозиций МГЭ важную роль играют процессы РНК-интерференции. Короткие молекулы РНК – piРНК (Piwi interacting РНК) связываются комплементарно с мРНК МГЭ, которые в дальнейшем деградируют. Большое количество последовательностей piРНК обнаружено на антисмысловой цепи гена DIP1 в районе локализации гена flamenco. Таким образом, можно предполагать, что продуктом гена flamenco может быть молекула РНК-предшественника, после процессинга которого образуется множество piРНК.
Формирование фенотипа flamenco может быть обусловлено изменениями в структуре ДНК или уровне транскрипции РНК любой из 8 обнаруженных ОРС или влиянием на экспрессию области, богатой дефектными копиями МГЭ. Отсюда возникает необходимость исследования структурной организации этого района Х-хромосомы и анализа его экспрессии в линиях D. melanogaster, мутантных и нормальных по гену flamenco.
|
|
|
Цель и задачи исследования. Цель настоящей работы – исследование молекулярной природы района гена flamenco, осуществляющего контроль транспозиции ретротранспозона-ретровируса gypsy у Drosophila melanogaster.
В работе предстояло решить следующие задачи:
1. Исследовать структурную организацию генов, входящих в район локуса flamenco в линиях D. melanogaster, мутантных и нормальных по гену flamenco.
2. Провести анализ структуры и экспрессии гена DIP1 у видов Drosophila, родственных D. melanogaster.
3. Провести сравнительный анализ экспрессии генов, входящих в район локуса flamenco, на уровне транскрипции на разных стадиях развития в линиях D. melanogaster, мутантных и нормальных по локусу flamenco методом ОТ-ПЦР.
4. Провести сравнительный анализ экспрессии на уровне транскрипции прицентромерного района Х хромосомы в области локализации локуса flamenco (ОТ-ПЦР, ПЦР в режиме реального времени).
Научная новизна и практическая значимость работы
Впервые проведено комплексное исследование структуры и экспрессии района локализации гена flamenco. Исследована структура и экспрессия кластера генов DIP1, CG32500, CG32819 и CG14476, входящих в район локализации гена flamenco. Показано, что гены CG32500, CG32819 и CG14476 в линиях flamenco и flamenco+ не участвуют в формировании фенотипа flamenco, в отличие от гена DIP1.
Впервые установлена специфичность транскрипции изучаемых генов на разных стадиях индивидуального развития D. melanogaster: эмбриональной, личинки 3 возраста и имаго.
Различия в структуре и экспрессии установлены только для ближайшего к точке инсерции гена DIP1 в линиях с фенотипами flamenco и flamenco+.
Впервые показано, что в транскрипции РНК-предшественника молекул piРНК принимает участие промотор дефектного мобильного элемента HB, аформирование фенотипа flamenco обусловлено нарушениями в процессах РНК-интерференции. Эти нарушения связаны со структурными изменениями в линиях с фенотипом flamenco, что ведет к изменению целостности молекулы РНК-предшественника piРНК.
Полученные данные могут быть использованы в дальнейшем для исследования механизмов контроля транспозиции у эукариот, процесса биогенеза piРНК в клетке в целом, и для изучения формирования мутантного фенотипа flamenco у D. melanogaster, который характеризуется повышенной частотой транспозиции МГЭ, в частности.
Личное участие автора.Вся работа выполнена непосредственно автором. Поставленные задачи решены с применением современных биоинформатических и молекулярно-генетических методов. Выводы сделаны на основании собственных оригинальных данных.
Апробация работы.Работа прошла апробацию наМеждународной конференции «Генетика в России и мире», посвященной 40-летию ИОГен им. Н. И. Вавилова РАН (Москва, 2006), Международной научной конференции «Current Evolutionary thinking in Biology, Medicine and Sociology», посвященная 90-летию со дня рождения академика Д. К. Беляева. (Новосибирск, 2007), на Международной конференции студентов, аспирантов и молодых ученых «Ломоносов» (Москва, 2007, 2008, 2009), на 1-й Международной конференции «Дрозофила в экспериментальной генетике и биологии» (Харьков, 2008), на IV съезде российского общества биохимиков и молекулярных биологов (Новосибирск, 2008), на V съезде Вавиловского общества генетиков и селекционеров (Москва, 2009), на Всероссийской конференции посвященной 10-летию кафедры генетики БГПУ им. М. Акмуллы (Уфа, 2009).
Публикации.По материалам диссертации опубликовано 12 печатных работ, из них статей в журналах, соответствующих Перечню ВАК – 3, тезисов докладов и материалов конференций – 9.
Структура и объем работы.Диссертационная работа изложена на 103 страницах, содержит 25 рисунков, 5 таблиц и состоит из следующих разделов: введения, обзора литературы, материалов и методов, результатов исследования, обсуждения результатов, выводов и списка литературы, включающего 129 цитируемых источника.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования.Лабораторные линии D. melanogaster (SS, MS, Oregon R (+Y+3), Р[yellow] – с фенотипом flamenco, линия flamenco+). Виды Drosophila из коллекции кафедры генетики МГУ: Drosophila sechellia, Drosophila mauritiana, Drosophila simulans, Drosophila erecta, Drosophila yakuba.
Штаммы Escherichia coli C600, JM109 из коллекции кафедры.
Условия культивирования лабораторных линий, получение личинок 3 возраста и эмбрионов 0-24 ч.Линии мух поддерживались в стандартных условиях: при температуре 25°С на питательной агаризованной среде.
Самцов и самок исследуемых линий flamenco+, SS, MS, Oregon R (+Y+3) помещали на чашки Петри при температуре 25°С на ночь. Эмбрионы собирали и помещали в пробирки объемом 1,5 мл для последующего выделения РНК.
Для получения личинок 3-го возраста самцов и самок по 10 штук помещали в пробирки. Через 3 сут отбирали личинок в пробирки объемом 1,5 мл для последующего выделения РНК. В линии flamenco+ отбирали только самцов.
Сбор семенников и яичников проводили у взрослых половозрелых особей (около 100 штук самцов или самок).
Клетки E. coli культивировали на агаризованной или в жидкой среде LB (Luria-Bertani) с карбенициллином (50 мкг/мл).
Приготовление компетентных клеток и трансформация E. coli. осуществлялись с помощью стандартных методик (Maniatis et al., 2001).
Выделение хромосомной ДНК и плазмидной ДНКосуществляли с помощью набора для выделения хромосомной ДНК«Fermentas» по протоколу.
Обработка ДНК ферментамипроводилась рестрикционными эндонуклезами по протоколам фирмы производителя «Fermentas».Лигирование с вектором для клонирования согласно протоколу «Promega».
Тотальную РНК из эмбрионов, личинок, имаго,яичников и семенников выделяли с помощью набора «Promega» согласно протоколу. Перед постановкой обратной транскрипции пробы (по 3 мкг тотальной РНК) обрабатывали ДНКазой I («Fermentas») для разрушения ДНК.
Обратная транскрипция (ОТ)проводилась с помощью набора для синтеза кДНК «Fermentas». В качестве матрицы использовали тотальную РНК, выделенную из яичников (семенников) изучаемых линий.
Полимеразная цепная реакции.Приготовление смеси для реакции выполняли по протоколу фирмы «Fermentas». Реакцию проводили в амплификаторе Amply4 («Biokom»). В качестве матрицы использовали хромосомную ДНК и кДНК, выделенную из: D. sechellia, D. mauritiana, D. simulans, D. erecta, D. yakuba, D. melanogaster (линии flamenco+, SS, MS и Oregon R (+Y+3)). Проводили амплификацию фрагментов ДНК и кДНК генов DIP1, CG32500, CG32819, CG14476,кДНК района локализации гена flamenco.В качестве контроля использовали фрагменты гена rp49.
ПЦР в реальном времени. Приготовления смеси с использованием набора реагентов фирмы «Fermentas» («Master Mix (SYBR)») проводили по протоколу фирмы производителя. Реакция проводилась в амплификаторе MiniOpticon Real-Time PCR System производства Bio-Rad Laboratories. Одновременно ставили отрицательные контроли для каждого образца: пробы, обработанные ДНКазой I и не прошедшие ОТ.
Секвенирование.Клонированные фрагменты ДНК были секвенированы в Институте общей генетики им. Н. И. Вавилова РАН.
Биоинформатические методы. Использованные программы: GenBank (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=Nucleotide) и база данных последовательностей генома D. melanogaster FlyBase (http://flybase.bio.indiana.edu/) для поиска нуклеотидных последовательностей; BLAST (http://flybase.org/blast/) для поиска гомологии генов; Vector NTI для работы с известными нуклеотидными последовательностями; ClustalW (http://www.ebi.ac.uk/Tools/clustalw/) для множественного выравнивания последовательностей; SoftBerry (linux1.softberry.com) для выявления экзон-интронного строения; Promoter Prediction (http://www.fruitfly.org/cgi-bin/seq_tools/promoter.pl) для поиска промоторной области; для обработки данных ПЦР в режиме реального времени использовали программное обеспечение фирмы «Bio-Rad» – CFX Manager.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование структуры гена DIP1 у D. melanogaster
По данным FlyBase в исследуемой области 20А1-5 размером более 300 т.п.н. обнаружено только 8 ОРС, организованных в кластер: ген DIP1, точка начала трансляции которого находится на расстоянии 1,5 т.п.н. от инсерции Р[yellow], две ОРС (CG32500 и CG32819), последовательно повторенных три раза (Robert et al., 2001), и завершает кластер ОРС CG14476 (Рис. 1). Функции гена DIP1 и остальных 7 генов кластера неизвестны.
Нами было сделано предположение, что инсерция в линии Р[yellow] может влиять на транскрипцию гена DIP1 или другого гена кластера. Если изменение экспрессии гена DIP1 приводит к фенотипу flamenco, то в линиях SS и MS функция гена DIP1 также должна быть нарушена вследствие изменений его структуры и/или экспрессии.
Проведенный рестрикционный анализ показал, что амплифицированный с праймерами DIPd4 и DIPr2 фрагмент в линиях SS и MS, в отличие от линий flamenco+ и Р[yellow], не содержит сайта рестрикции DraI в положении 1765 (Рис. 1). Эта мутация определяется мононуклеотидной заменой сайта узнавания ТТТААА на ТТТААG и является трансляционно незначащей.

Рис. 1. Схема области 20А5 локализации гена flamenco по данным FlyBase. Показано направление транскрипции 8 ОРС и дефектных МГЭ. Треугольником показана инсерция P[yellow]. Обозначены: сайты рестрикции DraI и их координаты; сайты локализации праймеров; ATG – предполагаемые сайты инициации трансляции, черным прямоугольником показан альтернативный экзон, стрелкой показано направление и локализация последовательности HB.
Кроме того, ген DIP1 в линиях MS, SS Oregon R (+Y+3), в отличие от линий flamenco+ и Р[yellow], содержит вставку, заключенную между двумя другими сайтами DraI(2297 и 2888) и обозначенную нами IdSS, размером 182 п.н. во втором интроне (Рис. 1). Выявленная вставка была утрачена в линиях Р[yellow] и flamenco+. Согласно Genbank комплементарная цепь последовательности второго интрона гена DIP1 содержит дефектную копию МГЭ HB размером ~1300 п.н. Выделенная вставка позволяет продлить область гомологии ОРС HB с генами Tc1-подобных транспозаз на величину последовательности IdSS.
Более того, нами обнаружены структурные отличия линии Oregon R (+Y+3) от линий MS, SS и flamenco+: вставка размером 173 п.н. в промоторной области гена DIP1, которая может влиять на уровень экспрессии гена DIP1, либо соседнего района. Эта вставка не обнаружена в промоторной области гена DIP1 у других линий D. melanogaster, но она присутствует в гомологичных областях у более молодых видов D. sechellia и D. simulans. Следовательно, в линиях D. melanogaster (flamenco+, MS, SS) произошла делеция этой последовательности.
Предположительно, МГЭ передвигались по геному, поэтому в результате делеций, сопровождавших этот процесс (линии Р[yellow] и flamenco+), их фрагменты обнаруживаются во втором интроне и начале гена DIP1. Таким образом, по нашим данным, из четырех исследуемых генотипов D. melanogaster генотип линии SS эволюционно самый древний, Oregon R (+Y+3) более молодой, Р[yellow] и flamenco+ самые молодые. Не исключено, что подобные изменения в нуклеотидной структуре исследуемого района способствовали появлению механизмов защиты от действия МГЭ и могут влиять на экспрессию гена DIP1.
Анализ экспрессии гена DIP1 у D. melanogaster
Ген DIP1 состоит из четырех экзонов, первый из которых может быть альтернативным. DIP1 кодирует несколько продуктов, образующихся в результате альтернативного сплайсинга пре-мРНК (DeSausa et al., 2003). В базе данных FlyBase приведены два названия одного и того же гена: DIP1 и Klett. Известны три варианта CDS (coding sequence), включающих сайт трансляции ATG1: DIP1-c, она же Klett-c (AF175711), DIP1-b, она же Klett-d (AF182154) и DIP1-d (AY217028), и два варианта CDS c альтернативным первым экзоном (с ATG2): Klett-a (AJ2500866) и Klett-b (AJ2500867). С ATG3, локализованного во втором экзоне, читается форма DIP1-a (AF175713) (Рис. 1).
Анализ продуктов альтерантивного сплайсинга гена DIP1, включающих сайт ATG1/ATG2методом ОТ-ПЦР с парами праймеров DIP d4-DIP r2, DIP d3-DIP r2 (Рис. 1) подтвердил наличие следующих форм: DIP1-c (1109 п.н.), DIP1-b (1063 п.н.), DIP1-d (713 п.н.), Klett-a (1113 п.н.) и Klett-b (1068 п.н.) (Рис. 2).
Нами исследована экспрессия гена DIP1 на 3-х стадиях индивидуального развития: у эмбрионов, личинок 3 возраста и имаго D. melanogaster. Во всех линиях на стадии имаго и у эмбрионов выявляются формы DIP-c, Dip-b и Dip-d, Klett-a и Klett-b (Рис. 2). Формы DIP-c и Klett-a транскрибируются преимущественно.
Мы установили, что экспрессия гена DIP1 D. melanogaster не является конститутивной, а зависит от возраста особей. В линиях flamenco+, SS, MS на стадии личинок транскрипции гена не выявлено. Однако в линии Oregon R (+Y+3)его транскрипция практически не снижена, что связано с наличием дополнительного промотора в области начала гена DIP1.
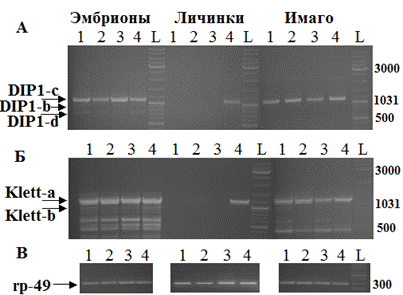
Рис. 2. Экспрессия гена DIP1 на разных стадиях развития мух линий flamenco+ (1), SS (2), MS (3), Oregon R (+Y+3) (4). Использованы пары праймеров: А. DIP d4-DIP r2 для оценки кДНК с ATG1; Б. DIP d3-DIP r2 для оценки кДНК с ATG2. В. Контрольная амплификация кДНК гена rp49. Стрелками показаны ПЦР-фрагменты. Маркер размера фрагментов ДНК (п.н.) (дорожка L) – GeneRuler DNA Ladder Mix («Fermentas»).
Обнаруженные нами многочисленные траскрипты свидетельствуют о многофункциональности гена. Но исследование его функции с помощью инактивации невозможно в связи с тем, что ген является жизненно важным (De Felice et al., 2004). Поэтому нами решено было провести сравнительный анализ структуры и экспрессии гена DIP1 у других видах Drosophila, близкородственных D. melanogaster.
Структурная организация и анализ экспрессии гомологов гена DIP1 в геномах D. sechellia, D. mauritiana, D. simulans, D. erecta и D.yakuba
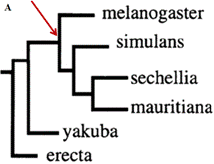
В настоящее время в базе данных FlyBase представлены секвенированные последовательности геномов двенадцати различных видов рода Drosophila. Наиболее близкими по структуре к гену DIP1 D. melanogaster являются гомологи, обнаруженные у представителей подгруппы melanogaster: D. sechellia, D. mauritiana, D. simulans, D. erecta и D. yakuba (Рис. 3А).
ПЦР-анализ хромосомной ДНК видов подгруппы melanogaster на наличие копий HB показал, что копии этого МГЭ присутствуют в геномах всех видов подгруппы, но ни в одной из нуклеотидных последовательностей гомологов гена DIP1 копий HB нет. Геном D. mauritiana в настоящее время не секвенирован, в отличие от геномов D. sechellia, D. simulans, D. erecta и D. yakuba, поэтому амплифицированные фрагменты были нами клонированы и секвенированы.
Анализ секвенированных последовательностей показал, что гомолог DIP1 у D. mauritiana, также как и гомологи гена у D. sechellia, D. simulans, D. erecta и D. yakuba, действительно не содержит HB. Этот мобильный элемент ранее перемещался по геному и попал в ген DIP1 после отделения D. melanogaster от общего эволюционного древа подгруппы melanogaster (Рис. 3А).


|
Рис. 3 А. Эволюционное дерево представителей подгруппы melanogaster, стрелкой показано внедрение НВ в геном D. melanogaster. Б-Е. Амплифицированные фрагменты ДНК и кДНК гена DIP1 и его гомологов видов D. melanogaster (mel), D. sechellia (sec), D. simulans (sim), D. mauritiana (mau), D. yakuba (yak), D. erecta (ere).Использованы пары праймеров: Б. ДНК, амплифицированная с праймерами DIPd1-DIPr1, +HB и –HB обозначено наличие/отсутствие HB внутри гена DIP1 и его гомологов;В. кДНК, амплифицированная с праймерами DIPd1-DIPr1.Г; ДНК, амплифицированная с праймерами DIPd2-DIPr1;Д. кДНК, амплифицированная с праймерами DIPd2-DIPr1; Е. Контрольная амплификация кДНК гена rp49. Маркер размера фрагментов (в п.н.) ДНК (дорожка L)
В области, соответствующей альтернативному первому экзону, у D. sechellia, D. simulans и D. mauritiana обнаружены делеции, которые могут привести к изменению экспрессии гомологов гена DIP1. У D. erecta и D. yakuba организация района совпадает с таковой у D. melanogaster.
Анализ экспрессии форм, образующихся с альтернативного первого экзона, однозначно свидетельствует об экспрессии форм Klett-a/Klett-b у D. erecta (Рис. 3Б-Е). У D. sechellia, D. simulans и D. mauritiana экспрессии с альтернативного первого экзона нет.
Таким образом, альтернативные формы транскриптов гена DIP1 (Klett-a/Klett-b) отсутствуют у более молодых, чем D. melanogaster, видов дрозофилы, и есть у более древних. По-видимому, альтернативные формы, не являясь основными у D. melanogaster, не поддерживались в процессе эволюции отбором, что привело к их утрате более молодыми видами. Отличия, связанные с изменением экспрессии гена DIP1, могут стать причиной формирования фенотипа flamenco и быть следствием инсерции в область локализации гена flamenco. Инсерция в свою очередь может влиять на экспрессию и соседних с DIP1 генов.
Анализ экспрессии генов кластера CG32500, CG32819 и CG14476 у D. melanogaster
По данным FlyBase ОРС CG32500, CG32819 и CG14476 содержат в кодируемой ими последовательности высоко консервативные домены. Размеры амплифицированных фрагментов хромосомной ДНК с парами праймеров совпадали с теоретически ожидаемым.
Мы установили, что экспрессия гена CG32500 на уровне транскрипции происходит на всех стадиях развития D. melanogaster, различия можно выявить лишь в количестве амплифицированного продукта: у личинок в отличие от эмбрионов и имаго уровень экспрессии гена снижен. В результате ПЦР-амплификации получен продукт размером ~800 п.н. (Рис. 4А), что соответствует продукту сплайсинга пре-мРНК согласно базе данных (FlyBase). Мы не обнаружили различий в экспрессии гена в линиях flamenco и flamenco+.

Рис. 4. Амплифицированные фрагменты на стадиях развития: эмбриональной, личинки 3 возраста, имаго. Линии flamenco+ (flam+), SS, MS, Oregon R (+Y+3) (OreR). Использованы пары праймеров: А. фрагменты гена CG32500; Б. фрагменты гена CG32819; В. фрагменты гена CG14476. Стрелками показаны ПЦР-фрагменты (в п.н.). Маркер размера фрагментов (в п.н.) ДНК (дорожка L)
Анализ данных по экспрессии гена CG32819 (рис. 4Б), свидетельствует о том, что он транскрибируется только у эмбрионов, а размеры производимой РНК соответствуют данным FlyBase (1803 п.н. и 1560 п.н.). Форма 1560 п.н. образуется в результате альтернативного сплайсинга (Рис. 4Б). На стадии имаго обнаружен единственный продукт размером 800 п.н. Он является артефактом, поскольку секвенированная последовательность не проявляет сходства с геном CG32819. На стадии личинок продуктов амплификации не выявлено. Таким образом, мы установили, что функция гена CG32819 важна только на ранних этапах развития дрозофилы во всех линиях.
Выявить различия в экспрессии гена CG14476 в линиях с фенотипами flamenco+ и flamenco не удалось (Рис. 4В). Продукт ОТ-ПЦР обнаружен на стадии имаго и у эмбрионов, у личинок экспрессия этого гена значительно снижена (Рис. 4В). Таким образом, экспрессия гена идет на всех стадиях развития особи. Размер полученного фрагмента (~2900 т.п.н.) соответствует размеру, представленного в базе данных.
Полученные нами данные по экспрессии генов кластера у D. melanogaster, свидетельствуют о том, что гены CG32500, CG32819 и CG14476 не участвуют в формировании фенотипа flamenco.
Эволюционный анализ кластера генов DIP1, CG32500, CG32819 и CG14476 у разных видов Drosophila
Подобная структурная организация 8 ОРС: трипликация генов CG32500, CG32819 и однонаправленность транскрипции может быть связана с перемещением мобильных генетических элементов. Транспозиции, приведшие к образованию кластера D. melanogaster, можно проследить при сравнительном анализе генов, гомологичных генам DIP1, CG32500, CG32819 и CG14476, у разных видов Drosophila. Исследования проводились с помощью биоинформатического анализа секвенированных геномов видов дрозофилы, находящихся в разной степени филогенетического родства. Последовательности геномов разных видов Drosophila секвенированы в конце 2007 года и размещены в базе данных FlyBase, но они еще не аннотированы.
Гомологи исследуемых генов кластера обнаружены в геномах всех исследованных видов.
На основании проведенного биоинформатического анализа построена схема эволюции кластера генов района flamenco (Рис. 5). Таким образом, гомологи генов кластера района гена flamenco присутствуют в геномах всех анализируемых видов, но ни в одном из них, структурная организация района не повторяет строение кластера у D. melanogaster.
Ген DIP1 консервативен у всех видов, причем у D. sechellia и D. simulans он существует в нескольких структурных вариантах. Таким образом, функция гена DIP1 является консервативной в разных видах дрозофилы.

Рис. 5. Эволюция кластера генов района гена flamenco. Показаны гомологи генов DIP1, CG32500, CG32819 и CG14476. Горизонтальными стрелками – возможные этапы сборки генов в кластер. В круг обведены гены, которые повторены 3 раза у D. melanogaster.
Поиск РНК-предшественника piРНК в области локализации гена flamenco
В области гена flamenco считывается значительное количество piРНК, участвующих в подавлении транспозиций МГЭ. Была выдвинута гипотеза, что в этой области транскрибируется длинная молекула-предшественник с антисмысловой цепи гена DIP1, дающая начало piРНК (Brennecke et al., 2007). Область локализации ближайшей к гену DIP1 piРНК картирована на расстоянии ~2500 п.н. от начала гена (Рис. 6).
Если предположить, что в линиях с фенотипом flamenco+ образуется единый однонитевой РНК-предшественник piРНК, который в результате процессинга дает начало множеству piРНК, то, очевидно, в линиях с фенотипом flamenco механизм образования коротких молекул РНК нарушен.
Причин нарушения может быть как минимум две: цельный транскрипт или не образуется в результате нарушения инициации транскрипции, или образуется, но не подвергается дальнейшему процессингу. Поиск единого РНК-предшественника piРНК был проведен методом ОТ-ПЦР с подобранными специфическими праймерами на РНК, выделенной из яичников линий flamenco+, MS, SS, Oregon R (+Y+3). Область исследования, праймеры и размер продуктов указаны на рис. 6.
Анализ ПЦР-продуктов на матрице кДНК подтвердил гипотезу о существовании в исследуемой области продуктов транскрипции. Продукты обнаруживаются как в районе между началом гена DIP1 и первой piРНК, так и внутри гена DIP1. Уровень экспрессии в линиях с фенотипом flamenco снижен по сравнению с уровнем flamenco+ линии (данные не приведены).

Рис. 6. Схема расположения праймеров в области гена flamenco.Фигурными скобками показаны амплифицированные фрагментов кДНК, указаны их размеры. Обозначен HB внутри второго интрона гена DIP1 и его предполагаемый промотор (Потапова и др., 2009). Обозначена предполагаемая молекула-предшественник. Треугольником обозначена инсерция (~1,5 т.п.н. от начала гена DIP1), приводящая к фенотипу flamenco. Пунктиром показано положение центромеры относительно района гена flamenco. Вертикальными пронумерованными линиями обозначены точки для анализа методом ОТ-ПЦР в режиме реального времени.
Таким образом, общий уровень экспрессии области flamenco в линиях SS и Oregon R (+Y+3) ниже, чем в flamenco+, что может быть связано со структурными особенностями линий: наличие вставки во втором интроне гена DIP1 в линиях SS и Oregon R (+Y+3) и увеличение области начала гена DIP1 в линии Oregon R (+Y+3) на 173 п.н.
Мы предположили, что молекула РНК-предшественника piРНК может транскрибироваться с промотора МГЭ НВ, локализованного в составе гена DIP1. Этому способствует направление транскрипции МГЭ НВ противоположное транскрипции гена DIP1 (Рис. 6). Биоинформатическим методом определена область предполагаемого промотора в элементе HB (Рис. 7Б), кроме промотора на комплементарной цепи гена DIP1 выявлены и другие промоторы (Рис. 7Б).

| 
|
Рис. 7. Поиск области предполагаемого промотора в последовательности HB. А. Схема локализации праймеров в гене DIP1. Отмечена предполагаемая область промотора, показан размер HB элемента. Штрих-линией обозначены продолжения гена DIP1. Б. Диаграмма с обнаруженными биоинформатически промоторами. По оси Y отложена вероятность нахождения промотора, по оси Х протяжённость DIP1 и прилегающей области в п.н. В круг обведены наиболее вероятные промоторные последовательности.
Для установления предполагаемой области начала транскрипции были подобраны несколько праймеров до и после предполагаемой точки начала транскрипции (Рис. 7А).В качестве матрицы для постановки ОТ со специфическим праймером RT1 for1 использовали РНК линий flamenco+, MS и Oregon R (+Y+3), выделенную из яичников.
Среди продуктов амплификации выявлены фрагменты нужной длины (соответствуют длине фрагментов, представленных в базе данных) с парами праймеров RT1 for1-RT1 rev1 и RT1 for1-RT1 rev2 (Рис. 7А). ПЦР-продукт с парой праймеров RT1 for1-RT1 rev3 обнаружен не был, что свидетельствует об отсутствии РНК-матрицы в конце второго интрона гена DIP1, левее предполагаемого промотора.
В то же время при наличии амплифицированного фрагмента с праймерами RT1 for1-RT1 rev2 можно утверждать о сдвиге области предполагаемого промотора. Тем более биоинформатический анализ показал возможность такого сдвига в район 3'-конца гена DIP1 (Рис. 7Б).
Таким образом, мы обнаружили, что молекула РНК-предшественника образуется как в линии flamenco, так и flamenco+, но обнаруженные ранее в линиях MS, SS и Oregon R (+Y+3) структурные изменения могут влиять на количество анализируемой матрицы.
Исследование области flamenco методом ПЦР в реальном времени
Намибыли подобраны пары праймеров в области flamenco (на рис. 6 вертикальными пронумерованными линиями показаны анализируемые точки). Для постановки ОТ в качестве затравок использовали 6 пар праймеров, которые отжигались одновременно на одной и той же матрице РНК, выделенной из яичников или семенников. Это позволяло оценить уровень транскрипции РНК исследуемых линий с фенотипом flamenco+ и flamenco по шести точкам. После серии аналогичных экспериментов данные были объедены и обработаны программой Bio-Rad CFX Manager (Рис. 8). Представлены диаграмма и график, соответственно, экспрессии в яичниках по семи анализируемым точкам в линиях flamenco+, MS и Oregon R (+Y+3). Линию SS в данных экспериментах не использовали.
Из диаграммы на (Рис. 8) видно, что в линии с фенотипом flamenco+ экспрессия в районе локализации гена flamenco в целом выше, чем в линии MS и Oregon R (+Y+3), особенно, в точках между началом гена DIP1 и началом скопления МГЭ. Скорее всего, это связано со структурными отличиями линий с фенотипом flamenco: наличие вставки в районе HB (линии MS, SS и Oregon R (+Y+3)), вставка в область начала гена DIP1 (линия Oregon R (+Y+3)). Область между геном DIP1 и первой обнаруженной piРНК, видимо, является регуляторной, поэтому в линии flamenco+, где не нарушена регуляции транспозиции МГЭ, она экспрессируется с большей эффективность и далее происходит снижение экспрессии за счет процессинга однонитевого транскрипта. Причем процессинг начинается только в районе скопления МГЭ, а в районе возможной регуляции остается на высоком уровне.

Рис. 8. Диаграмма экспрессии 6 анализируемых точек в районе локализации гена flamenco в линиях flamenco+, MS и Oregon R (+Y+3) на РНК, выделенной из яичников. Суммарные данные 7 независимых экспериментов нормализованы относительно референсного гена rp49. Показан доверительный интервал значений. Последовательность столбцов соответствует последовательности точек в области локализации гена flamenco.
В линии MS снижена экспрессия исследованного района (Рис. 8, 9). Резкое уменьшение количества РНК-предшественника выявляется во втором интроне гена DIP, что связано с наличием вставки в HB. Далее РНК обнаруживается во всех исследуемых точках, в том числе в области скопления дефектных копий МГЭ. Стабильное количество РНК в точках 4-6 (Рис. 9) свидетельствует о нарушении функции процессинга РНК-предшественника. Таким образом, вставка IdSS влияет на уровень экспрессии, но не на процесс образования piРНК. Процессинг может быть нарушен в следствие мутаций в генах, кодирующих белки, которые участвуют в биогенезе коротких молекул РНК (Pélisson et al., 2007).
Как и в линии MS, в линии Oregon R (+Y+3) наблюдается стабильный сниженный уровень экспрессии РНК. Снижение экспрессии выявлено только в области HB. Не исключено, что вставка внутри гена DIP1 влияет только на количество образованного транскрипта. Следующая же вставка (в начале гена DIP1) компенсирует эффект снижения и приводит к восстановлению уровня активного транскрипта. В результате, полноценная молекула РНК-предшественника подвергается процессингу. В данном случае фенотип flamenco не является следствием структурных изменений и обусловлен наличием другого, отличного от линии MS, аллеля flamenco. По-видимому, фенотип flamenco в линии Oregon R (+Y+3) обусловлен сниженным количеством piРНК, связанным с уменьшенным количеством РНК-предшественникаАналогичным образом по 5 точкам был исследован район локализации гена flamenco на РНК, выделенной из семенников. Анализируя данные, можно сделать вывод, что экспрессия в данном районе не проявляет никаких закономерностей.

| Рис. 9. РНК-предшественник в яичниках линии flamenco+, MS и Oregon R (+Y+3). Порядок и название точек соответствует порядку на рис. 7 и 8. |
По-видимому, РНК района локализации гена flamenco не принимает участие в сперматогенезе, в отличие от самок, для которых было доказано участие данного локуса в гаметогенезе(Brennecke et al., 2007).
ЗАКЛЮЧЕНИЕ
Процессы посттранскрипционного подавления экспрессии генов выполняют в организме функцию, направленную на репрессию чужеродных последовательностей ДНК- и РНК-содержащих вирусов и мобильных элементов. Эти механизмы являются очень эффективными в распознавании новых элементов, поскольку не зависят от конкретной структуры, особенностей размножения или кодируемых белков чужеродных последовательностей. Они обеспечивают подобие иммунной системы на уровне последовательностей нуклеиновых кислот, а не белков, при этом, в отличие от иммунной системы, образование фактора, специфически противостоящего заражению конкретным элементом, происходит в момент инфекции и не требует предварительных стадий.
Производимые в районе локализации гена flamenco piРНК участвуют в контроле транспозиции в половых клетках яичников у D. melanogaster. Причем, в каких именно, герминальных или фолликулярных, соматического происхождении, остается неизвестным. Важно отметить, что piРНК данного района взаимодействуют с белком Piwi. И путь образования piРНК с участием Piwi относят к механизму образования первичного класса piРНК. Первичные piРНК инициирует образование вторичных piРНК, амплификация которых выступает как мгновенный и эффективный путь защиты от действия атакующих постоянно геном МГЭ. Процесс амплификации особенно важен при гаметогенезе у самок. Ведь при активной транспозиции МГЭ необходимо обеспечить потомству подобие «иммунной» системы.
Полученные в работе данные однозначно свидетельствуют о наличии молекулы РНК-предшественника piРНК в линиях c фенотипами flamenco и flamenco+, что позволяет выдвинуть следующую гипотезу. С каждого промотора независимо синтезируются РНК различного (небольшого) размера, соответственно их концы могут также являться затравками для транскрипции, и происходит накопление транскрипта в линии flamenco+ (то есть в норме). Напротив, в линии MS, где наблюдается генетическая нестабильность, экспрессия снижена по сравнению с диким типом и вставка IdSS, изменяя последовательность, затормаживает цепную реакцию образования РНК. В линии Oregon R (+Y+3) наблюдается снижение эффективности транскрипции, как и в MS, при этом процессинг РНК-предшественника происходит. Следовательно, в этом случае включаются неизвестные механизмы восстановления синтеза РНК с последующим нарезанием на piРНК.
ВЫВОДЫ
1. Во втором интроне гена DIP1 у D. melanogaster обнаружен дефектный мобильный генетический элемент HB. В линиях с фенотипом flamenco внутри HB выявлена инсерция (IdSS) размером 182 п.н. Изучение экспрессии гена DIP1 в линиях D. melanogaster с разным статусом flamencoпоказало, что эта инсерция не только влияет на экспрессию гена DIР1, но и участвует в формировании фенотипа flamenco.
2. В линии дрозофилы Oregon R (+Y+3) с фенотипом flamenco в промоторной области гена DIP1 обнаружена вставка размером 173 п.н. Анализ экспрессии гена DIP1 в линиях D. melanogaster, отличающихся по статусу flamenco, на разных стадиях развития показал, что в линии Oregon R (+Y+3) транскрипция этого гена происходит конститутивно, в отличие от всех других исследованных линий.
3. Показано, что ген DIP1 состоит из четырех экзонов, первый из них может быть представлен двумя альтернативными вариантами. Анализ структуры и экспрессии гена DIP1 и его гомологов показал, что у D. simulans, D. sechellia, D. mauritiana первый альтернативный экзон представлен только одним структурным вариантом. По-видимому, функционально значимым является лишь один из альтернативных вариантов первого экзона гена DIP1.
4. Показано, что гены CG32500, CG32819 и CG14476, локализованные рядом с геном DIP1 и образующие с ним единый кластер, в линиях flamenco и flamenco+ не участвуют в формировании фенотипа flamenco.
5. В линиях flamenco MSне формируются короткие РНК из протяженного транскрипта, синтезируемого в районе мастер-локуса flamenco. Показано, что транскрипция длинного РНК-предшественника молекул piРНК начинается с многочисленных промоторов, один из которых локализован во втором интроне гена DIP1.
6. Показано, что в генетически нестабильной линии MS и Oregon R (+Y+3) район локализации локуса flamenco экспрессируется менее интенсивно, чем в линии flamenco+. В линии MS кроме нарушения процесса образования piРНК имеются нарушения в процессах элонгации образования функционального транскрипта-предшественника piРНК.
Работа выполнена при поддержке гранта РФФИ 08-04-00693 и частичной поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» (2009-2011 г.г.).
Дата добавления: 2018-05-31; просмотров: 323; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
