Будова та загальні способи одержання похідних 1,4-дигідро- піридину
 |
Похідні 1,4-дигідропіридину (1,4-ДГП) відомі людству більш ніж сто років, з того часу як Ганч розробив методи їх синтезу. Найбільшого розвитку хімія 1,4-дигідропіридинів досягла після використання в клінічній практиці високоефективного коронародилататора ніфедипіну (адалату, фенігідину) – 2,6-диметил-3,5-диметоксикарбоніл-4-(2ʼ-нітро- феніл)-1,4-дигідропіридину (1.1) [1, 2].
1.1
 |
Для одержання 1,4-ДГП загальної формули (1.2) використовують синтез Ганча [1], що являє собою конденсацію альдегіду, b-кетоестеру і амоніаку у співвідношенні 1 : 2 : 1[1, 3]:
1.2
R1 = CH3, C2H5;
R = 2-CF3, 3-CF3, 2-OCHF2, 4-OCHF2, 2-SCHF2, 2-SO2CF3, 2-OSO2CHF2, 2-OSO2CHF3, 4-OSO2CHF2. Також застосовуються різні модифікації синтезу Ганча, основні з яких представлено на рис. 1.1.
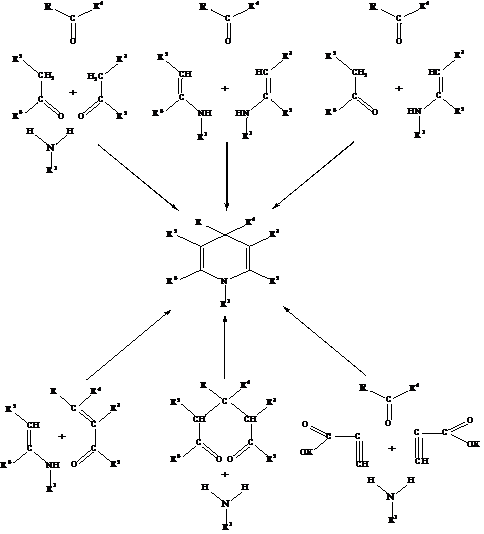 |
Рис. 1.1 Способи одержання 1,4-ДГП
Синтезовано велику кількість похідних 1,4-дигідропіридину з різноманітними варіаціями замісників, що володіють високою серцево- судинною активністю.
Найбільш активними за дією на серцево-судинну систему є 1,4-ДГП з арильними замісниками у положенні 4, найчастіше арил – це заміщений феніл. Такі сполуки одержують конденсацією естерів ацетооцтової кислоти, відповідного альдегіду і амоніаку в розчині етанолу. За таким само способом було отримано сполуку (1.2). Вказано, що 1,4-ДГП типу (1.2) проявляють коронарнорозширювальну та гіпотензивну дію [1, 4, 5].
|
|
|
У порівнянні з ніфедипіном (1.1) вони більш стійкі при зберіганні в твердому вигляді та окисненні у розчинах. 1,4-ДГП з пара-замісниками в арильному радикалі значно менш токсичні, однак їх гіпотензивна та коронаророзширювальна активність дуже мала.
Замісники в 3 та 5 положеннях 1,4-дигідропіридинового кільця мають дуже великий вплив на фармакологічну дію похідних 1,4-ДГП. Не лише заміна однієї естерної групи на іншу, але й заміна її на інші групи призводить до якісних та кількісних змін біологічної активності. Це пов’язано із будовою молекули 1,4-ДГП.
1,4-ДГП, що містять неідентичні замісники у положеннях 3 та 5, володіють такою властивістю, як хіральність. Два енантіомери можуть досить сильно відрізнятися за своєю активністю. Але на прикладах енантіомерно чистих 1,4-ДГП було показано, що несиметричні у положеннях 3 та 5 сполуки є більш активними, ніж симетричні; цікаво те, що більш активні з них ті сполуки в яких більш об’ємна естерна група зліва [6, 7].
В останній час стали отримувати 1,4-ДГП з нетрадиційними замісниками в положеннях 3,5, наприклад з залишками фосфатної кислоти.
Фосфорильовані 4-алкіл-1,4-дигідропіридини одержують з фосфорильованих енамінів і α,β-ненасичених карбонільних сполук. Пізніше були синтезовані багаточисленні похідні фосфорильованих 1,4-ДГП з різноманітними замісниками в дигідропіридиновому кільці (1.3) [1, 8, 9]:
|
|
|
 |
1.3
R = -CH3, -C2H5, -C3H7, -CH2CH2OC3H7, -(CH2)2N(CH3)CH2C6H5;
R1 = -CH3, -NHR³, -C6H5, -CH2SC6H5, -цикло-(CH2)6, -(CH2)6, -CH2OC6H4CF3-м
В результаті розрахунків та рентгеноструктурних аналізів різних похідних 1,4-ДГП типу ніфедіпіну (1.1) вказується, що такі сполуки мають конформацію ванни з 4-арильним замісником, який знаходиться в аксіальному положенні і є ортогональним по відношенню до площини дигідропіридинового кільця (1.4). Окрім того, замісник X має знаходитись по той же бік зв’язку C(4)–Ar, що й атом Гідрогену у C(4), тобто перевага надається синперепланарному ротамеру. Естерні групи знаходяться в екваторіальному положенні. При цьому для оптимальної активності необхідно, щоб карбоніли естерних груп були в цис-трансформації по відношенню до замісників в положенні 2 та 6 дигідропіридинового кільця.
 |
1.4
|
|
|
Велике значення має наявність орто-замісника в 4-арильному ядрі. Він сприяє синперипланарному та ортогональному розміщенню арильного залишку, а також цис/цис конформації естерних груп в 3 та 5 положеннях. Нещодавно було вказано, що в серії 1,4-ДГП (1.5) зі зростанням розміру орто-заміснику в бензеновому кільці найбільш активним як судинорозширюючий агент є 1,4-ДГП із найбільш об’ємним атомом йоду в орто-положенні 4-фенільного кільця [10].
 |
1.5
Hal = F, Cl, Br, I.
Якщо замісники у положеннях 3 та 5 різні, для біологічної активності необхідно, щоб у цис-конформації була ліва по відношенню до дигідропіридинового кільця естерна група. 1,4-ДГП, що містять неідентичні замісники у положеннях 3 та 5, володіють такою властивістю, як хіральність. Два енантіомери можуть досить сильно відрізнятися за своєю активністю. Але на прикладах енантіомерно чистих 1,4-ДГП було показано, що несиметричні у положеннях 3 та 5 сполуки є більш активними, ніж симетричні; цікаво те, що більш активні з них ті сполуки в яких більш об’ємна естерна група зліва. При зв’язуванні з рецептором права менша естерна група є важливою для утворення водневого зв’язку з звʼязуючою ділянкою, а більша ліва естерна група завдяки своїй ліпофільності повинна розміщуватися поруч з ліпофільною частиною звʼязуючої ділянки [11].
|
|
|
 |
В основі синтезусполукз замісниками в положеннях 2 та 6 тлежить або прямий синтез, або реакції заміщення. Наприклад, 2-метил-3-(2ʼ-нітрооксипропокси-карбоніл)-4-(3ʼ-нітрофеніл)-5-метоксикарбоніл-6-аміно-1,4-дигідро-піридин отримують конденсацією відповідного похідного бензиліденацетооцтової кислоти і амідину (1.6).
1.6
В деяких випадках використовують реакції нуклеофільного заміщення. Наприклад, бромують 1,4-дигідропіридини бромідом перброміду піридинію і в результаті заміщення брому в отриманому 6-бромметилпохідному (іноді без виділення останнього) отримують різні 1,4-дигідропіридини. Як приклад можна привести одержання 2-метил-3,5-диметоксикарбоніл-4-(2ʼ-хлорфеніл)-6-(2-аміноетилтіометил)- 1,4-дигідропіридину (1.7).
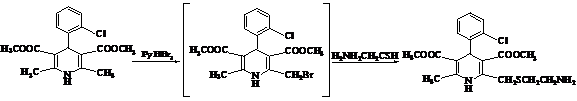
1.7
 |
До сполук, що виявляють позитивний інотропний ефект і є агоністами кальцію, відносяться й 1,4-ДГП, що містять лактонну групу (1.8) [12, 13].
1.8
Ar = C6H5-, 2-CF3C6H4-, 3-CF3C6H4-, 2-CHF2C6H4-, 2-CHF2OC6H4-, 2-CHF2SC6H4-;
R = Me, Et, Pr-i.
Міркування щодо 1,4-ДГП, які містять в положенні 3 нітрогрупу, підходять й до даного випадку – лактонну групу можна розглядати, як невеликий за розміром негативно заряджений замісник [14, 15]. Ті ж міркування можна віднести і до сполук, що містять у своєму складі ціаногрупу.
Дата добавления: 2018-05-13; просмотров: 747; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
