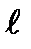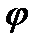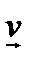Средняя квадратичная скорость
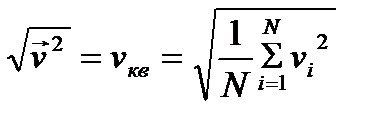
Средняя энергия поступательного движения молекул
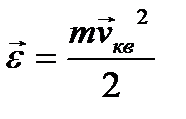
|
Температура – физическая величина,характеризующее степень нагретости тела.
Из опыта известно, что если два тела находятся в контакте в тепловом равновесии их температуры одинаковые.
Измерение температуры можно проводить косвенным путём по изменению физических свойств тел, с помощью которых измеряется температура. Такие тела называются термометрическими.
Шкала Цельсия- 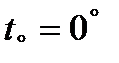 -температура таяния льда
-температура таяния льда
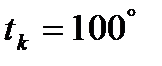 -температура кипения воды
-температура кипения воды
Это эмпирические шкалы температур.
Шкала Кельвина или термодинамическая шкала
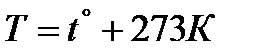
T=0K – значение температуры, при которой прекращается тепловое движение молекул вещества.
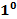 C=1K
C=1K
Величина температуры тела тесно связанна со скоростьюдвижения молекул, а также с внутренней тепловой энергией тела.
Из уравнения состояния идеального газа
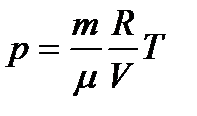 (1)
(1)
По закону Авогадро
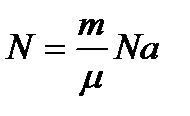 (2)
(2)
В результате получаем
 (3)
(3)
 - постоянная Больцмана
- постоянная Больцмана
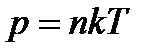
|

|
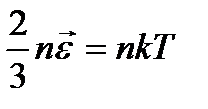
Если система замкнутая (т.е. нет теплообмена) и находится в термодинамическом равновесии (T=const) средняя кинетическая энергия молекул постоянна. (а ср. кв. скорости различные (если массы различные).
Закон Дальтона.
Имеется смесь газов с концентрациями 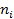 .
.
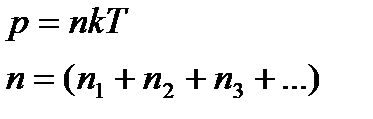
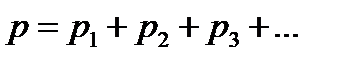
|
Давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
Распределение Максвелла
Молекулы газа движутся с различными скоростями претерпевая соударения
|
|
|
1) Направления движения молекулравновероятны. В любом направлении, в любой момент времени движется одинаковое количество молекул.
2) Вероятность того, что молекулы обладают очень большой или очень малой скоростью мала.т. е. при 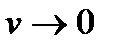 и
и 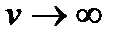 вероятность
вероятность 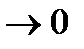
3) Следовательно, скорости молекул группируются где-то около наиболее вероятного при данных условиях значения.
Допустим нам удалось сделать мгновенную фотографию распределения по скоростям N молекул газа.

|
| 0 |
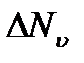
|
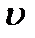
|
1) Плотность распределения молекул по скоростям зависит от интервала скоростейт.
е. является функцией скорости.
2) Для разных моментов времени, если газ находиться в равновесном состоянии (Т=const) распределение остаётся неизменным.
Введем функцию распределения молекул по скоростям, т.е. доля молекул в единичном интервале скоростей при заданном значении величины скорости или плотность вероятности, что скорость молекулы равна  :
:
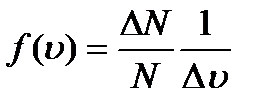
Вероятность того, что молекула обладает скоростьюв интервале dv равна
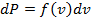
Вероятность того, что молекула обладает какой-то скоростью от 0 до  равна единице т.е.
равна единице т.е.
это достоверное событие или
|
|
|
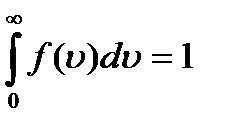 (*)
(*)
Вид функции был найден теоретически Максвеллом

|
Из условия нормировки функции (*) находим
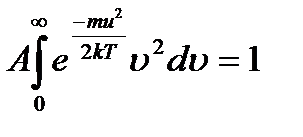
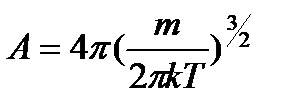
|
Функция распределения = произведению двух функций скоростей:
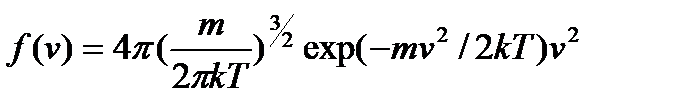
Функция распределения = произведению двух функций.
| 70% |

|
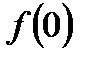
|
| 1 |

|
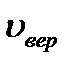
|

|
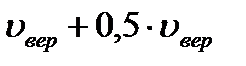
|
Площадь под кривой распределения равна 1.
Наиболее вероятная скорость –скорость, при которой f(v)=max
В этом случае
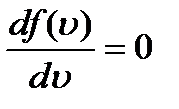
Из этого уравнения находим
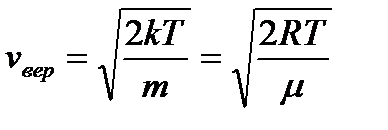

|

|
|
|
|
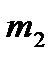
|
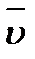
|
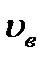
|

|

Средняя арифметическая скорость:

Для водорода при нормальных условиях 
Средне квадратичная скорость:
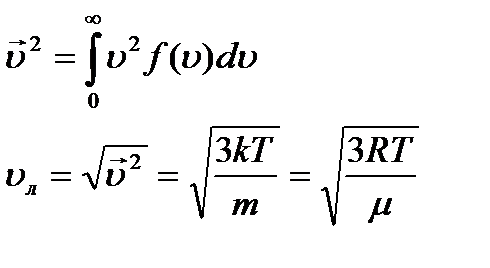
Опыт Штерна.
| R |
| S |
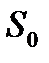
|

|
|

След получился несколько размытый, но можно было оценить среднею скорость и качественное распределение по скоростям.
Опыт Ламмерта
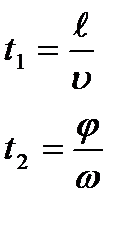
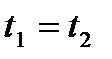
|
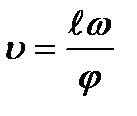
|
Получить распределение по скоростям.
За  вторая щель должна повернуться на
вторая щель должна повернуться на 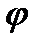

|
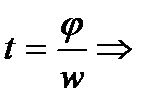
|
|
|
Дата добавления: 2018-05-12; просмотров: 670; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!