Б. Транспорт железа в плазме крови и его поступление в клетки
В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%.
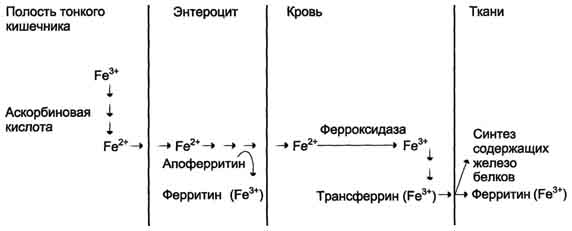
Рис. 13-7. Поступление экзогенного железа в ткани. В полости кишечника железо освобождается из белков и солей органических кислот пищи. Усвоению железа способствует аскорбиновая кислота, восстанавливающая железо. В клетках слизистой оболочки кишечника избыток поступившего железа соединяется с белком апоферритином с образованием ферритина, при этом ферритин окисляет Fe2+ в Fe3+. Поступление железа из клеток слизистой оболочки кишечника в кровь сопровождается окислением железа ферментом сыворотки крови ферроксидазой. В крови Fe3+ транспортирует белок сыворотки крови трансферрин. В тканях Fe2+ используется для синтеза железосодержащих белков или депонируется в ферритине.
Железо в клетке используется для синтеза железосодержащих белков или депонируется в белке ферригине.
Ферритин содержится почти во всех тканях, но в наибольшем количестве в печени, селезёнке и костном мозге. Незначительная часть ферритинаэкскретируется из тканей з плазму крови. Поскольку поступление ферэитина в кровь пропорционально его содержанию в тканях, то концентрация ферритина в крови - важный диагностический показатель запасов железа в организме при железодефидитной анемии. Метаболизм железа в организме представлен на рис. 13-8.
|
|
|
В. Регуляция поступления железа в клетки
Содержание железа в клетках определяется соотношением скоростей его поступления, использования и депонирования и контролируется двумя молекулярными механизмами. Скорость поступления железа в неэритроидные слетки зависит от количества белков-рецепторов трансферрина в их мембране. Избыток железа в клетках депонирует ферритин. Синтез шоферритина и рецепторов трансферринарегулируется а уровне трансляции этих белков и зависит от содержания железа в клетке.
15 Биохимический анализ крови
При развитии ЖДА в биохимическом анализе крови будут регистрироваться:
• уменьшение концентрации сывороточного ферритина;
• уменьшение концентрации сывороточного железа;
• повышение ОЖСС;
• уменьшение насыщения трансферрина железом.
Общий анализ крови
В общем анализе крови при ЖДА будут регистрироваться снижение уровня гемоглобина и эритроцитов. Умереннаяэритроцитопения может проявляться при Нb<98 г/л, однако снижение эритроцитов <2 х 1012/л для ЖДА не характерно.
При ЖДА будут регистрироваться изменения морфологических характеристик эритроцитов и эритроцитарных индексов, отражающих количественно морфологические характеристики эритроцитов.
|
|
|
Морфологические характеристики эритроцитов
Размер эритроцитов – нормальный, увеличенный (макроцитоз) или уменьшенный (микроцитоз). Для ЖДА характерно наличие микроцитоза.
Анизоцитоз – различия в размерах эритроцитов у одного и того же человека. Для ЖДА характерен выраженный анизоцитоз.
Пойкилоцитоз – наличие в крови одного и того же человека эритроцитов разной формы. При ЖДА может быть выраженныйпойкилоцитоз.
Цветовой показательэритроцитарных клеток (ЦП) зависит от содержания в них гемоглобина. Возможны следующие варианты окрашивания эритроцитов:
• нормохромные эритроциты (ЦП= 0,85-1,15) – нормальное содержание гемоглобина в эритроцитах. Эритроциты в мазке крови имеют равномерную розовую окраску умеренной интенсивности с небольшим просветлением в центре;
• гипохромные эритроциты (ЦП<0,85) – содержание гемоглобина в эритроците снижено. В мазке крови такие эритроциты имеют бледно-розовую окраску с резким просветлением в центре. Для ЖДА гипохромия эритроцитов является характерной и часто сочетается с микроцитозом;
• гиперхромные эритроциты (ЦП>1,15) – содержание гемоглобина в эритроцитах повышено. В мазке крови эти эритроциты имеют более интенсивную окраску, просвет в центре значительно уменьшен либо отсутствует. Гиперхромиясвязана с увеличением толщины эритроцитов и часто сочетается с макроцитозом;
• полихроматофилы – эритроциты, окрашенные в мазке крови в светло-фиолетовый, сиреневый цвет. При специальной суправитальной окраске это – ретикулоциты. В норме могут быть единичными в мазке.
Анизохромия эритроцитов – различная окраска отдельных эритроцитов в мазке крови.
|
|
|
Эритроцитарные индексы
Средний объем эритроцита (meancellvolume – MCV) – количественный показатель объема эритроцитов. В зависимости от значений MCV происходит дифференциация анемий на микроцитарные, нормоцитарные и макроцитарные. Для ЖДА характерным является микроцитарный характер анемии.
Среднее содержание гемоглобина в эритроците (meancellhemoglobin – MCH) – по клиническому значению аналогично цветовому показателю. На основании значений МСН различают нормохромные, гиперхромные и гипохромные анемии. Для железодефицитной анемии характерным является гипохромный характер.
Средняя концентрация гемоглобина в эритроцитах (meancellhemoglobinconcentration, MCHC) – характеризуется степенью насыщения эритроцитов гемоглобином и не зависит от объема эритроцитов. Для ЖДА характерным является снижение показателя МСНС.
|
|
|
23
Аминотрансферазы.Аспартатамино-трансфераза (АсАТ) и аланинаминотранс-фераза(АлАТ) являются ферментами, катализирующими перенос а-аминогруппаспартата и аланина на а-кетогруппы а-ке-тоглутаровой кислоты. АлАТ преимущественно локализована в печени, тогда как АсАТ содержится в большинстве тканей, включая сердце, скелетные мышцы, почки, головной мозг. АсАТрасположена в митохондриях и цитозолегепатоцитов, а АлАТ — главным образом в цитоплазме.
Увеличение активности аминотрансфе-раз является признаком цитолиза печеночных клеток и выхода ферментов в кровоток. При этом диагностическое значение имеет не только само по себе увеличение активности ферментов в сыворотке, но и степень увеличения их активности (табл. 6.6). Чувствительность лабораторных методов обнаружения увеличения активности ами-нотрансфераз в сыворотке возрастает при использовании дополнительного разведения биологического субстрата, подвергаемого анализу.
Умеренное увеличение активности АсАТ и АлАТ в сыворотке часто обнаруживается у пациентов при жировой инфильтрации печени, неалкогольной стеаторее, хронических вирусных гепатитах. Более высокие степени увеличения активности ферментов регистрируются при острых вирусных гепатитах, некрозе печени в результате действия лекарственных препаратов (например, ацетаминофена) или токсинов, ишемии печени вследствиециркуляторно-го шока. При этом степень увеличения активности аминотрансфераз не всегда коррелирует со степенью некроза, выявляемого при биопсии печени, и поэтому полноценного диагностического значения не имеет. Но быстрое снижение активности в динамике заболевания может отражать массивный некроз печени и является плохим прогностическим признаком.
Диагностическое значение имеет не только увеличение активности аминотрансфераз, но и отношение Ac AT : Ал AT. В частности, отношение 2 : 1 чаще встречается у пациентов с алкогольным поражением печени. В то же время увеличение АлАТ свыше 500 ед/л обычно встречается и в отсутствие алкогольного поражения печени, даже при отношении 2:0. Увеличение активности АсАТ без пропорционального роста АлАТ является следствием отличий в восстановлении печеночной АлАТ в связис дефицитом кофактора пиридоксин-5-фос-фата. При вирусном гепатите отношение АсАТ : А л AT обычно 1 : 0, но в динамике может существенно возрастать при формировании фиброза и цирроза печени.
Щелочная фосфатаза.Термином «сывороточная щелочная фосфатаза» обозначают группу ферментов, катализирующих гидролиз фосфат-эфиров при щелочной реакции рН. Эти ферменты встречаются во многих тканях и органах, в частности в печени, костях, кишках, почках, плаценте. При заболеваниях печени увеличение активности плазменной щелочной фосфата-зы обычно отражает поступление фермента в кровоток и является маркером холеста-за. Существенное увеличение активности щелочной фосфатазы чаще всего наблюдается при таких заболеваниях печени и желчевыводящих путей, как внепеченоч-ная обструкция желчевыводящих путей, индуцированный приемом лекарственных средств холестаз, первичный склерозиру-ющий холангит, инфильтративные процессы в печени (амилоидоз, поражение печени при гематологических заболеваниях). Вследствие широкого распространения этого фермента его активность может увеличиваться и при других физиологических и патологических состояниях. Так, у детей с активным ростом костного скелета щелочная фосфатаза в норме может быть увеличена до трех раз.
Гамма-глутамилтранспептидаза.Принято считать, что гамма-глутамилтранспептидаза имеет диагностическую ценность в таких случаях:
- Ее активность может увеличиваться при холестазе. Поэтому определение этого фермента используется для дифференциальной диагностики увеличения активности щелочной фосфатазы и исключения увеличения концентрации щелочной фосфатазы костного происхождения.
- Изолированное увеличение активности фермента может наблюдаться у людей, злоупотребляющих алкоголем, даже при отсутствии грубых изменений печени. Это, возможно, является следствием индукции активности микросомальных ферментов. В таких случаях часто отмечается жировая дистрофия печени. При фиброзе, циррозе и гепатите алкогольной этиологии одновременно с повышением активности гамма-глутамилтранспептидазы в сыворотке возрастает активность и других печеночных ферментов.
Гамма-глутамилтранспептидаза является малоспецифичным маркером заболеваний печени и желчевыводящих путей. Это обусловлено тем, что активность фермента может увеличиваться при достаточно широком спектре заболеваний: при почечной недостаточности, инфаркте миокарда, заболеваниях поджелудочной железы, сахарном диабете. Повышение активности фермента может быть обусловлено также индукцией ферментов печени некоторыми лекарственными препаратами, в частности барбитуратами и фенитоином (ди-лантином).
Альбумин и факторы свертывания крови.Большинство циркулирующих в крови белков, в том числе и альбумин, синтезируется в печени. Концентрация альбумина в плазме зависит от интенсивности его синтеза (в организме взрослого этот показатель составляет 12 г/день), скорости его элиминации из кровотока и объема плазмы. Таким образом, уменьшение скорости синтеза альбумина, возрастание интенсивности его элиминации из крови или увеличение объема плазмы может сопровождаться гипоальбуминемией. Уменьшение концентрации альбумина может отмечаться при нарушении белково-синтетической функции печени, при асците, больших потерях белка у пациентов с заболеванием почек, патологией пищеварительного канала и других состояниях. Вследствие длительного периода полувыведения концентрация альбумина при остром поражении печени может оставаться в нормальных пределах.
В отличие от альбумина факторы свертывания крови относительно быстро элиминируются из организма. Поэтому отклонения в показателях системы свертывания крови являются более ранним биохимическим маркером нарушения белково-синтетической функции печени, чем концентрация альбумина. При этом наименьшим периодом циркуляции в кровотоке (4 — 6 часов) обладает VII фактор свертывания крови (проконвертин). Изменения его концентрации сказываются на величине протромбинового времени (протромбинового индекса). Таким образом, увеличение протромбинового времени (уменьшение протромбинового индекса) может быть ранним признаком нарушения синтеза факторов свертывания крови в печени. В некоторых случаях до или одновременно с уменьшением активности VII фактора снижается концентрация IX фактора свертывания крови (фактор Кристмаса). Его дефицит приводит к удлинению активированного частичного тромбопластинового времени (АЧТВ). Этим объясняется необходимость оценки у пациентов с заболеваниями печени наряду с протромбиновым временем и других показателей системы свертывания крови.
Сывороточный билирубин. Изменения биохимических показателей при желтухах.Билирубин является эндогенным органическим анионом (см. выше). Образуется преимущественно в результате катаболизма гема эритроцитов, в меньшей степени — вследствие разрушения миоглобина, цитохромов, каталазы, пероксидазы. При образовании связывается с альбумином и транспортируется к печени, где происходит процесс связывания его с глюкуроновой кислотой и экскреция в желчь. У практически здоровых людей концентрация общего билирубина составляет менее 17 мкмоль/л, неконъюгированного (непрямого) — 12 мкмоль/л, конъюгиро-ванного (прямого) — 5 мкмоль/л. Патологией является не только увеличение общего билирубина, но и увеличение концентрации конъюгированного билирубина, даже при условии нормальной концентрации общего билирубина. Гипербилирубинемия может быть обусловлена следующими механизмами:
- Повышенная нагрузка билирубина на гепатоциты.
- Нарушение захвата и переноса билирубина в гепатоцит.
- Нарушение процессов конъюгации билирубина в гепатоците.
4. Нарушение экскреции его в желчь. Гипербилирубинемию с окрашиванием тканей и органов в желтый цвет называют желтухой. В зависимости от клинико-патофизиологической характеристики выделяют три типа желтухи:
- Надпеченочная.
- Печеночно-клегочная.
- Под печеночная (холестатическая).
Первый тип вызывается повышенным образованием билирубина при гемолизе и некоторых наследственных нарушениях обмена билирубина. При этом билирубин в основном представлен неконъюгирован-ной фракцией. В моче билирубин не выявляется. Активность сывороточных транс-аминаз и щелочной фосфатазы в пределах нормы.
Печеночно-клеточная желтуха возникает вследствие нарушения функции гепатоцита. При этом увеличивается концентрация не только неконъюгированного, но и конъюгированного билирубина. В зависимости от механизма развития желтухи выявляются другие патохимические и клинические признаки печеночно-клеточной недостаточности (увеличение активности трансаминаз, нарушение белково-синтети-ческой функции печени и др.).
Холестатическая желтуха развивается при нарушении поступления желчи в кишки. При этом в сыворотке повышается концентрация конъюгированного билирубина, активность печеночной фракции щелочной фосфатазы, гамма-глутамил-транспептидазы, уровень общего холестерина и конъюгированных желчных кислот. Вследствие стеатореи уменьшается масса тела и нарушается всасывание витаминов A, D, Е, К, а также кальция, что приводит к соответствующимклиническим и пато-химическим нарушениям. Типичные клинические и лабораторные проявления различных типов желтух представлены в табл. 6.7.
Антинуклеарные антитела.Для хронического гепатита характерным является вовлечение иммунных факторов в непрерывное повреждение печеночных клеток. При этом иммунная реакция направлена против компонентов мембраны гепатоци-та, выступающих в качестве антигенов. Антинуклеарные антитела обнаруживаются у 75 % пациентов с хроническим активным гепатитом, а антимитохондриальные антитела — практически во всех случаях первичного билиарного цирроза.
22 Печень называют центральной метаболической лабораторией, поскольку она одинаково эффективно превращает вещества, поступающие из кишечника, и продукты метаболизма, образующиеся в различных органах и тканях в результате их жизнедеятельности. В настоящее время известно более 500 метаболических функций. Кратко рассмотрим основные из них.
1. Синтетическая. Печень осуществляет синтез белков, ферментов, факторов свертывания крови, холестерина, фосфолипидов и др. В печени происходит основное образование кетоновых тел.
2. Детоксицирующая для эндогенных (аммиак, билирубин и др.).и экзогенных (лекарства и др.) веществ.
3. Секреторная - секреция желчи.
4. Экскреторная - выделение с желчью различных, в том числе твердых, веществ.
Печень принимает участие во всех видах обмена.
1.Белковый обмен. Печень осуществляет синтез следующих белков:
альбумины 100%, Фибриноген
a1-глобулины 90%, факторы свертывания крови
a2-глобулины 75%, (в т.ч. витамин К-зависимые)
b-глобулины 50%, псевдохолинэстераза (ХЭ)
g-глобулины - немного.
Печень поддерживает уровень аминокислот, в т.ч. циклических (тирозин, триптофан, фенилаланин,), нейтрализует аммиак, превращая его в мочевину. Синтез мочевины - одна из самых стабильных функций печени.
2.Липидный обмен. Синтез холестерина на 90% осуществляется печенью и кишечником. Значительная часть холестерина в печени превращается в желчные кислоты, стероидные гормоны, витамин D2. Печень преобразует токсичные для мозга жирные кислоты с короткой цепью (4-8 атомов углерода - капроновая, изовалериановая и др.) в жирные кислоты с длинной цепью (16-18 атомов углерода).
3.Углеводный обмен. Печень осуществляет поддержание стабильного уровня гликемии путем гликогенеза, гликогенолиза, глюконеогенеза. Печень вырабатывает инсулиназы - ферменты, расщепляющие инсулин, поддерживает уровень молочной и пировиноградной кислот.
4. Пигментный обмен включает превращение в гепатоците путем конъюгации с глюкуроновой кислотой токсичного жирорастворимого непрямого билирубина в нетоксичный водорастворимый прямой. Выделение билирубинглюкуронида может происходить либо путем прямой секреции в желчный капилляр, либо включением в желчную мицеллу.
5. Обмен порфиринов включает синтез гема, состоящего из комплекса протопорфирина с железом.Гемнеобходим для синтеза гем-содержащих ферментов печени (цитохромы и др.). Врожденное нарушение синтеза гема в печени приводит к заболеваниям - печеночным порфириям.
6. Обмен гормонов.При заболеваниях печени наблюдается повышение уровня гормонов, связанное с нарушением их секреции с желчью или искажением нормального обмена гормона (недостаточного разрушения). Повышается уровень адреналина и норадреналина (медиаторов симпатической нервной системы), минералокортикоида альдостерона, половых гормонов, особенно эстрогенов, тканевых гормонов серотонина и гистамина.
7. Обмен микроэлементов. Печень синтезирует белки для транспорта (трансферрин) и депонирования (ферритин) железа, она также является основным депо железа. Печень играет важную роль в обмене меди: она синтезирует церулоплазмин - гликопротеид, связывающий до 90% меди крови, а также поглощает из плазмы крови медь, непрочно связанную с альбумином, и экскретирует избыток меди при помощи лизосом с желчью в кишечник. Печень принимает участие и в обмене других микроэлементов и электролитов.
24 Биохимические изменения крови при инфаркте миокарда.
Признаки ишемии миокарда по биохимическим критериям нарастают постепенно (сутки) и усиливаются в период реперфузии миокарда.
Наибольшее диагностическое значение имеет определение ферментов: КФК, АсТ, ЛДГ. Выбор исследования зависит от того, сколько времени прошло с момента инфаркта. В течение 4-х часов после инфаркта содержание этих ферментов может быть в пределах нормы.
Повышение активности ферментов в крови носит волнообразный характер:
1 волна - ишемия, 2 -волна - реперфузия.
___________________________________________________________________
Фермент начало длительность повышения
КФК 4-8 ч 3 -5 дней
АсТ 6-8 ч 4 -6 дней
ЛДГ-1,2 12-24 ч 7 - 12 дней
Другой информационный метод диагностики - определение концентрации миоглобина в сыворотки крови, который выходит из мышечных клеток при их повреждении. Его содержание увеличивается на 2-3 часа раньше, чем КФК. В норме миоглобин 12 -52 нг/мл. При инфаркте его содержание увеличивается до 1120 нг/мл.
Сердечная мышца- миокард - занимает промежуточное положение в сравнении со скелетными и гладкими мышцами. Она относится к поперечно-полосатым мышцам, но сокращается непроизвольно, не имея периодов отдыха и перекачивая за сутки в среднем 7200 л крови за 100 000 сокращений. В сравнении со скелетными мышцами миокарда содержит больше миоглобина, фосфоглицеринов, белков стромы, миоальбумина, митохондрий; в миокарде интенсивнее протекает ресинтез АТФ, очень высока активность ферментов тканевого дыхания. Однако содержание АТФ, креатинфосфата, белков миофибрилл выше в скелетных мышцах в сравнении с миокардом. В сравнении с гладкими мышцами миокард содержит больше АТФ, креатинфосфата, белков миофибрилл, миоглобина, фосфоглицеринов. Энергию для сократительной деятельности миокард получает путем окисления 1)ВЖК (18 г в сутки), особенно активно-олеиновой кислоты; 2)глюкозы (11 г в сутки ); 3)лактата (10 г в сутки ); 4)ПВК ( 0,6 г в сутки ); 5) кетоновых тел.
В миокарде преобладает аэробный метаболизм. В постабсорбтивной фазе пищеварения АТФ в миокарде образуется приемущественно за счет ВЖК, в абсорбтивной фазе- за счет глюкозы; при физической нагрузке- за счет лактата. Образование аммиака в миокарде происходит пуриновым циклом, но некоторое количество аммиака используется для предотвращения закисления среды лактатом( поддержание КОС, предотвращение метаболического ацидоза). Обмен сократительных белков в миокарде происходит интенсивнее, чем в скелетных мышцах. В миокарде полная замена их происходит за 1 месяц, а в скелетных мышцах - за 5 месяцев.
Важнейшие ферментные системы миокарда:
1) Креаинфосфориназа-2 (КФК 2);
2) Аспартатаминотрансфераза( Ас-АТ).
3) Лактатдегидрогеназа-1(ЛДГ 1).
Особенности метаболизма в миокарде -аэробный характер гликолиза; чувствителен к недостатку О2; большой расход АТФ; различия в потребляемых субстратах для АТФ.
Особенности обмена липидов в миокарде. Липиды- в миокарде (12-16%); До 70% О2 крови в миокарде расходуется на окисление ВЖК(особенно олеиновой кислоты).
Особенности обмена углеводов.
· Аэробный гликолиз в норме очень интенсивен;
· В абсорбтивной стадии (после приема пищи) энергия образуется за счет глюкозы, а затем используется;
· Запасы гликогена меньше, чем в скелетной мышце; обмен гликогена в миокарде более интенсивен, чем в скелетной мышце;
· Активно протекает пентозофосфатный путь превращения глюкозы;
· Активно протекает ЦТК;
· 30% кислорода идет на окисление углеводов в миокарде;
Особенности обмена белков. Образование аммиака идет пуриновым циклом; Интенсивно идет переаминированиеоксалоацетата с различными аминокислотами, поэтому высока в клетках активность АсАТ (аспартатаминотрансферазы). Активность АсАТ в сердечной мышце почти в 10.000 раз выше, чем в сыворотке. Повышение активности АсАТ в сыворотке крови отмечено при целом ряде заболиванийи особенно при поражении сердечной мышцы (инфаркт миокарда), когда идет разрушении клеток миокарда с выходом АсАТ в кровь.
Дата добавления: 2018-05-12; просмотров: 646; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
