Специфіка методів дослідження ферментів
Введення в біохімію. Біохімічні компоненти клітин.
Біохімія - наука про хімічний склад, властивості, обмін речовин і енергії в живих організмах, а коротше кажучи наука про хімію життя.
Вивчення проблем, що складають сучасну біохімію почалось в кінці ХVIII століття, а як самостійна наука біохімія виділилась в кінці XIX століття. Але біохімічними процесами людство користувалось з глибокої давнини.
Основні розділи біохімії
· статична біохімія
· динамічна біохімія
· функціональна біохімія.
Статична біохімія вивчає хімічний склад живих організмів та структуру біоорганічних молекул - біомолекул, що входять до їх складу: білків, амінокислот, нуклеїнових кислот, нуклеотидів, вуглеводів та їх похідних, ліпідів, вітамінів, гормонів тощо.
Динамічна біохімія вивчає хімічні (біохімічні) реакції, що складають у своїй сукупності обмін речовин, або метаболізм живих організмів.
Функціональна біохімія - розділ біохімії, що вивчає біохімічні реакції, які лежать в основі певних фізіологічних функцій. Функціональна біохімія близька за своєю сутністю до молекулярної фізіології.
Клінічна біохімія – це прикладний розділ біохімії, який вивчає біохімічні процеси в організмі людини для оцінки стану здоров’я і з’ясування механізму розвитку хвороби і є окремим розділом клінічної лабораторної діагностики.
Найпоширенішими об'єктами біохімічних досліджень є кров і сеча, зрідка аналізуються інші рідини і екскрети, а також тканини.
|
|
|
Сучасна клінічна біохімія спрямована до комплексної, багатосторонньої і динамічної оцінки патологічного процесу на системному рівні. Це досягається завдяки визначенню багатьох показників, які характеризують обмін білків, вуглеводів, ліпідів, активність ферментів, гормонів, медіаторів та інших біологічно активних речовин.
Серед великої кількості сучасних методів клінічної лабораторної діагностики розрізняють наступні групи методик: хіміко-мікроскопічні методи дослідження біологічних матеріалів (сечі, калу, мокроти та ін.); методи гематологічних досліджень; методи дослідження системи гемостазу, методи клінічної мікробіології; методи клінічної імунології та методи клінічної біохімії.
Основні групи біохімічних показників, які визначаються в клініці, такі:
- вміст макромолекул, мономерів і деяких продуктів їхнього обміну;
- активність ферментів та ізоферментів;
- вміст вітамінів, коферментів та продуктів їхнього обміну;
- вміст води і мінеральних речовин;
- вміст позаклітинних регуляторів метаболізму - гормонів, гістогормонів, медіаторів та продуктів їхнього обміну.
Кожне захворювання або патологічний стан організму характеризуються сукупністю біохімічних порушень які відображають різні функції органів і систем організму. Наприклад, при діагностиці цукрового діабету спочатку визначається вміст глюкози, кетонових тіл у крові та сечі, а кінцевий діагноз встановлюється за концентрацією інсуліну в крові.
|
|
|
Ферменти та коферменти. Регуляція метаболізму
Ферменти є природними біологічними каталізаторами, і тому мають подібні властивості з неорганічними каталізаторами.
Суть ферментативної реакції характеризується слідуючими рівняннями.



 Е + S ЕS Е + Р
Е + S ЕS Е + Р
Е - фермент, S - субстрат, Р - продукти реакції. ЕS - фермент субстратний комплекс.
Ферментативна реакція може йти як у прямому так і в зворотньому напрямку.
Активність ферментів може змінюватися в залежності від статі, віку, фізіологічного стану організму.
Про білкову природу ферментів свідчать факти інактивації - втрати каталітичної активності ферментів при дії різноманітних фізичних і хімічних факторів. Зокрема, при кип'ятінні ферменти інактивуються внаслідок незворотної денатурації білка - фермента. Фермент втрачає при цьому свої каталітичні властивості. Так само денатурація білків - ферментів відбувається при дії мінеральних кислот, солей, важких металів, при дії рентгенівського та ультрафіолетового опромінення.
|
|
|
Ферменти при кислотному гідролізі, як і білки, розщеплюються на амінокислоти.
Ферменти мають ряд властивостей, характерних для високомолекулярних сполук пептидної (білкової) природи: амфотерність, електрофоретичну рухливість завдяки наявності позитивно та негативно заряджених груп на поверхні, здатність до висолювання та ренатурації, (зворотньої денатурації) під дією розбавлених розчинів солей, додавання при низьких температурах етанолу, ацетону. Активність ферментів при ренатурації не втрачається.
Відмінність у хімічному складі ферментів послужила основою для поділу їх на прості та складні.
Прості ферменти складаються тільки з амінокислот. Це в основному гідролітичні ферменти (пепсин, амілаза, ліпаза) ШКТ.
Складні ферменти мають небілкову частину кофермент і білкову - апофермент.
Коферменти можуть бути представленні мінеральними речовинами, їх називають металоферментами, активними формами вітамінів і нуклеозидтрифосфатами.
|
|
|
Активний ( каталітичний ) центр ферменту - це ділянка молекули ферментативного білка, що взаємодіє з субстратом під час ферментативної реакції і є необхідною для перетворення субстрату в каталітичному процесі . Активний центр формується певними ділянками поліпептидного ланцюга, що просторово зближені за рахунок унікальної тривимірної конформації ферментного білка.
Алостеричний (просторово інший, відмінний) центр являє собою ділянку молекули фермента, з якою звязуються певні, звичайно низькомолекулярні сполуки, які називаються ефекторами або модифікаторами.
Ферменти являються термолабільними сполуками. З підвищенням температури на кожні 10°С швидкість реакції підвищується в два рази. Це проходить до температурного оптимуму. Так називають інтервал температур в якому ферменти проявляють найбільшу активність. Для більшості ферментів це 35-45°С. В організмі людини оптимальна температура для дії ферментів 37°С. Підвищення температури приводить до зниження активності ферменту і швидкості реакції, а при 70-80°С фермент перестає діяти. Це зв'язано з тим, що ферменти мають білкову природу і при підвищенні температури змінюється структура активного центру настільки, що він перестає взаємодіяти з субстратом, тобто відбувається денатурація. При високій температурі структура білка руйнується і руйнується активний центр ферменту. Зниження температури викликає і зниження швидкості ферментативної реакції, але при цьому фермент зберігає свою структуру і властивості. Якщо температуру підняти до оптимуму, активність ферменту і швидкість реакції відновлюється.
Кожний фермент проявляє свою активність тільки при оптимальному рН викликає зниження активності ферменту і зниження швидкості реакції, а при значній зміні реакції середовища фермент інактивується. Це зв'язано з тим, що в утворенні ферменту – субстратного комплексу приймають участь електростатичні зв’язки, які утворюються між протилежно зарядженими функціональними групами субстрата і активного центра ферменту. Такий заряд створюється тільки специфічною рН.
Ступінь специфічності у ферментів різна і поділяється на абсолютну і відносну специфічність.
Відносну специфічність мають ферменти, кожен з яких діє на декілька речовин, що мають один тип зв'язку. Наприклад, протеїнази розщеплюють пептидний зв'язок - NH – СО.
Ферменти, що каталізують перетворення тільки одного субстрату мають абсолютну специфічність. Прикладом цього може бути амілаза, що гідролізує крохмаль до глюкози, сахараза, що розщеплює сахарозу на глюкозу і фруктозу.
Ферменти локалізуються в органоїдах клітини, де проявляється їх діяльність. Виключення складають ферменти ШКТ, які виділяються у просвіт ШКТ в момент травлення і ферменти системи зсідання крові, що функціонують в кровоносних судинах.
КЛАСИФІКАЦІЯ ФЕРМЕНТІВ
| КЛАС | ПІДКЛАС | КОФЕРМЕНТИ | ТИП РЕАКЦІЇ |
| Оксидоредук-тази | 1.Дегідрогена-зи 2.Оксигенази 3.Цитохроми | НАД,НАДФ,ФАД, ФМН O2 Гемінові(містять іони металів) | Окисно-відновні Перенос електронів |
| Трансферази | 1.Аміно— 2.Метило— 3.Ацил— 4.Фосфо— | Піридоксин, Ліпоє-ва к-та, КО-А, ТДФ | Перенос функціональних груп |
| Гідролази | 1.Естерази 2.Пептидази 3.Глікозидази 4.Протеази | За участю молекули води розщеплення зв”язків | Гідроліз |
| Ліази | 1.Декарбоксилази 2.Альдолази 3.Дегідротази | СО2 , С-С зв”язки (Їх розщеплення), відщеплення води і утворення подвійного зв’язка | Розщеплення ковалентних зв’язків |
| Лігази | ----------------------- | За участю енергії АТФ | Синтез нових сполук |
Визначення активності ферментів, дослідження механізму їх дії та кінетики ферментативного каталізу.
Специфіка методів дослідження ферментів
Зумовлена перш за все низькою концентрацією ферментів в тканинах. Звичайними методами кількісного аналізу, доступними в лабораторній діагностиці, цю концентрацію визначити неможливо. Тому про концентрацію ферменту судять пропорційно кількості перетвореного субстрату, або по кількості продукту реакції. Тому в біоматеріалі визначається їх активність. Як приклад визначення можна розглянути визначення активності α-амілази. Про активність α-амілази судять по кількості розщепленого крохмалю, що є субстратом для даного ферменту. Ступінь розщеплення крохмалю визначається йодометрично по зниженню зафарбованості розчину.
Одиниці активності ферменту
Активність ферменту визначають за кількістю розщепленого ним субстрату в перерахунку на 1л сироватки крові за одиницю часу. За міжнародну одиницю прийнята така кількість ферменту, яка в оптимальних умовах каталізує перетворення 1 мкмоль субстрату за 1 хвилину (U= мкмоль/хв). В перерахунку на 1л біологічного матеріалу цю величину можна передавати наступним чином:
Е/л = мкмоль/л • хв.
В міжнародній системі одиниць СИ за одиницю активності ферменту прийнято КАТАЛ, що відповідає кількості ферменту, який перетворює 1 моль субстрату за 1 секунду ( кат=моль/сек). В перерахунку на 1л біоматеріалу: катал=моль/сек • л.
Швидкість ферментативної реакції буде прямо пропорційно залежати від концентрації ферменту, а саме:


Залежність швидкості ферментативної реакції від концентрації субстрату буде у вигляді гіперболи: при низьких концентраціях субстрату швидкість реакції прямо пропорційна його концентрації (реакція першого порядку), а при високих концентраціях досягається ефект насичення, тобто незалежність V від [S].
Рівняння залежності V від [S], або рівняння Міхаеліса - Ментен:

Обробка рівняння Міхаеліса - Ментен за методом подвійних зворотних величин дає змогу представити залежність V від [S] прямою лінією - рівняння Лайнуівера - Берка:
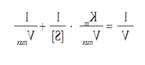
Механізмами дії ферментів
1) Ефект зближення та орієнтації – найбільш поширений механізм. Пояснення процесу: правильна взаємодія молекули субстрату з контактною ділянкою активного центру дозволяє найкращим чином зорієнтувати S відносно каталітичної ділянки та зблизити з функціональними групами, які необхідні для його перетворення у продукт.
2) Ефект деформації субстрату (так звана «теорія диби»). Пояснення процесу: після зв’язування S з активним центром відбувається розтягнення зв’язків (напруження та деформа-ція) в молекулі субстрату. Такі зв’язки або ділянки в молеку-лі субстрату легше атакуються, наприклад, молекулами води та розщеплюються.
3) Ефект кислотно-лужного каталізу. Пояснення процесу: в активному центрі ферменту є амінокислотні залишки, які відіграють роль акцептора або донора протонів і, таким чином, беруть участь у перетворенні S. Найбільш активними є функціональні групи амінокислотних залишків Цис, Глу, Асп, Гіс, Тир та ін.
4) Ефект ковалентного каталізу. Пояснення процесу: у активному центрі деяких ферментів між молекулою субстрату та функціональними групами активного центру утворюються нестійкі ковалентні зв’язки, після руйнації яких утворюється новий продукт або продукти. Формування ковалентних зв’язків відбувається завдяки атаці нуклео-фільних (негативно заряджених) або електрофільних (позитивно заряджених) функціональних груп активного центру ферменту молекулами субстрату.
Етапи ферментативного каталізу з урахуванням молекулярних механізмів дії:
I – етап зближення та орієнтації субстрату в активному центрі ферменту; II – утворення фермент-субстратного комплексу з деформацією зв’язків у молекулі субстрату; III – утворення нестабільного комплексу фермент-продукт (EP); IV – вивільнення продуктів реакції з активного центру ферменту

Дата добавления: 2018-05-12; просмотров: 1193; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
