Опыт 2. Свойства винной кислоты как комплексообразователя.
Не посвящается никому. Ибо нефиг.
Лабораторные работы по биоорганической химии.
Химия в РНИМУ (да и в целом тоже) — одна из самых абстрактных наук. Если анатомы и биологи могут показать предметы своих исследований в натуральную величину, гистологи, немного напрягшись, тоже в состоянии это сделать, то в этом моменте химикам нечем крыть. Действительно, нам говорят — молекулы, а мы вынуждены, в сущности, просто поверить в это. Нам говорят — НАД+окисляет спирт в альдегид — кто проверит, что этот НАД существует вообще? Мы считаем, что критическое мышление является краеугольным камнем познания. Способность подвергнуть сомнению, задать вопрос — необходимая для исследователя, да и просто вменяемого человека способность.
Неплохой возможностью доказать свои весьма неоднозначные гипотезы для химиков является эксперимент. Увы, реальность внесла свои коррективы. Исторически сложилось, что лабораторные работы по биоорганической химии проходят в скомкано, хаотично, да и вообще, ничего невозможно понять. Как правило, самому умному студенту группы достаются реактивы, он(а) пытается изобразить Менделеева и Бутлерова в одном лице, смешивая реактивы. Что-то получается, что-то нет. Тем временем его собратья по разуму частично (меньшинство) пытаются наблюдать и вникать в то, что делает их коллега (как правило, безуспешно). Интеллектуальное большинство же занято своими делами — обсуждением анатомии, гистологии, личных проблем и иного. Затем все списывают друг у друга выводы (они передаются с небольшими ошибками из поколения в поколение). С горем пополам все защищаются и расходятся.Движимые гуманизмом, человеколюбием, и чувством юмора — критично и иронично разберем, что там происходит в доступной, но научной форме. Поскольку на дворе XXIвек (сюрприз), по мере возможности сопроводим опыты видео так, чтобы лабораторные могли быть как будто бы сделаны не выходя из дома. Как обычно, текст создан из гуманных соображений и распространяется безвозмездно.
16.03.2018.
Алексей «Лёша-химик» Фёдоров
Опыт 1. Доказательство наличия двух карбоксильных групп в винной кислоте.
Что надо написать, чтобы сдать эту хуиту, примерный вариант (не списывай точь-в-точь, чтобы не спалиться!):
Цель: доказательство наличия двух карбоксильных групп в молекуле винной кислоты.
Ход эксперимента, часть 1: в пробирку помещают 1-2 капли 15% раствора винной кислоты и 1-2 капли 5% раствора гидроксида калия. Содержимое пробирки перемешивают.
Уравнение реакции:

Гидротартрат калия
Наблюдения: постепенно образуется белый кристаллический осадок малорастворимой в воде кислой соли винной кислоты и калия — гидротартрата калия. Если осадок не выпадет, охладить пробирку под струёй холодной воды и потереть стеклянной палочкой о внутреннюю стенку пробирки.
Вывод: кислая соль винной кислоты, гидротартрат калия, малорастворима в воде.
Ход эксперимента, часть 2: к осадку, полученному в первом эксперименте, приливают несколько капель 10% раствора гидроксида натрия. Содержимое пробирки перемешивают.
Уравнение реакции:
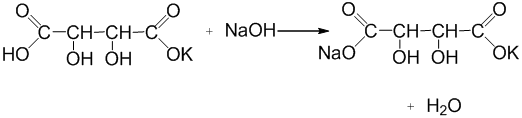
Гидротартрат натрия-калия
Наблюдения:белый осадок растворяется, образуется прозрачный раствор.
Вывод: Винная кислота содержит в составе молекулы две карбоксильные группы. Продукт замещения водорода по одной группе, кислая соль винной кислоты, является малорастворимым веществом, тогда как продукт замещения по обеим группам, средняя соль, растворима хорошо.
Комментарий:чтобы обсуждать корректность выводов, сначала спросим, признаём ли мы, что нам известна формула винной кислоты? Если она нам известна, то задача доказать наличие в ней двух карбоксильных групп выглядит забавно. Это и так видно. Если формула неизвестно, то нам, как детям ЕГЭ, сначала стоило бы убедиться, что карбоксильные группы там вообще есть, в ЕГЭ для этого использовали NaHCO3. Более-менее однозначно показать наличие двух карбоксильных групп можно было бы, если бы было показано, что винная кислота реагирует с щелочами в соотношении 1:2 по молям. Мало ли, какая хрень может сначала выпадать в осадок, а потом этот осадок растворялся бы. В том же ЕГЭ, помнится, так делали соединения алюминия — в них что, тоже две карбоксильные группы? Цель опыта достигнута хуй пойми как.
Опыт 2. Свойства винной кислоты как комплексообразователя.
Что надо написать, чтобы сдать эту хуиту, примерный вариант:
Цель: показать возможность образования хелатных комплексов с винной кислотой, оценить стойкость комплексов.
Ход эксперимента:в две пробирки налить по две-три капли 2% сульфата меди и 10% гидроксида натрия. В первую пробирку добавить тартрат натрия-калия, содержимое перемешать. Вторую пробирку оставляют для контроля. Наблюдают изменения в пробирках, после чего обе пробирки нагревают и еще раз фиксируют изменения в пробирках.
Уравнения реакций:
1) При сливании растворов сульфата меди и гидроксида натрия в обеих пробирках

2) При добавлении тартрата натрия-калия к осадку гидроксида меди в первой пробирке

3) При нагревании
во второй пробирке:

в первой пробирке:

Наблюдения: При смешивании растворов сульфата меди и гидроксида натрия в обеих пробирках образовался голубой осадок (внезапно). При добавлении тартрата в первую пробирку осадок растворился, образовался голубой прозрачный раствор. При нагревании обеих пробирок в первой изменений не наблюдается, во второй происходит образование черного нерастворимого вещества.
Выводы: вещества, содержащие 1,2-диольный (вицинальныедиолы) фрагмент, способны образовывать хелатные комплексы. В винной кислоте есть две гидроксильные группы у соседних атомов углерода, поэтому она способна образовывать хелатный комплекс с ионом двухвалентной меди. Хелатные комплексы весьма прочны и выдерживают нагревание раствора без разложения. При нагревании гидроксида меди он разлагается с образованием чёрного оксида и воды, тогда как в пробирке с раствором хелатного комплекса изменений не наблюдается.
Комментарий:Будем исходить из того, что курс ЕГЭ мы помним. Тогда вывод об образовании комплекса винная кислота-медь выглядит логично. Осадок гидроксида меди растворился, оксид меди не хочет выпадать при нагревании. Значит, медь куда-то делась, наиболее логично предположить, что она связалась с винной кислотой. В данном случае вывод выглядит логично. Однако весьма странно говорить о структуре хелатного комплекса как о чем-то известном. Осторожно! Дальше читать опасно. Обладающий хорошим воображением студент может предположить несколько возможных структур:


Официальный вариант Неофициальный, но возможный вариант


Маловероятный вариант Маловероятный вариант
Ирония в том, что точная структура комплекса не установлена, а доказать возможность или невозможность хотя бы одного из вариантов довольно сложно, хотя и возможно. А официальная пропаганда втирает нам, что верен только первый комплекс. Как всегда, власти скрывают! Рассуждение о установлении структур комплексов далеко за рамками нашей компетенции, можем рекомендовать обратиться к компетентным товарищам.
Опыт 3. Образование внутрикомплексных солей α-аминокислот.
Что надо написать, чтобы сдать эту хуиту, примерный вариант:
Цель: показать возможность образования хелатных комплексов альфа-аминокислот.
Ход эксперимента:в пробирку насыпать несколько лопаток карбоната меди, добавить несколько капель 1% раствора и глицина и подогреть. Полученный раствор осторожно слить с осадка и добавить по каплям раствор гидроксида натрия.
Уравнение реакции:

Наблюдения: Получили голубой прозрачный раствор.
Выводы:α-аминокислоты способны к образованию хелатных комплексных соединений. Хелатные комплексы весьма прочны, ионов меди в растворе практически нет, поэтому при добавлении гидроксида натрия осадок гидроксида меди не образовался.
Комментарий:Тут особо и не поиронизируешь: из карбоната выделялись пузырьки газа, значит он реагировал с кислотой. Это — классика школьной химии. Медь куда-то делась, и не хочет реагировать даже со щелочью, хотя обычно выпадает гидроксид меди. Единственный вывод, который пожалуй можно сделать — таки да, хелатный комплекс. Не удержимся и отпустим ироничное замечание: карбонат меди не существует, а существует гидроксокарбонат меди.
Опыт 4. Дезаминированиеα-аминокислот.
Что надо написать, чтобы сдать эту хуиту, примерный вариант:
Цель: провести реакцию дезаминирования глицина.
Ход эксперимента: В пробирке смешивают 0,5 мл. 1% раствора глицина, 0,5 мл. 5% раствора нитрита натрия и несколько капель концентрированного раствора соляной кислоты. Содержимое пробирки перемешивают.
Уравнение реакции:

Наблюдения: выделяются пузырьки газа.
Выводы: аминокислоты содержат аминогруппу (нихуя внезапно), способную вступать в реакции дезаминирования с образованием газообразного азота.
Комментарий:Тут тоже много не пошутишь. Реакция аминов с азотистой кислотой входит в ЕГЭ, была в первом семестре, хотя наверняка большинству так и осталась неизвестна. Из увиденного следует, что аминокислоты обладают свойствами аминов.
Дата добавления: 2018-04-15; просмотров: 16764; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
