Потенциометрические определения
Вопросы для самостоятельного изучения
Часть 2-я 2-го семестра
1. Электропроводность растворов электролитов. Числа переноса. Удельная и эквивалентная электропроводности, их зависимость от концентрации электролита. Предельная эквивалентная электропроводность и методы ее определения. Определение степени диссоциации и скорости движения ионов по измерениям электропроводности.
Электропроводность растворов электролитов
Движение ионов в электрическом поле
Проводники электрического тока разделяются на 2 основные группы:
1. Проводники 1 рода – это проводники, в которых носителями свободного заряда являются свободные электроны и в которых прохождение тока не сопровождается переносом вещества.
2. Проводники 2 рода – это проводники, в которых носителями свободного заряда являются ионы и в которых протекание тока сопровождается переносом вещества.
В особую группу входят полупроводники, обладающие электронно-дырочной проводимостью.
Растворы электролитов относят к проводникам 2 рода. Сила тока в них зависит от концентрации ионов и от скорости движения ионов.
Если в переносе заряда участвуют ионы разных видов, то для оценки «вклада» каждого иона вводят числа переноса.
 ,
,
где qi – заряд, перенесенный данным видом ионов;
q – заряд, перенесенный всеми ионами.
Можно показать, что для бинарного электролита

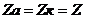
 ;
;  ;
;  ,
,
|
|
|
где Ui – абсолютная скорость движения ионов данного вида, т.е. скорость движения при градиенте потенциала (напряженности) электрического поля [1 В/м].
Удельная электропроводность
Согласно закону Ома для участка цепи  .
.
Зависимость сопротивления проводника от его материала  .
.
Для растворов электролитов вместо сопротивления часто пользуются электропроводностью.
Электропроводностью проводника называется величина, обратная сопротивлению.
 ;
;  .
.
Удельной электропроводностью называется величина, обратная удельному сопротивлению.
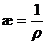 ;
;  .
.
Физический смысл удельной электропроводимости: удельная электропроводимость численно равна электропроводимости раствора электролита, помещенного между электродами площадью 1м2, находящимися на расстоянии 1м.

Удельная электропроводность электролитов зависит от концентрации ионов в растворе и от скорости их движения
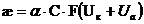
График зависимости удельной электропроводимости от концентрации:

С увеличением концентрации электролита в растворе удельная электропроводность сначала увеличивается, т.к. увеличивается концентрация ионов. При больших концентрациях удельная электропроводность уменьшается. Для слабых электролитов это объясняется уменьшением степени диссоциации. Уменьшение степени диссоциации объясняется тем, что с повышением концентрации ионов возрастает вероятность (скорость) обратной реакции - рекомбинации ионов в молекулу. Для сильных электролитов уменьшение удельной электропроводности объясняется уменьшением скорости движения ионов вследствие их взаимного торможения.
|
|
|
Эквивалентная электропроводность
(современное название: молярная)
 ;
; 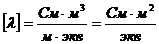 .
.
Часто употребляется другая формула:  ;
;  ;
; 
1000 см3 =1 л

Физический смысл эквивалентной электропроводности: эквивалентная электропроводность численно равна электропроводности раствора, помещенного между электродами, находящимися на расстоянии 1м, и содержащего 1экв. электролита.
Эквивалентная электропроводность отнесена к определенному числу молекул, введенных в раствор (NA/Z).
Эквивалентная электропроводность электролитов зависит от концентрации ионов в растворе и от скорости их движения
 .
.
График эквивалентной электропроводности:

Эквивалентная электропроводность с увеличением концентрации уменьшается. Для слабого электролита это объясняется уменьшением степени диссоциации. Для сильного электролита – уменьшением скорости движения ионов.
|
|
|
Математическая зависимость эквивалентной электропроводности от концентрации экспериментально получена Кольраушем и теоретически обоснована Онзагером.

(в справочнике см. уточненную формулу),
где λ0 – предельная эквивалентная электропроводность; λ→λ0 при С→0;
а – постоянная, независящая от концентрации.
График этой зависимости представляет собой прямую линию для сильных электролитов.
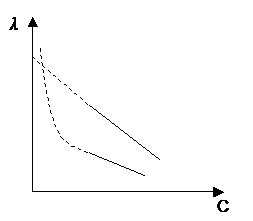
Предельная эквивалентная электропроводность обладает свойством аддитивности:
 ,
,
здесь λ0,а, λ0,к – это предельные ионные электропроводности (подвижности).
 ;
;  .
.
Предельную эквивалентную электропроводимость можно рассчитать двумя способами:
1. Графически.
2. Аналитически.
Измерив эквивалентную электропроводность электролита, можно рассчитать степень диссоциации слабого электролита или скорость движения ионов сильного электролита.
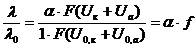 ,
,
где  - коэффициент электропроводности, зависит от скорости движения электронов.
- коэффициент электропроводности, зависит от скорости движения электронов.
Для слабого электролита  .
.
Для сильного электролита  .
.
|
|
|
2. Компенсационный метод измерения ЭДС. Хингидронный электрод.
ЭДС гальванического элемента равна разности равновесных электродных потенциалов. Электродные потенциалы являются равновесными, если сила тока в них бесконечно мала. Поэтому для измерения ЭДС применяют компенсационный метод (метод Поггендорфа).

Метод заключается в том, что ЭДС исследуемого элемента компенсируется напряжением, взятым от батареи, ЭДС которой известна. ЭДС батареи перед измерением проверяется по нормальному элементу, ЭДС которого известна с высокой точностью и сохраняет свое значение очень долго.
Измерение ЭДС заключается в следующем: перемещением рукоятки потенциометра изменяют его сопротивление и, соответственно , напряжение , подаваемое на исследуемый элемент. Добиваются такого положения рукоятки потенциометра, при котором сила тока в цепи, измеряемая гальванометром, равна нулю I=0. при этом ЭДС исследуемого элемента
 ,
,
где ЕА – ЭДС батареи, RA – полное сопротивление потенциометра, Rx – сопротивление части потенциометра, с которой снимается напряжение, подаваемое на гальванический элемент.
Для измерения потенциала электрода этот электрод соединяют с электродом сравнения, потенциал которого известен, и измеряют ЭДС полученного гальванического элемента. В качестве электрода сравнения часто используют хингидронный электрод, относящийся к окислительно- восстановительным электродам.
Обозначение электрода: H+ │хг, Pt.
хг – это эквимолярная смесь хинона С6H4O2 и гидрохинона С6H4(OH)2.
Реакция на электроде: С6H4O2 + 2 H+ + 2e ↔ С6H4(OH)2.
Потенциал электрода:
φ = φо + (RT/zF)ln(aH+) = φо – 0.059pH.
Достоинства этого электрода: простота, зависимость от pH среды. Недостаток: не работает в щелочной среде.
3. Термодинамика гальванического элемента. Определение энергии Гиббса реакции, энтропии реакции, константы равновесия и теплового эффекта по измерению ЭДС.
Измеряя ЭДС при различных температурах можно вычислить величину dЕ/dT. Она может быть больше нуля, меньше нуля и равной нулю. Это значит, что с увеличением температуры ЭДС может возрастать, уменьшаться или оставаться постоянной.
Значение ЭДС и ее температурной зависимости позволяет рассчитать термодинамические характеристики реакции, протекающей в гальваническом элементе:
1) Изменение энергии Гиббса:
 .
.
2) Константа равновесия реакции

3) Изменение энтропии в ходе реакции:

4) Тепловой эффект реакции: ΔG = ΔH – TΔS



Этот метод расчета термодинамических характеристик применим только для окислительно-восстановительных реакций.
4. Потенциометрические определения. Потенциометрическое титрование.
Потенциометрические определения
Потенциометрические определения – это определения каких-либо свойств, путем измерения ЭДС гальванических элементов. К ним относятся:
1) Определение термодинамических характеристик химических реакций;
2) Определение растворимости малорастворимых соединений;
3) Определение констант гидролиза солей;
4) Определение констант диссоциации кислот и оснований;
5) Определение ионного произведения воды;
6) Определение рН.
Дата добавления: 2018-04-05; просмотров: 765; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
