Опыт 3. Образование и реакции амминокомплекса меди
Nbsp; Федеральное агентство по образованию Российской Федерации Санкт-Петербургский государственный горный институт им. Г.В. Плеханова (технический университет)
Кафедра неорганической химии
Лабораторная работа №10
«Исследование комплексных соединений»
По дисциплине: Химия
(наименование учебной дисциплины согласно учебному плану)
Выполнил: студент гр. ГНГ-11______________ /Герасимова А.И. Киврина Е.В./
ОЦЕНКА: _____________
Дата: __________________
ПРОВЕРИЛ:
Преподаватель: ______________ /Берлинский И.В./
И.О.)
Санкт-Петербург
2011 год.
Цель работы: познакомиться с методами получения комплексных соединений и их свойствами.
Общие сведения
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определённым числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. При диссоциации комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
|
|
|
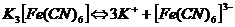

В первом случае соединение является анионным, так как содержит в своей структуре и образует при диссоциации в растворе комплексные анионы, а второй случай демонстрирует катионное соединение, поскольку при диссоциации – комплексный катион. Существуют и нейтральные соединения, у которых отсутствует внешняя сфера, а внутренняя не имеет никакого заряда, например: [Pt(NH3)2Cl2].
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, а в русском – справа налево, при этом название внутренней сферы произносят в одно слово, используя соединительную –о–, название комплексного аниона заканчивают суффиксом –ат. Степень окисления центрального атома при записи названия указывается римской цифрой в круглых скобках, заряды ионов – арабскими цифрами.
Выполнение работы
Образование комплексных соединений
Опыт 1. Образование и разрушение амминокомплекса серебра. Налить в пробирку 3−4 капли раствора нитрата серебра, добавить столько же раствора хлорида натрия (или хлорида калия). Отметить выпадение осадка хлорида серебра. Затем в вытяжном шкафу добавить в пробирку 3−5 капель концентрированного раствора аммиака и несколько раз встряхнуть. Осадок должен раствориться вследствие образования амминокомплекса серебра. Подкислить раствор аммиаката серебра азотной кислотой. Должен образоваться осадок хлорида серебра.
|
|
|
AgNO3 + NaCI = AgCI↓ + NaNO3, образовался белый творожистый осадок;
Ag1+ + NO31- + K1+ + Cl1- = 
 + K1+ + NО31-
+ K1+ + NО31-

AgCl + 2NH4OH (конц.) = [Ag(NH3)2]Cl + 2H2O , осадок растворился
AgCl + 2NH41+ +2OH1- = [Ag(NH3)2]1+ + Cl1- + 2H2O
Опыт 2. Получение амминокомплекса никеля. Налить в пробирку 3−4 капли раствора сульфата никеля. Добавить каплю разбавленного раствора аммиака, который находится в штативе с реактивами. В пробирке образуется студенистый осадок сульфата гидроксоникеля. Добавить в вытяжном шкафу 4−10 капель концентрированного раствора аммиака до полного растворения осадка. Обратите внимание на окраску раствора, обусловленную образованием в растворе катиона гексаамминоникеля (2+). К полученному раствору добавить 1 мл насыщенного раствора бромида натрия (или бромида калия). Должен выпасть осадок бромида гексаамминоникеля. Запишите уравнения всех реакций в молекулярной и ионной формах.
|
|
|
NiSO4 + NH4OH(р) = [Ni(OH)]SO4↓+ NH3, студенистый светло-зеленый осадок;
[Ni(OH)]SO4 + 6NH3(к) = Ni(NH3)62+ + SO42-, раствор светло-голубого цвета;
Ni(NH3)62+ + SO42- + 2KBr = [Ni(NH3)6]Br2↓+ K2SO4, бирюзовый осадок;
В первой реакции выпал студенистый осадок сульфат гидроксоникеля (II) -, [Ni(OH)]SO4 впоследствии при действии на него концентрированным раствором аммиака растворяется; это обуславливается образованием в растворе вещества – гидроксид гексаамминоникеля (II), придающего синий цвет раствору; при взаимодействии с которым бромида натрия даёт осадок [Ni(NH3)6]Br2.
Опыт 3. Образование и реакции амминокомплекса меди.
Налить в две пробирки по 10 капель р-ра сульфата меди (II).В первую пробирку добавить 2 капли раствора соли бария. Во вторую пробирку внести кусочек гранулированного олова и наблюдать выделение на его поверхности красноватого налета меди.
Уравнения реакции:
а) CuSO4+BaCl2=BaSO4  + CuCl2
+ CuCl2
Cu2++SO42-+Ba2++2Cl- =BaSO4  +Cu2++2Cl-
+Cu2++2Cl-
Ba2++SO42-= BaSO4 
б)СuSO4+Sn=SnSO4+Cu –выделяется красноватый налет
В первый момент выделяется осадок сульфата гидроксомеди (II), который затем растворяется вследствие образования амминокомплекса меди.
|
|
|
a) 2CuSO4 +2  = (CuOH)2SO4 +(NH4)2SO4
= (CuOH)2SO4 +(NH4)2SO4
2Cu2+ + 2SO42- + 2NH41+ + 2OH1 = (CuOH)2SO4  + 2NH41+ + SO42-
+ 2NH41+ + SO42-
2Cu2+ + SO42- + 2OH1- = (CuOH)2SO4 
b) минуя промежуточную стадию образования сульфата гидроксомеди (II):
CuSO4 + 6NH4OH = [Cu(NH3)4](OH)2 + (NH4)2SO4 + 4H2O
Cu2+ + SO42- + 6NH41+ + 6OH1- = [Cu(NH3)4]2+ + 2OH1- + 2NH41+ + SO42- + 4H2O
Cu2+ + 4NH41+ +4OH1- = [Cu(NH3)4]2+ + 4H2O
Полученный раствор комплексной соли меди разделить в две пробирки и провестите же два опыта, которые были проделаны с раствором сульфата меди.
а) (CuOH)2SO4+BaCl2=BaSO4  +(CuOH)2Cl2 - выделяется осадок
+(CuOH)2Cl2 - выделяется осадок
2CuOH++SO42-+Ba2++2Cl- = BaSO4  +2CuOH++2Cl-
+2CuOH++2Cl-
SO42-+Ba2+ = BaSO4 
б) (CuOH)2SO4+ Sn=SnSO4+2CuOH  - выделяется гидроксид меди (l)
- выделяется гидроксид меди (l)
В ходе первой реакции образовался осадок белого цвета: сульфат гидроксомеди (II) - (CuOH)2SO4, через некоторое время осадок растворяется, раствор меняет цвет на
тетраамминомеди (II).
Опыт 4.Получение комплексного основания кадмия.Получить в пробирке осадок гидроксида кадмия, добавляя к раствору его соли равный объем раствора гидроксида натрия. На полученный гидроксид подействовать концентрированным раствором аммиака до полного растворения осадка.
a) CdSO4+2NaOH = Cd(OH)2  + Na2SO4 студенистый, белый осадок
+ Na2SO4 студенистый, белый осадок
Cd+2+SO4-2+2Na++2OH- =Cd(OH)2  +2Na++SO4-2
+2Na++SO4-2
Cd+2+2OH-=Cd(OH)2 
б) Cd(OH)2 + 4NH3 = [Cd(NH3)4](OH)2 осадок растворился
Cd2++2OH- +4H++4NH2- =[Cd(NH3)4]+2 +2OH-
Cd2++4H++4NH2- =[Cd(NH3)4]+2
[Cd(NH3)4](OH)2 является более сильным электролитом, т к диссоциирует в воднос растворе, в отличае от Cd(OH)2.
Опыт 5. Получение тетрайодовисмутата калия.В пробирку к 3-4 каплям раствора нитрата висмута прибавлять по каплям раствор йодида калия до выпадения темно-бурого осадка йодида висмута. Растворить этот осадок в избытке раствора йодида калия.
a) Bi(NO3)3+3KI= BiI3  + 3KNO3 - выпал темно- бурый осадок
+ 3KNO3 - выпал темно- бурый осадок
Bi3++ 3NO3-+3K++3I- = BiI3  +3K++3NO3-
+3K++3NO3-
Bi3++3I-= BiI3 
б) BiI3+ KI= K[BiI4]
Bi3++3I-+K++I-= K++[BiI4]-
Bi3++3I-+ I-=[BiI4]-
-растворение выпавшего вначале осадка йодида висмута и образование светло-бурого раствора.
. Окраска раствора может быть обусловлена присутствием ионов Bi3+ и I-.
Так как лиганды, представляют собой связанные ковалентно анионы , то единственной возможной лигандой является I-. Комплексообразователем может быть ион Bi3+, так как в молекуле любого комплексного соединения один из ионов, обычно положительно заряженный является комплексообразователем и располагается в центральном месте молекулы. С лигандами I- комплексообразователь Bi3+, может образовывать сложный ион [BiI4]-.
Опыт 6. Получение комплексного йодида ртути. Налить в пробирку 3−4 капли раствора нитрата ртути (II) и добавить 1−2 капли раствора иодида калия. Отметить цвет образующегося осадка дийодида ртути. В пробирку по каплям добавить избыток раствора иодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата.
Hg(NO3)2 + 2KI = HgI2 ↓+ 2KNO3, осадок оранжевого цвета
HgI2 + 2KI = K2[HgI4], светло желтый раствор;
Этот анион можно выделить в осадок ионами серебра: в пробирку добавить 1-2 капли раствора нитрата серебра.
K2[HgI4] + 2AgNO3 = Ag2[HgI4]↓ + 2KNO3, желтый порошкообразный осадок;
2K+ + [HgI4]- + 2Ag- + 2NO3- = Ag2[HgI4]↓ + 2K+ + 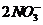
2Ag- + [HgI4]- = Ag2[HgI4]↓;
В первой реакции выпадает оранжевый осадок йодида ртути - HgI2, при добавлении избытка йодида калия осадок растворяется, что обусловлено образованием [HgI4]-2 (анион тетрайодомеркурата (II)).
Опыт 7. Образование гидроксокомплекса цинка.В пробирку налить 3−4 капли раствора сульфата цинка и добавить по каплям раствор гидроксида натрия, находящийся в штативе с реактивами, до выпадения осадка гидроксида цинка. Затем в вытяжном шкафу добавить по каплям 6 н. раствор едкого натра до полного растворения осадка вследствие образования комплексного аниона тетрагидроксоцинка (2−).
ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2↓ - студенистый осадок
Zn2+ + SO42- + 2Na+ + 2OH- = 2Na+ + SO42- + Zn(OH)2↓
Zn2+ + 2OH- = Zn(OH)2↓
Zn(OH)2 + 2NaOH = [Zn(OH)4]2- - растворение осадка
Zn(OH)2 + 2Na+ + 2OH- = [Zn(OH)4]2- + 2Na+
Zn(OH)2 + 2OH- = [Zn(OH)4]2-
-Реакции с участием комплексных соединений, не сопровождающийся разрушением комплексного иона.
Гидроксида цинка - Zn(OH)2, после добавления избытка гидроксида натрия осадок растворяется, тем самым образуется комплекс тетрагидроксоцинкат натрия - Na2[Zn(OH)4].
+
Опыт 8.Внутрикомплексные соединения.В три пробирки внести по 3 капли раствора хлорида железа. Одну оставить в качестве контрольной. В две другие добавить по 3 капли раствора щелочи. К образовавшемуся осадку в одну из них добавить 12-15 капель 2 н. щавелевой кислоты , в другую – столько же 2 н. лимонной кислоты. В обе пробирки и в контрольную внести 1-2 капли раствора роданида калия или аммония, который образует с ионами F3+ ярко окрашеный роданид железа.
а) FeCl3 +3NaOH = 3NaCl+Fe(OH)3
Fe3++3Cl- +3Na++3OH- =3Na++3Cl- + Fe(OH)3
Fe3++3OH- = Fe(OH)3
б) Fe(OH)3+3C2H2O4=[Fe(C2O4)3]+3H2O+3H
[Fe(C2O4)3]+3KSCN=Fe(SCN)3
в) Fe(OH)3+ С6Н8O7=[Fe(C2O3)3]+H2O+9H
г) FeCl3+3KSCN= Fe(SCN)3+3KCl
Во всех пробирках наблюдается окрашивание в красный цвет. Остаток щавелевой кислоты является полидентантным лигандом.
Дата добавления: 2018-04-05; просмотров: 5406; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
