Витамин А запасается в печени
Лекция 7
Липиды. Пигментный обмен. Витамины.
1. Липидный обмен. Липиды - разнообразные по химическому строению вещества, проявляющие ряд общих физических, физико-химических и биологических свойств. Они характеризуются способностью растворяться в эфире, хлороформе, других жировых растворителях и только незначительно ( и не всегда) – в воде, а также формировать вместе с белками и углеводами основной структурный компонент живых клеток.
Присущие липидам свойства обуславливаются характерными особенностями структуры их молекул.
· Простые липиды. Триацилглицерины (нейтральные жиры), в том числе диацилглицерины, моноглицерины; содержат одинаковые по химической природе жирные кислоты.
· Смешанные; содержат разные по химической природе жирные кислоты.
· Сложные липиды. Глицериновые (фосфатиды-глицериды): фосфатидилхолины (лецитины), фосфатидиэтаноламины (кефалины), фосфатидилсерины (серинфосфатиды); В этих соединениях остаток фосфорной кислоты связан с азотистым основанием.
· Гликолипиды. Цереброзиды: цереброн, керазин, нервонганглиозиды.
· Стериды. Эфиросвязанный холестерол.
Роль липидов в организме весьма разнообразна. Одни из них служат формой депонирования (триацилглицерины, ТГ) и транспорта ( свободные жирные кислоты, СЖК) веществ, при распаде которых высвобождается большое количество энергии, другие- представляют собой важнейшие структурные компоненты клеточных мембран (свободный холестерол и фосфолипиды). Липиды участвует в процессах терморегуляции, предохранении жизненно важных органов (например, почек) от механических воздействий (травм), потери белка, в создании эластичности кожных покровов, защите их от избыточного удаления влаги.
|
|
|
Некоторые из липидов являются биологически активными веществами, обладающими свойствами модуляторов гормонального влияния (простагландины) и витаминов (полиненасыщенные жирные кислоты). Более того, липиды способствуют всасыванию жирорастворимых витаминов A, D, E, K, выступают в роли антиокислителей (витамины A, E, и др.), во многом регулирующих процесс свободнорадикального окисления физиологически важных соединений, обуславливают проницаемость клеточных мембран по отношению к ионам и органическим соединениям, служат предшественниками ряда стероидов с выраженным биологическим действием: желчных кислот, витаминов группы D, половых гормонов, гормонов коры надпочеников.
Группы “общих липидов” плазмы составляют нейтральные жиры (триацилглицерины), фосфорилированные производные их основных предшественников (фосфолипиды); свободный, эфиросвязанный холестерол; гликолипиды, неэстерифицированные (свободные) жирные кислоты.
|
|
|
Методология исследования общих липидов и их фракций.
Среди существующих способов количественного определения содержания общих липидов в сыворотке (плазме) крови можно выделить следующие основные группы:
1.Гравиметрические методы, состоящие в установлении навески липидов, извлеченных из определенного объема биологических жидкостей либо гомогената тканей.
2.Окислительные методы, в которых используется окисление липидов бихроматом калия, хромовой кислотой или другими окислителями с последующим титриметрическим или колориметрическим завершением исследования.
3.Методы, основанные на свойстве липидов сыворотки избирательно окрашиваться суданом черным( или другим растворителем, проявляющим “сродство” к липидам).
4.Турбидиметрические методы, базирующиеся на сравнении степени мутности стандартной и исследуемой проб.
5.Методы основанные на цветной реакции (описанной в 1937 г. Чабролом и Чаранатом), развивающейся при взаимодействии продуктов распада ненасыщенных липидов с реактивом, включающим в себя ванилин, фосфорную и серную кислоты (сульфофосфанилиновый реактив).
Клинико-диагностическое значение определения уровня общих липидов в плазме (сыворотке) крови
|
|
|
Гиперлипидемия (гиперлипемия) -увеличение концентрации общих липидов плазмы как физиологическое явление может наблюдаться через 1-4 ч после приема пищи. Алиментарная гиперлипемия выражена тем сильнее, чем ниже уровень липидов в крови больного натощак.
Концентрация липидов в крови изменяется при целом ряде патологических состояний:
- нефротический синдром, липоидный нефроз, острый и хронический нефрит;
- билиарный цирроз печени, острый гепатит;
- ожирение- атеросклероз;
- гипотиреоз;
- панкреатит и т.д.
Исследование уровня холестерола (ХС) отражает лишь патологию обмена липидов в организме. Гиперхолестеролемия – документированный фактор риска коронарного атеросклероза. ХС – обязательный компонент мембраны всех клеток, особые физико-химические свойства кристаллов ХС и конформация его молекул способствует упорядоченности и подвижности фосфолипидов в мембранах при изменении температуры, что позволяет мембране находится в промежуточном фазовом состоянии («гель – жидкий кристалл») и сохранять физиологические функции. ХС используется в качестве предшественника при биосинтезе стероидных гормонов (глюко- и минералокортикоидов, половых), витамина D3, а также желчных кислот. Условно можно выделить 3 пула ХС:
|
|
|
- А - быстро обменивающийся (30 г);
- Б – медленно обменивающийся (50 г);
- В – очень медленно обменивающийся (60 г).
Эндогенный холестерин в значительном количестве синтезируется в печени (80%). Экзогенный холестерин поступает в организм в составе продуктов животного происхождения. Транспорт ХС из печени к внепеченочным тканям осуществляют
ЛПНП. Выведение ХС из печени из внепеченочных тканей в печень производят зрелые формы ЛПВП (50% - ЛПНП, 25% ЛПВП, 17%ЛПОНП, 5% -ХМ).
Гиперлипопротеинемия и гиперхолестеринемия ( классификация Фредриксона):
1 тип – гиперхиломикронемия;
2 тип - а – гипер-β-липопротеинемия, б - гипер -β и гиперпре-β-липопротеинемия;
3 тип – дис-β-липопротеинемия;
4 тип – гипер-пре-β-липопротеинемия;
5 тип – гиер-пре-β-липопротеинемия и гиперхиломикронемия.
Наиболее атерогенными являются 2 и 3 типы.
Фосфолипиды - группа липидов, содержащих помимо фосфорной кислоты (обязательный компонент) спирт (обычно глицерин), остатки жирных кислот и азотистые основание. В клинико-лабораторной практике имеет место метод определения уровня общих фосфолипидов, уровень которых повышается у больных с первичными и вторичными гиперлипопротеинемиями IIа и IIб. Понижение имеет место при ряде заболеваний:
- алиментарная дистрофия;
- анемии;
- жировая дегенерация печени,
- портальный цирроз;
- прогрессирование атеросклероза;
- гипертириоз и т. д.
Перекисное окисление липидов (ПОЛ) является свободно-радикальным процессом, инициация которого происходит при образовании активных форм кислорода – супероксидиона О2.; гидроксильного радикала НО. ; гидропероксидного радикала НО2.; синглетного кислорода О2; гипохлоритного иона ClO-. Основными субстратами ПОЛ являются полиненасыщенные жирные кислоты, находящиеся в структуре фосфолипидов мембран. Сильнейшим катализатором являются ионы металлов железа. ПОЛ – это физиологический процесс, который имеет важное значение для организма, так как регулирует проницаемость мембран, влияет на деление и рост клеток, начинает фагосинтез, является путем биосинтеза некоторых биологических веществ (простагландинов, тромбоксанов). Контроль за уровнем ПОЛ осуществляет антиоксидантная система (аскорбиновая кислота, мочевая кислота, β- каротин и т.д.). Потеря равновесия между двумя системами приводит к гибели клеток и клеточных структур.
Для диагностики принято определять в плазме и эритроцитах крови содержание продуктов ПОЛ (диеновые конъюгаты, малоновый диальдегид, шиффовы основания), концентрацию основного природного антиоксиданта – альфа-токоферола с расчетом показателя коэфицента МДА/ТФ. Интегральным тестом оценки ПОЛ является определение проницаемости эритроцитарных мембран.
2. Пигментный обмен совокупность сложных превращений различных окрашенных веществ в организме человека и животных.
Наиболее хорошо известен пигмент крови – гемоглобин (хромопротеин, который состоит из белковой части глобина и простетической группы, представленной 4 гемами, каждый гемм состоит из 4 пиррольных ядер, которые связаны между собой метиновыми мостиками, в центре находится ион железа со степенью окисления 2+). Средний срок жизни эритроцита составляет 100-110 суток. По окончании этого периода происходит разрушение и деструкция гемоглобина. Процесс распада начинается уже в сосудистом русле, завершается в клеточных элементах системы фагоцитирующихмононуклеаров (купферовские клетки печени, гистиоциты соединительной ткани, плазматические клетки костного мозга). Гемоглобин в сосудистом русле связывается с гаптоглобином плазмы и задерживается в сосудистом русле, не проходя почечный фильтр. Вследствие трипсиноподобного действия бета-цепи гаптоглобина и вызванных его влиянием конформационных изменений в порфириновом кольце гема создаются условия для более легкого разрушения гемоглобина в клеточных элементах системы фагоцитирующихмононуклеарон.Образующийся таким образом высокомолекулярный пигмент зеленого цвета вердоглобин (синонимы: вердогемоглобин, холеглобин, псевдогемоглобин) представляет собой комплекс, состоящий из глобина, разорванной системы порфиринового кольца и трехвалентного железа. Дальнейшие превращения приводят к потере вердоглобином железа и глобина, в результате чего порфириновое кольцо разворачивается в цепь и формируется низкомолекулярный желчный пигмент зеленого цвета-биливердин. Почти весь он ферментативным путем восстанавливается в важнейший красно-желтый пигмент желчи - билирубин, являющийся обычным компонентом плазмы крови.На поверхности плазматической мембраны гепатоцита подвергается диссоциации. При этом высвобожденный билирубин образует временный ассоциат с липидами плазматической мембраны и перемещается через нее благодаря деятельности определенных ферментных систем. Дальнейшее прохождение свободного билирубина в клетку происходит при участии в этом процессе двух белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z.
Лигандин и протеин Z обнаружены также в почках и кишечнике, поэтому при недостаточности функции печени они свободны компенсировать ослабление процессов детоксикации в этом органе. И те и другие достаточно хорошо растворимы в воде, но лишены способности перемещаться через липидный слой мембраны. За счет связывания билирубина с глюкуроновой кислотой присущая свободному билирубину токсичность в значительной мере теряется. Гидрофобный, липофильный свободный билирубин, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клеток и органелл. Это отрицательно сказывается на состоянии центральной нервной системы, вызывая у больных ряд характерных неврологических симптомов.
Билирубинглюкурониды (или связанный, конъюгированный билирубин) в отличие от свободного билирубина тотчас вступают в реакцию с диазореактивом (“прямой” билирубин). Следует иметь в виду, что в самой плазме крови билирубин, не конъюгированный с глюкуроновой кислотой, может быть либо связан с альбумином, либо нет. Последняя фракция (не связанного ни с альбумином, ни с липидами, ни с другими компонентами крови билирубина) наиболее токсична.
Билирубинглюкурониды благодаря ферментным системам мембран активно перемещаются через них (против градиента концентрации) в желчные ходы, выделяясь вместе с желчью в просвет кишечника. В нем под воздействием ферментов, продуцируемых кишечной микрофлорой, происходит разрыв глюкуронидной связи. Высвобожденный свободный билирубин восстанавливается с образованием в тонком кишечнике сначала мезобилирубина, а затем и мезобилиногена (уробилиногена). В норме определенная часть мезобилиногена, всасываясь в тонком кишечнике и в верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается (путем окисления), превращаясь в дипиррольные соединения – пропент-диопент и мезобилилейкан.
Мезобилиноген (уробилиноген) при этом в общий ток кровообращения не поступает. Часть его вместе с продуктами разрушения вновь направляется в просвет кишечника в составе желчи (энтерогепотальный круговорот). Однако даже при самых незначительных изменениях в печени ее барьерная функция во многом “снимается” и мезобилиноген попадает сначала в общий ток кровообращения, а затем в мочу. Основная же масса его направляется из тонкого кишечника в толстый, где под влиянием анаэробной микрофлоры (кишечной палочки и других бактерий) подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген (суточное количество 100-200 мг) почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую оболочку толстого кишечника в систему нижней полой вены, доставляется с кровью в почки и выделяется с мочой.
Таким образом, в моче здорового человека мезобилиноген (уробилиноген) отсутствует, но в ней содержится некоторое количество стеркобилина (который часто не совсем правильно называют “уробилином”)
Для определения содержания билирубина в сыворотке (плазме) крови используют в основном химические и физико-химические методы исследования, среди которых выделяют колориметрические, спектрофотометрические (ручные и автоматизированные), хроматографические, флюориметрические и некоторые другие.
Содержание общего билирубина в сыворотке крови в норме не превышает 25, 7 мкмоль /л, при более высоких значениях используют термин «гипербилирубинемия».
Один из важных субъективных признаков нарушения пигментного обмена – появление желтухи, которое отмечается обычно при уровне билирубина в крови 27-34 мкмоль/л и более. Причинами гипербилирубинемии могут быть: 1) усиление гемолиза эритроцитов (более 80% общего билирубина представлено неконъюгированным пигментом); 2) нарушение функции печеночных клеток и 3) задержка оттока желчи (гипербилирубинемия имеет печеночное происхождение, если более 80% общего билирубина составляет конъюгированный билирубин). В первом случае говорят о так называемой гемолитической желтухе, во втором – о паренхиматозной (может быть вызвана наследственно обусловленными дефектами в процессах транспорта билирубина и его глюкуронидирования), в третьем – о механической (или обтурационной, застойной) желтухе.
При паренхиматозной форме желтухиотмечаются деструктивно-дистрофические изменения в паренхиматозных клетках печени и инфильтративные – в строме, приводящие к повышению давления в желчных протоках. Застою билирубина в печени способствует также резкое ослабление метаболических процессов в пораженных гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить связанный билирубин из клеток в желчь против градиента концентрации. Повышение концентрации связанного билирубина в крови приводит к его появлению в моче.
Повышение содержания общего и в особенности связанного билирубина в крови, а также наличие его в моче не являются ранними признаками поражения паренхимы печени.
Наиболее “тонким” признаком поражения печени при гепатитах служит появление мезобилиногена(уробилиногена) в моче.
При паренхиматозной желтухе увеличивается главным образом концентрация связанного (коньюгированного) билирубина в крови. Содержание свободного билирубина возрастает, но в меньшей степени.
В основе патогенеза обтурационной желтухе лежит прекращение поступления желчи в кишечник, что приводит к исчезновению стеркобилиногена из мочи. При застойной желтухе увеличивается главным образом содержание связанного билирубина крови. Внепеченочные холестатические желтухи сопровождаются триадой клинических признаков: обесцвеченным калом, темной мочой и зудом кожи. Внутрипеченочныйхолестаз клинически проявляется зудом кожи и желтухой. При лабораторном исследовании отмечается гипербилирубинемия (за счет связанного), билирубинурия, повышение щелочной фосфатазы при нормальных значениях трансаминаз в сыворотке крови.
Гемолитические желтухи обусловлены гемолизом эритроцитов и, как следствие, повышенным образованием билирубина. Повышение содержания свободного билирубина является одним из главных признаков гемолитической желтухи.
В клинической практике выделяют врожденные и приобретенные функциональные гипербилирубинемии, обусловленные нарушением элиминации билирубина из организма (наличие дефектов в ферментных и других системах переноса билирубина через мембраны клеток и его глюкуронидирования в них). Синдром Жильбера - наследственное доброкачественное хроническое заболевание, протекающее с умеренно выраженной негемолитической неконъюгированной гипербилирубинемией. Постгепатитная гипербилирубинемия Калька - приобретенный энзимный дефект, приводящий к увеличению уровня свободного билирубина в крови, врожденная семейная негемолитическая желтуха Криглера – Найяра (отсутствие в гепатоцитахглюкуронилтрансферазы), желтуха при врожденном гипотириозе (тироксин стимулирует ферментную глюкуронилтрансферазную систему), физиологическая желтуха новорожденных, лекарственная желтуха и др.
Нарушения пигментного обмена могут быть вызваны изменениями не только в процессах распада гемма, но и в образовании его предшественников – порфиринов (циклические органические соединении, в основе которых лежит кольцо порфина, состоящее из 4 пирролов, соединенных метиновыми мостиками). Порфирии – группа наследственных заболеваний, сопровождающихся генетическим дефицитом активности энзимов, принимающих участие в биосинтезе гемма, при которых в организме обнаруживается увеличение содержания порфиринов или их предшественников, что обуславливает ряд клинических признаков (избыточное образование продуктов метаболизма, вызывает развитие неврологических симптомов и (или) повышение фоточувствительности кожи).
Наиболее широко используемые методы определения билирубина основаны на его взаимодействии с диазореагентом (реактивом Эрлиха). Широкое распространение получил метод Ендрассика- Грофа. В этом методе в качестве «освободителя» билирубина используют смесь кофеина и бензоата натрия в ацетатном буфере. Ферментативное определение билирубина основано наего окислении билирубиноксидазой. Возможно определение неконъюгированного билирубина и другими методами ферментативного окисления.
В настоящее время все большее распространение, особенно при экспресс-диагностике, получает определение билирубина методами «сухой химии».
Витамины.
Витаминами называют незаменимые низкомолекулярные вещества, поступающие в организм с пищей извне и участвующие в регуляции биохимических процессов на уровне ферментов.
Сходство и различие витаминов и гормонов.
Сходство – регулируют метаболизм в организме человека через ферменты:
· Витамины входят в состав ферментов и являются коферментами или кофакторами;
· Гормоны или регулируют активность уже имеющихся ферментов в клетке, или являются индукторами или репрессорами вв биосинтезе необходимых ферментов.
Различие:
· Витамины – низкомолекулярные органические соединения, экзогенные факторы регуляции метаболизма и поступают с пищей извне.
· Гормоны – высокомолекулярные органические соединения, эндогенные факторы, синтезирующиеся в эндокринных железах организма в ответ на изменение внешней или внутренней среды организма человека, и также регулируют метаболизм.
Витамины классифицируются на:
1. Жирорастворимые: A, D, E, K, А.
2. Водорастворимые: группа В, PP, H, C, ТГФК (тетрагидрофолиевая кислота), пантотеновая кислота (В3), Р (рутин).
Витамин А (ретинол, антиксерофтальмический) –химическая структура представлена β- иононовым кольцом и 2 остатками изопрена; потребность в организме составляет 2,5-30 мг в сутки.
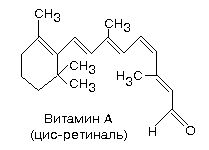
Наиболее ранний и специфический признак гиповитаминоза А - гемералопия (куриная слепота) - нарушение сумеречного зрения. Возникает из-за недостатка зрительного пигмента - родопсина. Родопсин содержит в качестве активной группы ретиналь (альдегид витамина А) - находится в палочках сетчатки. Эти клетки (палочки) воспринимают световые сигналы низкой интенсивности.
Родопсин = опсин (белок) + цис-ретиналь.
При возбуждении родопсина светом, цис-ретиналь, в результате ферментативных перестроек внутри молекулы переходит в полностью-транс-ретиналь (на свету). Это приводит к конформационной перестройке всей молекулы родопсина. Родопсин диссоциирует на опсин и транс-ретиналь, что является пусковым механизмом, возбуждающим в окончаниях зрительного нерва импульс, который затем передается в мозг.
В темноте, в результате ферментативных реакций транс-ретиналь вновь превращается в цис-ретиналь и, соединяясь с опсином, образует родопсин.
Витамин А также влияет на процессы роста и развития покровного эпителия. Поэтому при авитаминозе наблюдается поражение кожи, слизистых оболочек и глаз, которое проявляется в патологическом ороговении кожи и слизистых. У больных развивается ксерофтальмия - сухость роговой оболочки глаза, так как происходит закупорка слезного канала в результате ороговения эпителия. Так как глаз перестает омываться слезой, которая обладает бактерицидным действием, развиваются конъюнктивиты, изъязвление и размягчение роговицы - кератомаляция. При авитаминозе А может быть также поражение слизистой ЖКТ, дыхательных и мочеполовых путей. Нарушается устойчивость всех тканей к инфекциям. При развитии авитаминоза в детстве - задержка роста.
В настоящее время показано участие витамина А в защите мембран клеток от окислителей - т. е. витамин А обладает антиоксидантной функцией.
Витамин А запасается в печени.
Пищевые источники - печень морских рыб и млекопитающих, желток яиц, цельное молоко, рыбий жир. Овощи и фрукты красно-оранжевого цвета (томаты, морковь и др.) содержат много каротина - водорастворимого предшественника витамина А, имеющего в молекуле 2 иононовых кольца.
В настоящее время, гиповитаминоз А наблюдается у людей с заболеваниями кишечника, поджелудочной железы, при нарушении желчевыделительной функции печени, т. е. при заболеваниях, при которых нарушается всасывание жира. Высокие дозы витамина А могут приводить к токсическим эффектам. Характерные проявления гипервитаминоза - воспаление глаз, гиперкератоз, выпадение волос, диспептические явления.
Витамин Д (холекальциферол, антирахитный) –по химической природе представляет собой холекальциферол (производное циклопентаноперигидрофенантрена), суточная потребность которого в организме составляет 0,025 мг. Из витамина Д3, под действием 25-гидроксилазы (в печени) и 1- гидроксилазы (в почках) синтезируется гормон кальцитриол, регулирующий обмен кальция и фосфора в организме.
Сам витамин Д не обладает витаминной активностью, но он служит предшественником 1,25-дигидрокси-холекальциферола (1,25-дигидроксивитамина Д3).

Синтез активной формы протекает в два этапа - в печени присоединяется оксигруппа в положении 25, а затем в почках - оксигруппа в положении 1. Из почек активный витамин Д3 переносится в другие органы и ткани - главным образом в тонкий кишечник и в кости, где витамин Д участвует в регуляции обмена Са и Р. Недостаток витамина Д приводит к развитию нарушений фосфорно-кальциевого обмена и процессов окостенения. В результате у детей развивается рахит, связанный с недостатком Са и Р. Характерные признаки рахита - остеомаляция ("размягчение" костей - запаздывание окостенения), запаздывание закрытия родничков, деформации грудной клетки, позвоночника, конечностей. У таких детей снижен мышечный тонус, наблюдается раздражительность, потливость, выпадение волос.
У взрослых при недостатке витамина Д наблюдается остеопороз - разрежение костной ткани в результате вымывания солей кальция из скелета, повышение нервно-мышечной возбудимости, инактивация кальций-зависимых ферментов, нарушение свертывания крови.
Дата добавления: 2018-04-05; просмотров: 699; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
