Основные положения технической термодинамики
Техническая термодинамика рассматривает закономерности взаимного превращения теплоты в работу. Объектом исследования является термодинамическая система – совокупность макроскопических тел, обменивающихся энергией друг с другом и окружающей средой. Термодинамическая (т/д) система в зависимости от внешних условий в каждый момент времени находится в каком-либо физическом состоянии. Количественное состояние системы характеризуется физическими величинами, называемыми параметрами состояния.
К основным параметрам состояния относят: удельный объем v, абсолютное давление Р, температуру Т. Параметрами состояния являются также внутренняя энергия U, энтальпия h, энтропия S.
Удельный объем [м3/кг] – величина, определяемая отношением объема вещества (V) к его массе (m): v = V / m.
Величину, обратную удельному объему, называют плотностью: ρ = m / V.
Абсолютное давление – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума.
При давлении сосуда больше атмосферного: Р = Ри + Ро;
при давлении сосуда меньше атмосферного: Р = Ро – Рв ,
где Ро – атмосферное давление; Рв – давление вакуума; Ри – избыточное давление. За единицу давления принят 1Па = 1 н/м2.
Температура пропорциональна кинетической энергии частиц рабочего тела. Единицей измерения температуры является Кельвин (К). Температуру, измеренную в Кельвинах, обозначают Т, в градусах Цельсия (оС) – t:
|
|
|
Т = t + 273,15.
Состояние тела, при котором во всех точках его объема Р, v, Т и все другие физические свойства одинаковы, является равновесным состоянием.
Совокупность изменений состояния термодинамической системы при переходе из одного состояния в другое называется термодинамическим процессом.
Первый закон термодинамики
Теплота и работа.Тела, участвующие в термодинамическом процессе обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами: 1) в форме теплоты; 2) в форме работы.
Количество энергии, полученное телом в форме работы, называют работой, совершенной над телом, а отданную энергию – затраченной телом работой. Количество теплоты, полученное (отданное) телом, и работа, совершенная (затраченная) над телом, зависят от характера термодинамического процесса, т.е от условий перехода тела из начального состояния в конечное.
Внутренняя энергия.В общем случае внутренней энергией называется совокупность всех видов энергий, заключенных в теле или системе тел. В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии.
|
|
|
Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P, T); U = f (v, T); U= f (P, v).
Первый закон термодинамики является законом сохранения и превращения энергии: «Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах».
Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии системы: «Теплота, подведенная к системе, расходуется на изменение энергии системы и совершение работы». Уравнение первого закона термодинамики имеет вид:
Q = (U2 – U1) + L , (3.11)
где Q – количество теплоты, подведенное (отведенное) к системе; L – работа, совершенная системой (над системой); (U2 – U1) – изменение внутренней энергии в данном процессе.
Если: Q > 0 – теплота подводится к системе; Q < 0 – теплота отводится от системы; L > 0 – работа совершается системой; L < 0 – работа совершается над системой.
Для элементарного изменения системы выражение (3.11) имеет вид:
dQ = dU + dL.
Первый закон термодинамики указывает, что для получения полезной работы в непрерывно действующем тепловом двигателе необходимо подводить (затрачивать) теплоту.
|
|
|
Двигатель, постоянно производящий работу и не потребляющий никакой энергии, называется вечным двигателем первого рода. Из этого следует: «Вечный двигатель первого рода невозможен».
Количество подведенной (отведенной) к телу теплоты можно определить по выражению:
 , (3.12)
, (3.12)
где С – теплоемкость тела, Дж /К;  – изменение температуры тела, К.
– изменение температуры тела, К.
В технических расчетах пользуются понятиями удельной массовой с [Дж/(кг·К)], объемной [Дж/(м3·К)] и молярной сμ [Дж/(кмоль·К)]теплоемкости. Связь между с, с/ и сμ определяется выражением:
с = с/ · v = сμ / μ ,
где v – удельный объем вещества, м3/кг; μ – мольная масса, кг/моль.
Количество теплоты определяется соответственно:
Q=c·m(T2 – T1) = с/Vн(T2 – T1) = сμ n(T2 – T1),
где m – масса газа, кг; Vн – объем газа, приведенный к нормальным физическим условиям, м3; n – число молей газа, кмоль.
В зависимости от способа подвода теплоты различают теплоемкости при постоянном давлении ср (изобарную) и при постоянном объеме сv (изохорную):
ср – μ сv = μ R или ср – сv = R (уравнение Майера).
Отношение k = ср / сv называют показателем адиабаты.
Уравнение состояния идеального газа выведено в 1834 г. французским физиком Клапейроном и для 1 кг массы газа имеет вид:
|
|
|
Р· v = R·Т ,
где R - газовая постоянная, представляет работу 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1 градус, Дж/(кг·К).
Для произвольного количества газа массой m уравнение состояния:
Р·V = m·R·Т .
В 1874 году Д.И.Менделеев предложил универсальное уравнение состояния для 1 кг газа (уравнение Клапейрона – Менделеева):
Р· v = Rμ·Т/μ , (3.13)
где μ – мольная (молекулярная) масса газа, (кг/кмоль); Rμ = 8314,20 Дж/кмоль (8,3142 кДж/(кмоль К)) – универсальная газовая постоянная, представляет работу 1 кмоль идеального газа в процессе при постоянном давлении и при изменении температуры на один градус. Зная Rμ, можно найти газовую постоянную:
R = Rμ/μ.
Для произвольной массы газа уравнение Клапейрона – Менделеева:
Р·V = m·Rμ·Т/μ .
Второй закон термодинамики
Основные положения второго закона термодинамики.Превращение работы в теплоту происходит полностью и безусловно. Обратный процесс превращения теплоты в работу возможен только при определенных условиях и не полностью. Теплота сама собой может переходить от более нагретых тел к холодным. Для перехода теплоты от холодных тел к нагретым нужно затратить дополнительную энергию.
Второй закон термодинамики устанавливает, возможен или невозможен тот или иной процесс, направление протекания процесса, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.Для существования теплового двигателя необходимы два источника: горячий и холодный. Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем второго рода.
Первая формулировка (Оствальда): «Вечный двигатель второго рода невозможен».Вечный двигатель второго рода можно осуществить, если теплоту Q2 передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует вторая формулировка (Клаузиуса): «Теплота не может самопроизвольно переходить от более холодного тела к более нагретому».Третья формулировка (Карно): «Там где есть разница температур, возможно совершение работы».
Энтропия.Это одна из функций состояния термодинамической системы, устанавливающая связь между количеством теплоты и температурой [Дж/К]:
dS = dQ / T.
Выражение для удельной энтропии [Дж/(кг·К)]: ds = dq / T.
Энтропия является экстенсивным параметром состояния (зависит от массы вещества): S = f1(P,V) ; S = f2(P,T) ; S = f3(V,T) .
Для удельной энтропии: s = f1(P,v) ; s = f2(P,T) ; S = f3(v,T).
Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только ее изменение в данном процессе Ds:
Ds = cv·ln(T2/T1)+R·ln(v 2/ v 1);
Ds = cp·ln(T2/T1) - R·ln(P2/P1); (3.14)
Ds = cv·ln(Р2/Р1)+cр·ln(v 2/ v 1).
Если Ds > 0 – к системе подводится тепло; Ds < 0 – от системы отводится тепло;
Ds = 0 (s = сonst) – к системе не подводится и не отводится тепло (адиабатный процесс).
Цикл и теоремы Карно.Циклом Карно называется круговой цикл, состоящий из двух изотермических и двух адиабатных процессов. Обратимый цикл Карно в P, v- и T, s- диаграммах показан на рис. 3.8.

Рис. 3.8. Обратимый цикл Карно в P,v- (а) и T,s- (б) диаграммах
Участок 1-2 характеризует обратимое адиабатное расширение при s1=сonst (температура уменьшается от Т1 до Т2); 2-3 – изотермическое сжатие (отвод теплоты q2 к холодному источнику от рабочего тела); 3-4 – обратимое адиабатное сжатие при s2=сonst (температура повышается от Т3 до Т4); 4-1 – изотермическое расширение (подвод теплоты q1 от горячего источника к рабочему телу).
Основной характеристикой любого термодинамического цикла является термический коэффициент полезного действия (термический КПД):
ht = Lц / Qц , или ht = (Q1 – Q2) / Q1 .
Для обратимого цикла Карно термический КПД:
htк = (Т1 – Т2) / Т1 . (3.15)
Из (3.15) следует первая теорема Карно: Термический КПД обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников.
Из сравнения произвольного обратимого цикла и цикла Карно вытекает вторая теорема Карно: Обратимый цикл Карно является наивыгоднейшим циклом в заданном интервале температур,т.е. термический КПД цикла Карно всегда больше термического КПД произвольного цикла: htк > ht .
Термодинамические процессы
К основным термодинамическим процессам относятся изохорный, изотермический, изобарный и адиабатный процессы.
Для идеального газа:
Изохорный процесс (рис.3.9, а): v = сonst , n 2 = n 1.
Уравнение состояния процесса: P2 / P1 = T2 / T1.
Так как v 2 = v 1, то работа процесса l = 0.
Уравнение первого закона термодинамики: q = Du = сv·(T2 - T1).
Изобарный процесс (рис.3.9, б): P = const , P2 = P1.
Уравнение состояния процесса: n 2 /n 1 = T2 / T1 .
Работа процесса: l = P·(n 2 - n 1).
Уравнение первого закона термодинамики: q = Du + l = ср·(T2 - T1).

| 
| 
|
| а) | б) | в) |
| Рис. 3.9. Изопроцессы идеального газа: а – изохорный; б – изобарный; в – изотермический | ||
Изотермический процесс (рис.3.9, в): Т = const , Т2 = Т1.
Уравнение состояния процесса: P1 / P2 = n 2 / n 1 .
Так как Т2 = Т1, то Du = 0. Уравнение первого закона термодинамики:
q = l = R·T·ln(n 2/n 1) или q = l = R·T·ln(P1/P2),
где R – газовая постоянная, Дж/(кг К).
Адиабатный процесс. В данном процессе не подводится и не отводится тепло, т.е. q =0. Уравнение состояния процесса: P·n l = const,
где l = cp / cv – показатель адиабаты.
Уравнение первого закона термодинамики: l = -Du = -сv·(T2 – T1) = сv·(T1 – T2),
или l = R·(T1 – T2) / (l -1);
l = R·T1·[1 – (n 1/ n 2) l -1] /(l – 1);
l = R·T2·[1 – (P2/P1) (l -1)/ l] /(l – 1).
Первый закон термодинамики для потока.При рассмотрении рабочих процессов тепловых машин встречаются задачи изучения закономерностей движения рабочих тел (газов, пара и жидкостей).
Если принять допущения:
- движение газа по каналу установившееся и неразрывное;
- скорости по сечению, перпендикулярному оси канала, постоянны;
- пренебрегается трение частичек газа друг другу и о стенки канала;
- изменение параметров по сечению канала мало по сравнению их абсолютными значениями;
то уравнение первого закона термодинамики для потока газа будет иметь вид:
q = Du + De + lпрот. + lтехн. , (3.16)
где De – изменение энергии системы, состоящей из изменения кинетической и потенциальной энергий; lпрот – работа проталкивания, затрачиваемая на движение потока; lтехн. – техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.);
De = (w22 – w21)/2 + g·(z2 –z1),
где w1, w2 – скорости потока в начале и в конце канала; z1, z2 – высота положения начала и конца канала.
lпрот. = P2·n 2 – P1·n 1.
q = (u2 – u1) + (w22 – w21)/2 + g·(z2 –z1) + P2·n 2 – P1·n 1 + lтехн. .
Введем понятие энтальпии, которую обозначим через величину h:
h = u + Pn , (3.17)
h2 = u2 + P2·n 2 ; h1 = u1 + P1·n 1 .
Тогда уравнение первого закона термодинамики для потока газа будет иметь вид:
q = h2 – h1 + (w22 – w21)/2 + g·(z2 –z1) + lтехн . (3.18)
Реальные газы. Водяной пар
Свойства реальных газов.В отличие от идеальных газов, молекулы реальных газов имеют объем и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между ними. При практических расчетах свойств реальных газов наряду с уравнением состояния применяется отношение (P·n)/(R·T)=c, где с – коэффициент сжимаемости.
Для идеальных газов с = 1, так как P·n = R·T. Тогда величина с выражает отклонение свойств реального газа от свойств идеального. Величина с для реальных газов в зависимости от давления и температуры может принимать значения больше или меньше единицы, и только при малых давлениях и высоких температурах она практически равна единице. Тогда реальные газы можно рассматривать как идеальные.
Уравнения состояния реального газа.Поведение реального газа отражает уравнение Ван-дер-Ваальса:
(P + a/n2)·(n – b) = R·T , (3.19)
где а, b – постоянные величины (а учитывает силы взаимодействия, b – размер молекул); a/n2 – внутреннее давление (добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами).
Для жидкости a/n2 велико (для воды при 20 оС составляет 1050 МПа), поэтому внешнее давление оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. Для газов из-за малых сил сцепления молекул a/n2 очень мало, поэтому внешнее давление легко изменяет объем газа.
Уравнение (3.19) качественно верно отображает поведение жидкостей и газов, но для двухфазных состояний оно неприменимо. На рис.3.10 показаны изотермы, построенные по уравнению (3.19).

Рис.3.10. Изотермы, построенные по уравнению Ван-дер-Ваальса
На рис.3.10 видно, что при сравнительно низких температурах Т имеются волнообразные участки. Чем выше Т, тем короче эти участки. Волнообразные кривые указывают на непрерывный переход от жидкого в парообразное состояние при данной Т. Точка А соответствует состоянию жидкости, точка В – пара. Переход из жидкого в парообразное состояние происходит через двухфазное состояние вещества (при данной температуре и постоянном давлении), что показано прямой АВ.
Для особо чистых веществ возможно осуществление участков волнообразной кривой AQ и DB. В первом случае имеют место неустойчивые состояния перегретой жидкости, а во втором – переохлажденного пара. При определенной Т изотерма не будет иметь волнообразного участка (точка К). Эту Т называют критической. Если соединить точки А1, А2, А3 … и В1, В2, В3 ... получится кривая, похожая на параболу. Кривая АК соответствует состоянию кипения жидкости. Кривая КВ соответствует состоянию сухого насыщенного пара.
Таким образом, для реального вещества Pv– диаграмму можно разбить на три области: 1) область жидкого состояния, левее кривой АК; 2) область двухфазных состояний (влажный пар), между кривыми АК и КВ; 3) область перегретого пара, правее кривой КВ и выше критической точки. Условно область жидкости ограничивают сверху линией КМ (критическая изобара).
Критическую температуру Тк Д.И.Менделеев назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости равно нулю, т.е. различие между жидкостью и парообразным состоянием вещества исчезает (насыщенный пар).
Связь между критическими параметрами и постоянными уравнения (3.19):
Тк = 8·а/(27·R·b) ; Pк = a/(27·b2) ; (3.20)
а = (27· R2 ·Т2к)/(64 ·Pк) ; b = (27· R ·Тк)/(8 ·Pк).
При больших плотностях газа (3.19) дает значительные ошибки. М.П. Вукалович и И.И. Новиков в 1939г. предложили универсальное уравнение состояния реальных газов с учетом ассоциации и диссоциации их молекул:
(P + a/n2)·(n – b) = R·T (1 – С/( n ·Т(3+2m)/2), (3.21)
где a, b – постоянные уравнения Ван-дер-Ваальса; С, m – постоянные, определяемые на основе опытных данных.
Понятие о водяном паре.Рабочим телом в паровых турбинах, атомных установках, теплоносителем в теплообменниках является водяной пар. Пар – газообразное тело в состоянии, близком к кипящей жидкости. Процесс превращения вещества из жидкого в парообразное состояние называют парообразованием. Испарение – парообразование, происходящее с поверхности жидкости.
При некоторой определенной температуре, зависящей от природы жидкости и давления, начинается парообразование во всей массе жидкости – кипение. Обратный процесс называется конденсацией. Она также протекает при постоянной температуре. При испарении жидкости в ограниченном пространстве (в паровых котлах) одновременно происходит обратное явление – конденсация пара. Если скорость конденсации станет равной скорости испарения, то наступает динамическое равновесие. Пар в этом случае имеет максимальную плотность и называется насыщенным паром. Если Т пара выше Т насыщенного пара того же давления, то такой пар называется перегретым. Разность между Т перегретого пара и Т насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром. В момент испарения последней капли жидкости в ограниченном пространстве без изменения Т и давления образуется сухой насыщенный пар. Состояние такого пара определяется давлением. Механическая смесь сухого пара и мельчайших капелек жидкости называется влажным паром. Массовая доля сухого пара во влажном паре называется степенью сухости х:
х = mсп / mвп ,
где mсп – масса сухого пара во влажном; mвп – масса влажного пара.
Массовая доля жидкости во влажном паре называется степенью влажности у:
у = 1 – х .
Для кипящей жидкости при Т насыщения х = 0, для сухого пара х = 1.
Основные термодинамические процессы водяного пара в h,s- диаграмме
В практических расчетах количество участвующей в процессе теплоты проще определять по h,s- диаграмме водяного пара (рис. 3.11). Это график, построенный в системе координат h-s, на котором нанесены изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара. На графике нанесены также линии постоянного паросодержания (х = const) и постоянного удельного объема (v = const). Изохоры идут круче, чем изобары.
Семейство изобар в области насыщения представляет собой пучок расходящихся прямых. Они начинаются на нижней и оканчиваются на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
Состояние перегретого пара определяется в технике давлением p и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением p и паросодержанием х. Точка, изображающая это состояние, находится на пересечении изобары и линии х = const.

| 
|
| а) | б) |
| Рис. 3.11. h,s- диаграмма для воды и водяного пара (а) и ее практически используемая область для водяного пара (б) | |
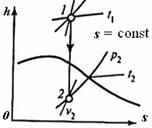
На рис. 3.12 представлены основные термодинамические процессы для водяного пара в h,s- диаграмме. С помощью h,s- диаграммы можно без дополнительных расчетов и с достаточной точностью найти числовые значения до шести термодинамических параметров: h, S, v, p, t, x. По найденным параметрам определяются: работа, теплота, изменение внутренней энергии.

| 
| 
| 
|
| а) | б) | в) | г) |
| Рис. 3.12. Основные термодинамические процессы для водяного пара в h,s- диаграмме | |||
Термодинамические циклы
Циклы паротурбинных установок.Паротурбинная установка (ПТУ) – основа тепловых и атомных электростанций. Рабочим телом в ПТУ является водяной пар, а основным циклом – цикл Ренкина. Цикл Ренкина – теоретический термодинамический цикл паровой машины, состоящий из четырех основных процессов: 1) испарения жидкости при высоком давлении; 2) расширения пара; 3) конденсации пара; 4) увеличения давления жидкости до начального значения. Принципиальная схема ПТУ показана на рис.3.13, а.

| 
| 
|
| а) | б) | в) |
| Рис. 3.13. Циклы паротурбинных установок: схема ПТУ (а); циклы Ренкина на насыщенном (б) и перегретом (в) паре | ||
В паровом котле 1 и в перегревателе 2 теплота горения топлива передается воде. Полученный пар поступает в турбину 3, где происходит преобразование теплоты в механическую работу, а затем в электрическую энергию в электрогенераторе 4. Отработанный пар поступает в конденсатор 5, где отдает теплоту охлаждающей воде. Полученный конденсат конденсатным насосом 6 отправляется в питательный бак 7, откуда питательным насосом 8 сжимается до давления, равного в котле, и подается через подогреватель 9 в паровой котел 1.
Цикл Ренкина на насыщенном паре. В данном случае перегреватель отсутствует, поэтому на турбину будет поступать насыщенный пар.
Процессы (рис.3.13,б):
· 3-0 – подвод теплоты q1 к питательной воде (3-4 – кипение воды в котле; 4-0 – парообразование при постоянном давлении);
· 0-1– адиабатное расширение пара в турбине;
· 1-2 – конденсация пара с отдачей теплоты q2 охлаждающей воде;
· 2-3 – адиабатное сжатие конденсата.
Термический КПД цикла Ренкина: htР = (q1 – q2)/q1 .
Так как: q1 = h0 – h3 ; q2 = h1 – h2 ,
где h0 (h1), h3 ( h2) – энтальпии соответственно в начальных и конечных точках процесса,
то htР = [(h0 – h3)–(h1 – h2')] /(h0 – h3) = lПТУ / q1, (3.22)
где lПТУ – полезная работа цикла ПТУ, равная разности работ турбины lт и насоса lн.
lПТУ = lт – lн ,
где lт= h0 – h1 ; lн = h3 – h2 .
Обычно lт >> lн , при этом h3 ≈ h2 .
Выражение (3.22) в упрощенном виде:
htР = (h0 – h1)/( h0 – h3) . (3.23)
Теоретическая мощность турбины, Вт:
Nт = (h0 – h1)·D/3600 , (3.24)
где D = 3600·m – часовой расход пара, кг/ч; m – секундный расход пара, кг/с.
Цикл Ренкина на перегретом паре применяется для увеличения термического КПД цикла ПТУ. Для этого перед турбиной ставят перегреватель 2 (рис.3.13, а), который увеличивает температуру и давление пара. При этом возрастает средняя температура подвода теплоты в цикле. Диаграмма цикла показана на рис.3.13,в. Формулы расчета l, htР, Nт остаются без изменений.
Циклы двигателей внутреннего сгорания.Двигатели внутреннего сгорания (ДВС) выполняются в виде поршневых газовых двигателей, в которых рабочим телом являются продукты сгорания топлива. Циклы поршневых ДВС подразделяют на три группы:
- цикл Отто (1876 г.) – с подводом теплоты при постоянном объеме (карбюраторные ДВС);
- цикл Дизеля (1892 г.) – с подводом теплоты при постоянном давлении (компрессорные дизели);
- цикл Тринклера (1901 г.) – со смешанным подводом теплоты при постоянном объеме (бескомпрессорные дизели);
Основные характеристики любого цикла теплового двигателя:
- степень сжатия (отношение удельных объемов рабочего тела в начале и конце сжатия): e = n1 / n2 ;
- степень повышения давления (отношение давлений в конце и в начале изохорного процесса подвода теплоты) l = Р3 / Р2 ;
- степень предварительного расширения или степень изобарного расширения (отношение удельных объемов в конце и в начале изохорного процесса подвода теплоты): r = n3 / n2 .
Рассмотрим цикл ДВС с подводом теплоты при постоянном объеме на примере четырехтактного двигателя (рис.3.14, а).

| 
|

|
| а) | б) | в) |
| Рис. 3.14. Циклы ДВС: с подводом теплоты при постоянном объеме (а); идеальный процесс (б); со смешанным подводом теплоты (в) | ||
На рис. 3.14, а:
· а-1 (1 такт) – в цилиндр через всасывающий клапан поступает смесь воздуха и паров горючего (нетермодинамический процесс);
· 1-2 (2 такт) – адиабатное сжатие (повышается температура);
· 2-3 – сгорание горючей смеси, давление быстро возрастает при постоянном объеме (подвод теплоты q1);
· 3-4 (3 такт) – адиабатное расширение (рабочий процесс, совершается полезная работа);
· 4-а – открывается выхлопной клапан, и отработанные газы покидают цилиндр, давление цилиндра падает (отводится тепло q2);
· 1-а (4 такт) – происходит выталкивание оставшихся в цилиндре газов.
Затем процесс повторяется. Описанный процесс является необратимым (наличие трения, химической реакции в рабочем теле, конечные скорости поршня, теплообмен при конечной разности температур и т.п.).
Для анализа теории тепловых машин термодинамика рассматривает идеальные (обратимые) циклы. Диаграмма идеального процесса ДВС показана на рис.3.14, б. Из диаграммы выводится формула для термического КПД цикла Дизеля:
htД = 1 – 1/eg , (3.25)
где e – степень сжатия (чем выше e, тем выше экономичность ДВС); g – показатель адиабаты.
На рис.3.14, в показана диаграмма идеального цикла ДВС со смешанным подводом теплоты при постоянном объеме:
· 1-2 - чистый воздух с температурой Т1 сжимается до температуры Т2, которая больше температуры воспламенения топлива. В этот момент в цилиндр через форсунки под давлением впрыскивается топливо;
· 2-3 – горючая смесь самовоспламеняется, и к рабочему телу подводится теплота q1/, давление повышается до Р3;
· 3-4 – поршень перемещается обратно, поступление и сгорание топлива продолжается при постоянном давлении и подводится теплота q1//.
· 4-5 – поршень продолжает перемещаться в нижнюю мертвую точку, давление падает (адиабатное расширение);
· 5-1 – процесс отвода теплоты q2 при постоянном объеме (через выпускной клапан покидают отработанные газы).
Термический КПД цикла Тринклера определяется по формуле:
htТ = l – (l·rg – 1) / eg-1·[(l - 1) + g·l·(r – 1)] . (3.26)
Циклы Дизеля широкое применение не нашли, так как у этих циклов очень большой коэффициент сжатия.
Циклы газотурбинных установок (ГТУ).Основными недостатками поршневых ДВС являются ограничение по мощности и невозможность адиабатного расширения рабочего тела до атмосферного давления, которые отсутствуют в газотурбиннных установках. В ГТУ рабочим телом являются продукты сгорания жидкого или газообразного топлива.
На рис.3.15, а дана схема ГТУ со сгоранием топлива при постоянном давлении. Топливным насосом 5 и компрессором 4 топливо и воздух через форсунки 6 и 7 поступают в камеру сгорания 1. Из камеры продукты сгорания направляются в комбинированные сопла 2, где они расширяются, и поступают на лопатки газовой турбины 3. На рис.3.15, б, в представлен идеальный цикл ГТУ на PV и TS диаграммах.

| 
|

|
| а) | б) | в) |
| Рис. 3.15. Схема (а) и идеальный цикл ГТУ на PV (б) и TS (в) диаграммах | ||
На рис. 3.15, б:
· 1-2 – адиабатное сжатие до давления Р2;
· 2-3 – подвод теплоты q1 при постоянном давлении Р2 (сгорание топлива);
· 3-4 – адиабатное расширение до первоначального давления Р1;
· 4-1 – охлаждение рабочего тела при постоянном давлении Р1 (отвод теплоты q2).
Характеристиками цикла являются:
· степень повышения давления: l = Р2/ Р1 ;
· степень изобарного расширения: r = n3 /n2 .
Работа турбины: lт= h3 – h4 .
Работа компрессора: lк= h2 – h1 .
Полезная работа ГТУ равна разности работ турбины и компрессора:
lГТУ = lт – lк . (3.27)
Термический КПД цикла ГТУ:
htГТУ = 1 – 1/ l (g-1)/g . (3.28)
Теоретическая мощность газовой турбины, компрессора и установки (ГТУ):
Nт = lт·D/3600 = (h3 – h4)·D/3600;
Nк = lк·D/3600 = (h2 – h1)·D/3600;
NГТУ = lГТУ·D/3600 = [(h3 – h4)–(h2 – h1)]·D/3600 . (3.29)
Действительный цикл ГТУ отличается от теоретического цикла наличием потерь на трение и вихреообразование в турбине и компрессоре. Эффективными методами повышения экономичности ГТУ являются: регенерация теплоты, ступенчатое сжатие и расширение рабочего тела и пр.
Дата добавления: 2018-04-04; просмотров: 607; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
